Свойства и структура воды
Свойства и структура воды
ОглавлениеВведениеГлава 1. МОЛЕКУЛА h3O Энергия образования молекулы Полная энергия молекулы § 3. РАЗМЕРЫ И ФОРМА § 4. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА § 5. КОЛЕБАТЕЛЬНЫЕ ЧАСТОТЫ МОЛЕКУЛЫ ЗАКЛЮЧЕНИЕ Глава 2. СВОЙСТВА ПАРА Исследования межмолекулярных сил отталкивания § 2. УРАВНЕНИЯ СОСТОЯНИЯ РЕАЛЬНОГО ГАЗА Вириальная форма уравнения состояния Эмпирическое уравнение состояния § 3. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА Термодинамические функции Зависимость термодинамических функций от P и T § 4. ВЯЗКОСТЬ Глава 3. СВОЙСТВА ЛЬДОВ § 1. ЛЕД Пластическая деформация монокристалла льда I Диэлектрические свойства льда 1 Электропроводность льда Самодиффузия Спектральные свойства льда I Теплоемкость льда I § 2 ДРУГИЕ ЛЬДЫ Термодинамические свойства льдов Диэлектрические свойства Спектральные свойства ЗАКЛЮЧЕНИЕ Глава 4.  ВОДОРОДНАЯ СВЯЗЬ ВОДОРОДНАЯ СВЯЗЬ§ 2. СВОЙСТВА АТОМОВ, ОБРАЗУЮЩИХ ВОДОРОДНУЮ СВЯЗЬ § 3. МЕТОДЫ ВЫЧИСЛЕНИЯ ЭНЕРГИИ § 4. ПОЛУЭМПИРИЧЕСКИЕ ПОТЕНЦИАЛЬНЫЕ ФУНКЦИИ § 5. ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ЭНЕРГЕТИЧЕСКИХ ХАРАКТЕРИСТИК ВОДОРОДНОЙ СВЯЗИ ЗАКЛЮЧЕНИЕ Глава 5. ЖИДКОЕ СОСТОЯНИЕ § 1. РАЗЛИЧНЫЕ ПОДХОДЫ К РЕШЕНИЮ ПРОБЛЕМЫ ЖИДКОГО СОСТОЯНИЯ § 2. СТРУКТУРА ЖИДКОСТИ § 3. ПЛАВЛЕНИЕ Глава 6. СВОЙСТВА ЖИДКОЙ ВОДЫ § 2. СПЕКТРАЛЬНЫЕ ДАННЫЕ § 3. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА Теплоемкость Зависимость … от V (молекулярный объем) Зависимость объема и его производных от температуры § 4. СТАТИСТИЧЕСКАЯ ДИЭЛЕКТРИЧЕСКАЯ ПОСТОЯННАЯ Вязкость Теплопроводность Самодиффузия § 6. НЕКОТОРЫЕ ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ПРОЦЕССОВ МОЛЕКУЛЯРНОГО ВЗАИМОДЕЙСТВИЯ Молекулярное рассеяние света Вода как самодиссоциирующая среда § 7. ВОДА D2O ЗАКЛЮЧЕНИЕ ЛИТЕРАТУРА |
Глава 4.
 1. Свойства воды | BookOnLime
1. Свойства воды | BookOnLimeОписание свойств воды начинают, обычно, с характеристики аномалий, присущих воде – самому распространенному и, вместе с тем, самому загадочному и необычному веществу на земле. Причем практически каждое из этих аномальных свойств имеет важное значение для обеспечения жизнедеятельности на земле. Необычные свойства воды особенно ярко выделяются на фоне свойств ее гомологов: h3S, h3Se, h3Te. Молекула воды является самым первым и легким представителем этого гомологического ряда, однако гидриды серы, селена и теллура при комнатной температуре, в отличие от воды, находятся в газообразном состоянии (рис. 23).
И вода, если бы она была обычным членом гомологического ряда, должна в соответствии со своей молекулярной массой закипать при температуре –70 оС и превращаться в лед при температуре –90 оС, а значит, не могла бы быть основой жизни на земле.
Рис. 23. Точки плавления и кипения гидридов VI группы Периодической системы элементов
Другая особенность воды – это аномальное изменение плотности в зависимости от температуры (рис. 24). В обычных жидкостях плотность всегда уменьшается с ростом температуры. Для воды характер изменения плотности в зависимости от температуры другой – после таяния льда плотность увеличивается, проходит через максимум при температуре 4 оС, а затем уменьшается с ростом температуры.
24). В обычных жидкостях плотность всегда уменьшается с ростом температуры. Для воды характер изменения плотности в зависимости от температуры другой – после таяния льда плотность увеличивается, проходит через максимум при температуре 4 оС, а затем уменьшается с ростом температуры.
Рис. 24. Зависимость плотности воды от температуры
Жидкая вода имеет максимум плотности не в точке плавления, а при температуре 4 оС и ее плотность уменьшается, как при повышении температуры, так и при ее понижении до температуры возможного переохлаждения, равной – 40 оС (при 1 атмосфере). При этом плотность воды больше плотности льда на 10%, благодаря чему лед плавает на поверхности воды. При температуре 4 оС вода уменьшается в объеме до минимальных значений, а при дальнейшем понижении температуры от 4 оС до 0 оС расширяется (рис. 25).
Рис. 25. Зависимость молярного объема воды и льда от температуры
Минимум объема воды при температуре 4 оС обусловлен, по мнению Зацепиной Г. Н., особенностью межмолекулярного взаимодействия системы Н2О, в которой число межмолекулярных переходов протонов равно числу внутримолекулярных переходов. Вода, превращаясь в лед, благодаря увеличению объема приобретает огромную силу, способность разрушать крепчайшие породы и, вместе с тем это спасает нашу планету от оледенения. Так как максимум плотности при 4 оС предотвращает конвективное перемешивание жидкости и опускание на дно поверхностных слоев воды, остывших до температуры ниже 4 оС, что замедляет дальнейшее охлаждение и промерзание водоемов.
Н., особенностью межмолекулярного взаимодействия системы Н2О, в которой число межмолекулярных переходов протонов равно числу внутримолекулярных переходов. Вода, превращаясь в лед, благодаря увеличению объема приобретает огромную силу, способность разрушать крепчайшие породы и, вместе с тем это спасает нашу планету от оледенения. Так как максимум плотности при 4 оС предотвращает конвективное перемешивание жидкости и опускание на дно поверхностных слоев воды, остывших до температуры ниже 4 оС, что замедляет дальнейшее охлаждение и промерзание водоемов.
Морская вода, в отличие от пресной ведет себя иначе. Наличие различных солей меняет ее физико-химические свойства. Она замерзает при – 1,9 оС (переохлажденная вода) и имеет максимальную плотность при – 3,5 оС, то есть она превращается в лед, не достигая наибольшей плотности. Переохлажденная вода, то есть остающаяся в жидком состоянии ниже точки замерзания 0 оС, ведет себя странно, с одной стороны плотность воды сильно уменьшается по мере переохлаждения, но, с другой стороны она приближается к плотности льда при понижении температуры.
Другая аномалия воды – необычное поведение ее сжимаемости, то есть уменьшение объема при увеличении давления. Для обычных жидкостей сжимаемость растет с температурой – при высоких температурах жидкости более рыхлы, имеют меньшую плотность, их легче сжать. Вода так ведет себя при высоких температурах выше 50 оС. При низких температурах, от 0 оС до 45 оС сжимаемость воды меняется противоположным образом, в результате при температуре 45 оС появляется минимум. Изотермическая сжимаемость воды при температуре 0 оС в четыре раза больше, чем изотермическая сжимаемость льда (рис. 26).
Рис. 26. Зависимость сжимаемости воды от температуры
Максимальное изменение сжимаемость испытывает при плавлении. Сжимаемость воды и льда мала по сравнению со сжимаемостью других веществ (табл.4.1.1).
Таблица 4.1.1. Сжимаемость ряда веществ в интервале температур от 5 оС до 30 оС
Температура, оС | βs ·1012, дин/см2 | ||
| Вода | Метанол | Бензин | |
5 | 51,6 | – | 84,2 |
10 | 48,7 | 114,9 | 88,5 |
15 | – | 118,8 | 92,2 |
25 | 46,6 | 122,7 | 95,6 |
30 | 45,8 | 131,0 | 103,1 |
Указание особенности изменения сжимаемости воды и льда объясняют характером водородных связей в них.
Самая сильная аномалия воды – это температурная зависимость ее теплоемкости. Величина теплоемкости показывает, сколько нужно затратить тепла, чтобы поднять температуру вещества на один градус. При нагревании вещества теплоемкость, как правило, возрастает для всех веществ, кроме воды. Изменение теплоемкости воды с повышением температуры аномально – от 0 оС до 37 оС она падает и от 37 оС до 100 оС начинает повышаться.
Таблица 4.1.2. Теплоемкость веществ в трех агрегатных состояниях
Агрегатное состояние | |||||||
Н2О | Nh4 | Ch5 | HCl | h3 | Hg | Na | |
газообразное | 8,75 | 9,9 | – | 6,7 | 6,9 | – | 5,0 |
жидкое | 18,0 | 12,0 | 11,0 | 12,0 | 11,0 | 6,8 | 7,6 |
твердое | 9,0 | 9,0 | 14,0 | 15,0 | 13,0 | 6,7 | 8,0 |
Вода же при плавлении льда меняет теплоемкость в два раза, такого огромного скачка при плавлении не наблюдается ни у одного вещества. Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная.
Теплоемкость льда имеет очень низкое значение, она близка к теплоемкости одноатомных кристаллов и равна теплоемкости твердого аммиака. В процессе плавления металлов теплоемкость практически не изменяется, для веществ из многоатомных молекул в процессе плавления она, как правило, уменьшается, что, вероятно, связано с тем, что молекулы могут свободно вращаться в жидкости, и не могут в твердом теле. Для таких соединений как Н2О и Nh4 теплоемкость в жидком состоянии много больше, чем в твердом состоянии. Это означает, что в воде открываются какие-то новые, энергоемкие процессы, на которые тратится подводимое тепло, что и обуславливает появление избыточной теплоемкости, причем это характерно для всего диапазона температур, при которых вода находится в жидком состоянии. Эта аномалия исчезает только в паре, то есть это свойство именно жидкой воды. Для переохлажденной воды теплоемкость еще больше возрастает при сильном переохлаждении, то есть переохлажденная вода еще более аномальна, чем обычная. Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Высокая теплоемкость воды и высокая удельная теплота плавления среди простых веществ (лед трудно растопить, а воду заморозить) способствуют смягчению климата на земле, не происходит резкого перепада температур зимой и летом, ночью и днем, поскольку существует гигантский регулятор, своеобразный термостат – воды Мирового океана.
Другой величиной, которая определяет характер теплового движения в жидкостях, является теплопроводность. Зависимость изменения теплопроводности воды от температуры приведена на рисунке 26. Для сравнения приведено изменение теплопроводности четыреххлористого углерода, который ведет себя, как обычная жидкость, то есть с ростом температуры уменьшается теплопроводность и растет теплоемкость. Как видно из рисунка 27, теплопроводность при плавлении льда уменьшается приблизительно в четыре раза. Переохлажденная вода имеет тот же характер изменения теплопроводности, что и обычная.
Рис. 27. Зависимость теплопроводности воды и четыреххлористого углерода от температуры
Все нормальные жидкости с ростом давления изменяют знак зависимости теплопроводности от температуры. Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
Теплопроводность воды не изменяет характера температурной зависимости под давлением. Относительная величина увеличения теплопроводности воды при давлении 1200 кг/см2 составляет около 50%, в то время как для нормальных жидкостей это увеличение при том же давлении составляет приблизительно 270%. Теплопроводность воды слабо зависит от давления, что связано с малой сжимаемостью воды по сравнению с другими жидкостями.
И, наконец, еще одно удивительное свойство воды, связанное с особенностями ее поверхностного натяжения. Вода в свободном состоянии принимает шарообразную форму (капли дождя, росы). На границе двух сред (вода-воздух) силы межмолекулярного притяжения действуют с одной стороны, стягивая поверхность жидкости. На структуру поверхностного слоя воды влияет два фактора – полярность молекул воды и сетка водородных связей. Поверхностное натяжение воды 72 мн/м (миллиньютон/метр). Это поверхностное натяжение настолько велико, что смоченные водой две пластинки из стекла удается разъединить только с помощью огромных усилий. Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Из всех известных жидкостей силы поверхностного натяжения воды по своей величине уступают только ртути (около 500 мн/м).
Рис. 28. Зависимость сдвиговой вязкости от температуры для воды и четыреххлористого углерода
Еще одно аномальное свойство воды – ее вязкость. Обычные жидкости с повышением давления увеличивают вязкость, а с ростом температуры уменьшают. Характер изменения вязкости у воды другой. На рисунке 28 представлена зависимость вязкости от температуры для воды и четыреххлористого углерода. Как видно из рисунка вязкость четыреххлористого углерода до температуры около 23 оС меньше, чем у воды, а для больших температур она больше, чем у воды.
Зависимость вязкости от давления для разных температур приведена на рисунке 29, из которой следует, что для низких температур с ростом давления вплоть до 2000 атм вязкость воды уменьшается, а затем начинает расти и при температуре 100 оС кривая близка по характеру зависимости для обычных жидкостей.
Рис. 29. Зависимость сдвиговой вязкости от давления для ряда температур
Зависимость сдвиговой вязкости от давления для ряда температур
Увеличение вязкости для них с ростом давления связано с уменьшением длины свободного пробега молекул, так как при большем давлении они плотнее упакованы. Как видно из приведенных характеристик, вода действительно является необычной, аномальной жидкостью и природа этих аномалий кроется в особенностях ее структуры.
Плотность воды | Геологическая служба США
• Школа наук о воде ГЛАВНАЯ • Темы свойств воды •
Плотность воды
Если вы еще учитесь в школе, вы, вероятно, слышали это утверждение на уроках естествознания: » Плотность – это масса единица объема вещества». На Земле вы можете предположить, что масса равна весу, если это упрощает задачу.
Если вы еще не учитесь в школе, то вы, вероятно, забыли, что вообще когда-либо слышали это. Определение плотности имеет гораздо больше смысла с небольшим объяснением. Пока объект состоит из молекул и, следовательно, имеет размер или массу, он имеет плотность.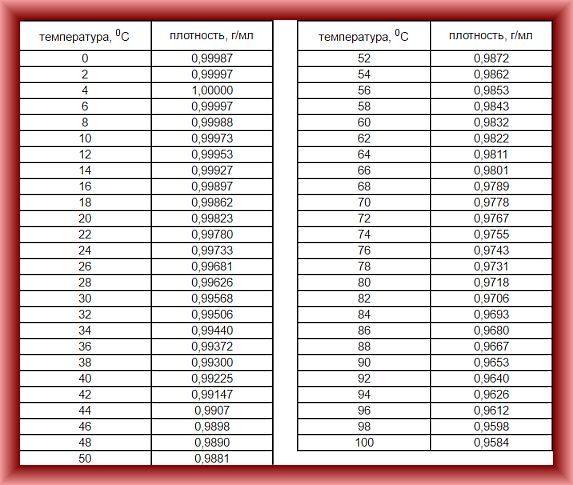 Плотность — это просто вес выбранного количества (объема) материала. Общепринятой единицей измерения плотности воды является грамм на миллилитр (1 г/мл) или 1 грамм на кубический сантиметр (1 г/см 9 ).0013 3 ).
Плотность — это просто вес выбранного количества (объема) материала. Общепринятой единицей измерения плотности воды является грамм на миллилитр (1 г/мл) или 1 грамм на кубический сантиметр (1 г/см 9 ).0013 3 ).
На самом деле точная плотность воды на самом деле не 1 г/мл, а немного меньше (очень, очень немного меньше), 0,9998395 г/мл при 4,0° Цельсия (39,2° по Фаренгейту). Однако чаще всего вы будете видеть округленное значение 1 г/мл.
Плотность воды зависит от температуры
Расти со старшим братом было трудно, особенно когда к нему приходили его друзья, потому что их любимым занятием было думать о том, как насолить мне. Однако однажды я смог использовать плотность воды, чтобы, по крайней мере, подшутить над ними. В один из жарких летних дней они забрались на огромный холм рядом с нашим домом, чтобы выкопать яму, чтобы спрятать свою коллекцию бутылочных крышек. Им захотелось пить, и они заставили меня вернуться домой и принести им галлон воды. Этот галлон водопроводной воды при температуре 70°F весил 8,329.фунтов, что было много для 70-фунтового ребенка, чтобы подняться на огромный холм.
Этот галлон водопроводной воды при температуре 70°F весил 8,329.фунтов, что было много для 70-фунтового ребенка, чтобы подняться на огромный холм.
Итак, когда они потребовали еще галлон воды, я заглянул в «Интернет» того дня — энциклопедию — и узнал, что галлон воды с температурой кипения весит всего 7,996 фунта! Я взбежал на холм, неся свой галлон воды, который весил на 0,333 фунта меньше; и побежали вниз еще быстрее, их сердитые голоса затихли позади меня.
| Температура (°F/°C) | Плотность (грамм/см 3 | Вес (фунт/фут 3 |
|---|---|---|
| 32°F/0°C | 0,99987 | 62.416 |
| 39,2°F/4,0°C | 1.00000 | 62.424 |
| 40°F/4,4°C | 0,99999 | 62.423 |
| 50°F/10°C | 0,99975 | 62.408 |
| 60°F/15,6°C | 0,99907 | 62. 366 366 |
| 70°F/21°C | 0,99802 | 62.300 |
| 80°F/26,7°C | 0,99669 | 62.217 |
| 90°F/32,2°C | 0,99510 | 62.118 |
| 100°F/37,8°C | 0,99318 | 61,998 |
| 120°F/48,9°C | 0,98870 | 61.719 |
| 140°F/60°C | 0,98338 | 61.386 |
| 160°F/71,1°C | 0,97729 | 61.006 |
| 180°F/82,2°C | 0,97056 | 60.586 |
| 200°F/93,3°C | 0,96333 | 60.135 |
| 212°F/100°C | 0,95865 | 59.843 |
Источник: Министерство внутренних дел США, Бюро мелиорации, 1977 г., Руководство по грунтовым водам , с
The Water Encyclopedia, Third Edition, Hydrological Data and Internet Resources, Edited Pedro Fierro, Jr.
and Evan K. Nyler, 2007
Лед менее плотный, чем вода
Если вы посмотрите на это изображение, вы увидите, что некоторые айсберга находится ниже уровня воды. Это не удивительно, но на самом деле почти весь объем айсберга находится ниже ватерлинии, а не над ней. Это связано с тем, что плотность льда меньше плотности жидкой воды. При замерзании плотность льда уменьшается примерно на 9процент.
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Большая часть айсберга находится ниже поверхности воды. Лучший способ представить себе, как вода может иметь разную плотность, — это посмотреть на замерзшую воду. Лед на самом деле имеет совсем другую структуру, чем жидкая вода, в которой молекулы выстраиваются в правильную решетку, а не более беспорядочно, как в жидкой форме. Бывает, что решетчатое устройство позволяет молекулам воды быть более разбросанными, чем в жидкости, и, таким образом, лед менее плотен, чем вода. Опять же, к счастью для нас, так как мы не услышали бы восхитительного звона кубиков льда о стенку стакана, если бы лед в нашем чае со льдом опустился на дно. Плотность льда около 90 процентов по сравнению с водой, но это может варьироваться, потому что лед также может содержать воздух. Это означает, что около 10 процентов ледяного куба (или айсберга) будет находиться над ватерлинией.
Опять же, к счастью для нас, так как мы не услышали бы восхитительного звона кубиков льда о стенку стакана, если бы лед в нашем чае со льдом опустился на дно. Плотность льда около 90 процентов по сравнению с водой, но это может варьироваться, потому что лед также может содержать воздух. Это означает, что около 10 процентов ледяного куба (или айсберга) будет находиться над ватерлинией.
Это свойство воды имеет решающее значение для всей жизни на Земле. Поскольку вода при температуре около 39 ° F (4 ° C) более плотная, чем вода при 32 ° F (0 ° C), в озерах и других водоемах более плотная вода опускается ниже менее плотной воды. Если бы вода была наиболее плотной в точке замерзания, то зимой очень холодная вода на поверхности озер опускалась бы, озеро могло бы замерзнуть снизу вверх. А поскольку вода является таким хорошим изолятором (из-за ее теплоемкость ), некоторые замерзшие озера летом могут не полностью оттаять.
Реальное объяснение плотности воды на самом деле более сложное, поскольку плотность воды также зависит от количества растворенного в ней вещества. Вода в природе содержит минералы, газы, соли и даже пестициды и бактерии, некоторые из которых растворены. Чем больше вещества растворяется в галлоне воды, тем больше этот галлон будет весить и становиться более плотным — океанская вода плотнее чистой воды.
Вода в природе содержит минералы, газы, соли и даже пестициды и бактерии, некоторые из которых растворены. Чем больше вещества растворяется в галлоне воды, тем больше этот галлон будет весить и становиться более плотным — океанская вода плотнее чистой воды.
Источники/использование: общественное достояние.
Тяжелые кубики льда опускаются на дно стакана с водой, а обычные плавают.Авторы и права: Майк Уокер
Мы говорили, что лед плавает на воде, но как насчет «тяжелого льда»?
Мы уже говорили, что лед плавает на воде, потому что он менее плотный, но лед особого вида может быть более плотным, чем обычная вода. «Тяжелый лед» на 10,6% плотнее обычной воды, потому что лед состоит из «тяжелой воды». Тяжелая вода, Д 2 O вместо H 2 O — это вода, в которой оба атома водорода заменены дейтерием, изотопом водорода, содержащим один протон и один нейтрон. Тяжелая вода действительно тяжелее обычной воды (которая естественным образом содержит небольшое количество молекул тяжелой воды), и лед из тяжелой воды тонет в обычной воде.
Измерение плотности
Источники/использование: общественное достояние.
Ареометр используется для измерения плотности жидкости. Прибор для измерения плотности жидкости называется ареометром. Это одно из самых простых научно-измерительных устройств, и вы даже можете сделать его сами из пластиковой соломинки (см. ссылки ниже). Однако чаще он сделан из стекла и очень похож на термометр. Он состоит из цилиндрического стержня и утяжеленной груши на дне, чтобы держать его в вертикальном положении. Ареометр осторожно опускают в измеряемую жидкость до тех пор, пока ареометр не начнет свободно плавать. На устройстве есть выгравированные или отмеченные линии, чтобы пользователь мог видеть, насколько высоко или низко плавает ареометр. В менее плотных жидкостях ареометр будет плавать ниже, а в более плотных — выше. Поскольку вода является «стандартом», по которому измеряются другие жидкости, отметка для воды, вероятно, обозначена как «1. 000»; следовательно, удельный вес воды при температуре около 4°C равен 1.000.
000»; следовательно, удельный вес воды при температуре около 4°C равен 1.000.
Ареометры имеют множество применений, не последним из которых является измерение солености воды на уроках естествознания в школах. Они также используются в молочной промышленности для оценки содержания жира в молоке, поскольку молоко с более высоким содержанием жира будет менее плотным, чем молоко с меньшим содержанием жира. Ареометры часто используются людьми, которые делают пиво и вино дома, поскольку они показывают, сколько сахара находится в жидкости, и позволяют пивовару узнать, как далеко зашел процесс брожения.
Сделайте свой собственный ареометр:
- Научно-ярмарочный проект «Ареометр»
- Изготовление и использование ареометра
Источники/Использование: Некоторое содержимое может иметь ограничения. Посетите СМИ, чтобы узнать подробности.
Как вы думаете, много ли вы знаете о свойствах воды?
Пройдите наш интерактивный тест на определение истинности/неверности свойств воды и проверьте свои знания о воде.
Калькулятор плотности воды | Будет ли он плавать или тонет?
, созданный Wojciech SAS, PhD
, рассмотрено Bogna Szyk and Jack Bowater
на основе исследований
Millero F J, Chen C-T, Bradshaw A, Schleicher K «Новое высокое уравнение высокого давления для морского вода« Глубоко Sea Research Part A. Документы по океанографическим исследованиям (апрель 1980 г.)
Последнее обновление: 13 февраля 2023 г.
Содержание:- Какова плотность воды?
- Единицы плотности воды
- Температурная зависимость плотности воды
- Плотность соленой воды
- Как пользоваться калькулятором плотности воды?
- Должны ли яйца всплывать или тонуть?
- Скорость звука в воде
С помощью этого калькулятора плотности воды вы можете быстро оценить плотность соленой воды. В этом тексте вы найдете ответ на вопрос «Какова плотность воды?» и как она изменяется в зависимости от температуры, солености или давления .
Задумывались ли вы когда-нибудь, какова связь между плотностью воды в кг/м³ , плотность воды в г/мл , плотность воды в фунт/фут³ ? Должны ли яйца плавать или тонуть в соленой воде? Читайте дальше, чтобы найти ответы и на эти вопросы!
🙋 Если вы хотите добраться до неба, вас также может заинтересовать наш калькулятор плотности воздуха.
Какова плотность воды?
Плотность воды (или любого другого вещества) равна отношению ее массы m к ее объему V . Обычно мы обозначаем плотность с помощью символа ρ , поэтому формула для плотности:
ρ = m / V .
Оказывается, плотность большинства веществ не постоянна, а изменяется при изменении внешних параметров, таких как температура или давление.
Единицы измерения плотности воды
Существуют различные единицы измерения плотности воды. Допустима любая комбинация единиц массы и единиц объема, но некоторые из них более распространены, чем другие. Наиболее часто используемые единицы измерения:
Наиболее часто используемые единицы измерения:
- [кг/м³] – килограмм на кубический метр;
- [lb/ft³] – фунт на кубический фут;
- [г/мл] или [г/см³] – грамм на миллилитр или грамм на кубический сантиметр, которые эквивалентны друг другу.
Плотность воды в кг/м3 в 1000 раза больше плотности воды в г/см3 и примерно в 16,018 раза меньше плотности воды в фунт/фут3 9 0004 . Если вас интересуют различные единицы плотности и вы хотите узнать их соотношение, попробуйте наш конвертер плотности.
Температурная зависимость плотности воды
Вы, наверное, знаете о явлении изменения плотности воды при различных температурах, даже если никогда не задумывались об этом с научной точки зрения; Вы когда-нибудь задумывались, почему лед плавает? Это изменение в основном вызвано тепловым расширением, когда одно и то же количество вещества занимает все больше и больше места по мере повышения температуры. В результате масса остается постоянной, но объем увеличивается, что приводит к уменьшению плотности .
В результате масса остается постоянной, но объем увеличивается, что приводит к уменьшению плотности .
Качественно это довольно просто, но с математической точки зрения оценка результата — это отдельная история. У воды есть интригующее свойство: она достигает максимальной плотности примерно при 4 °C или 40 °F .
Хотя существуют таблицы плотности чистой воды между точкой замерзания воды ( 0 °C или 32 °F ) и ее точкой кипения ( 100 °C или 212 °F ), не существует простая формула, которая дает точное значение для данной температуры. Чтобы обойти это, наш калькулятор плотности воды использует приблизительное уравнение, основанное на 5 TH Заказ Полином:
ρ (t) = ρ₀ + (a₁ × t) — (a₂ × t²) + (a₃ × t³) — (a₄ × t⁴) + (a₅ × t⁵) ,
, где температура T находится в °C , а значения коэффициентов следующие:
- ρ₀ = 999,83311 кг/м³ ;
- a₁ = 0,0752 кг/(м³·°C) ;
- a₂ = 0,0089 кг/(м³·°C²) ;
- a₃ = 7,36413 × 10⁻⁵ кг/(м³·°C³) ;
- а₄ = 4,74639× 10⁻⁷ кг/(м³·°C⁴) ; и
- a₅ = 1,34888 × 10⁻⁹ кг/(м³·°C⁵) .

Мы используем экспоненциальное представление, чтобы более четко выразить все малые значения. Хотя результат является приблизительным, он обеспечивается с достаточной точностью.
💡 Знаете ли вы, что температура кипения также зависит от давления? Проверьте наш калькулятор точки кипения, чтобы узнать больше об этом!
Плотность соленой воды
Смесь воды и соли, далее именуемая соленой водой, имеет плотность, отличную от плотности чистой воды. Основной параметр, который говорит нам о количестве соли в соленой воде, равен 9.0003 соленость, S , заданная как:
S = m₁ / (m₁ + m₀) ,
, где m₀ — масса чистой воды и m ₁ – масса соли. Другими словами, смешивание массы чистой воды м₀ с массой соли м₁ дает соленость S соленой воды. Это количество обычно дается в промилле ‰ , частях на тысячу (ppt) или практических единицах солености (psu), которые в основном эквивалентны.
В нашем калькуляторе плотности воды мы используем метод, предложенный Миллеро и его коллегами. Общая формула сложна, поэтому мы не будем показывать ее здесь явно. Тем не менее, в целом, в нем используется та же концепция, что и в уравнении температурной зависимости плотности – полином смешанных членов температуры, солености и давления:
ρ(T,S,p) = ρ(T) + f (Т,С,р) .
Здесь ρ(T) — плотность чистой воды, полученная из предыдущей главы.
Однако мы можем выделить некоторые общие свойства – плотность соленой воды увеличивается при более высокой солености и внешнем давлении .
Как пользоваться калькулятором плотности воды?
Какова плотность воды при 20 °C солености S = 35‰ и под давлением 1 атм ? Давайте попробуем наш калькулятор плотности воды и узнаем!
- Установите температуру на 20 °C .
- Установить соленость на 35‰ .

- Установите давление на 1 атм .
- И все! Плотность соленой воды 1024,9 кг/м³ .
Одинаковая плотность воды: 1,0249 г/мл или 63,982 фунт/фут³ .
Но это еще не конец! Проведите дома собственный эксперимент — возьмите несколько предметов с неизвестной плотностью (но более или менее равной значению плотности воды, т. е. 1000 кг/м³ ). Хотя изменить внешнее давление сложно, можно создать жидкость с известной соленостью и контролировать ее температуру. Проверьте расширенный режим, чтобы увидеть сколько чистой воды и соли нужно для получения соленой воды с удельной плотностью .
Вы можете начать с нагрева смеси (например, в микроволновой печи), а затем погрузить в нее предметы. Вы можете быстро оценить температуру воды, пока она остывает. Вначале плотность горячей воды довольно высока, поэтому все должно утонуть, но в какой-то момент плотность уменьшится до такой степени, что объект начнет плавать! Введите значения солености и температуры, при которых объект начал плавать, в калькулятор плотности воды, и вы сможете оценить эти плотности с относительно хорошей точностью!
Вы также можете выбрать один из объектов из списка, чтобы увидеть, плавает он или тонет. Мы учитываем некоторые средние значения, поэтому результаты могут быть точными не во всех случаях (особенно для фруктов).
Мы учитываем некоторые средние значения, поэтому результаты могут быть точными не во всех случаях (особенно для фруктов).
Должны ли яйца всплывать или тонуть?
Ну, самый точный ответ: зависит!
Во-первых, есть разница между свежими и тухлыми яйцами. При варке яйца вы можете положить его в чистую теплую воду, прежде чем проверить его, открыв его. Если тонет, то должен быть свежим, а если всплывает, то, скорее всего, несвежий . По мере старения яйца внутри образуются некоторые газы (например, сероводород), которые выходят из объекта через поры в скорлупе. В результате масса уменьшается, но объем яйца остается постоянным, поэтому плотность уменьшается.
Второй фактор – соленость воды. При приготовлении пищи мы чаще всего используем чистую или слегка подсоленную воду, поэтому приведенное выше объяснение справедливо. Но если мы поместим яйцо в действительно соленую среду (например, в Мертвое море, соленость которого составляет около 342‰ ), как свежий, так и гнилой сорт будут плавать.

