Как обозначается и в каких единицах измеряется абсолютная температура?
ответьте пж даю 20 ббаллов.
Альпинист поднимается на гору высотой 3500 м. Для каждой физической величины определите характер ее изменения. ФИЗИЧЕСКАЯ ВЕЛИЧИНА А) потенциальная эн … ергия Б) кинетическая энергия В) полная механическая энергия ХАРАКТЕР ИЗМЕНЕНИЯ 1) увеличивается 2) уменьшается 3) не изменяется Пожалуйста, сделайте, дам 50 баллов.
Какая жидкость при приходе в твёрдое состояние получается новой название
векторлык физикалык шамаларды жазыныз пж помогите
Плоская электромагнитная волна, распространяющаяся в диэлектрической среде вдоль оси OX, имеет скорость 2·108 м/с. Уравнение волны имеет вид ζ=0.01·si … n(106·t–k·x). Определите длину волны. Ответ дайте в км с точностью до двух цифр после десятичной точки.
Проводящая сфера радиусом 12 см несет заряд 60 нКл. Определите потенциал электрического поля на расстоянии 30 см от центра сферы, если она погружена в
… масло с диэлектрической проницаемостью, равной 20.
Є два бруски мідний та алюмінієвий об’єм одного з цих брусків на 50 см3 більший, ніж об’єм другого, а маса на 175 г менша, нiж маса другого. Які об’ем … и та маси брусків? Густина мiдi 8900 кг/м, густина алюмінію 2700 кг/м³ 2. З селища А прямою дорогою виїхав велосипедист. Коли він проїхав 12 Тільки можна розписати з дано
Конвертер температуры • Популярные конвертеры единиц • Компактный калькулятор • Онлайн-конвертеры единиц измерения
Конвертер длины и расстоянияКонвертер массыКонвертер мер объема сыпучих продуктов и продуктов питанияКонвертер площадиКонвертер объема и единиц измерения в кулинарных рецептахКонвертер температурыКонвертер давления, механического напряжения, модуля ЮнгаКонвертер энергии и работыКонвертер мощностиКонвертер силыКонвертер времениКонвертер линейной скоростиПлоский уголКонвертер тепловой эффективности и топливной экономичностиКонвертер чисел в различных системах счисления. Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др.
Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др. единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева
единицахКонвертер магнитодвижущей силыКонвертер напряженности магнитного поляКонвертер магнитного потокаКонвертер магнитной индукцииРадиация. Конвертер мощности поглощенной дозы ионизирующего излученияРадиоактивность. Конвертер радиоактивного распадаРадиация. Конвертер экспозиционной дозыРадиация. Конвертер поглощённой дозыКонвертер десятичных приставокПередача данныхКонвертер единиц типографики и обработки изображенийКонвертер единиц измерения объема лесоматериаловВычисление молярной массыПериодическая система химических элементов Д. И. Менделеева
Демонстрация «Горячее стекло» в музее стекла в городе Корнинг, штат Нью-Йорк. Стеклодувы работают со стеклом, нагретым до температур 870–1 040 °C или 1 600–1 900 °F.
Общие сведения
Демонстрация «Горячее стекло» в музее стекла в городе Корнинг, штат Нью-Йорк. Профессиональный стеклодув работает с комком расплавленного стекла на конце стеклодувной трубки. Позже она сделает из него вазу.
Температура — физическая величина, определяющая количество теплоты в теле или материи. Температуру также можно определить как количество кинетической энергии в частицах, составляющих тело или материю. Энергия передается от тел с более высокой температурой к телам более с низкой температурой, пока не будет достигнуто термодинамическое равновесие, то есть, пока температура обоих тел не сравняется. Этот процесс называется теплопередачей. К примеру, если открыть зимой окно, теплый воздух в комнате будет передавать тепло холодному воздуху на улице до тех пор, пока температура воздуха на улице и в комнате не станет одинаковой. В разных материалах тепло передается по-разному, в зависимости от их теплопроводности. Материалы с высокой теплопроводностью нагреваются и охлаждаются быстрее, чем материалы с низкой. Для теплоизоляции, например, в строительстве, используются именно материалы с низкой теплопроводностью.
Температуру также можно определить как количество кинетической энергии в частицах, составляющих тело или материю. Энергия передается от тел с более высокой температурой к телам более с низкой температурой, пока не будет достигнуто термодинамическое равновесие, то есть, пока температура обоих тел не сравняется. Этот процесс называется теплопередачей. К примеру, если открыть зимой окно, теплый воздух в комнате будет передавать тепло холодному воздуху на улице до тех пор, пока температура воздуха на улице и в комнате не станет одинаковой. В разных материалах тепло передается по-разному, в зависимости от их теплопроводности. Материалы с высокой теплопроводностью нагреваются и охлаждаются быстрее, чем материалы с низкой. Для теплоизоляции, например, в строительстве, используются именно материалы с низкой теплопроводностью.
Температуру измеряют с помощью термометра, и самая низкая температура, которая возможна — это –273,15 °C. Эта температура называется абсолютным нулем.
Единицы измерения температуры
Температуру измеряют в градусах, но существуют несколько температурных шкал: Цельсия (°C, самая распространенная шкала в мире), Фаренгейта (°F, используемая в США и некоторых других странах), и Кельвина (К, используемая в физике и других точных науках). Различие между шкалами Цельсия и Кельвина в том, что за ноль принята разная температура. По Цельсию — это температура замерзания воды, в то время как по Кельвину — это абсолютный ноль, то есть –273,15 °C. Шкала Фаренгейта отличается от шкалы Цельсия не только температурой, принятой за ноль, но еще и разницей между величиной одного градуса. Для перевода градусов Цельсия в градусы Фаренгейта используют формулу:
Различие между шкалами Цельсия и Кельвина в том, что за ноль принята разная температура. По Цельсию — это температура замерзания воды, в то время как по Кельвину — это абсолютный ноль, то есть –273,15 °C. Шкала Фаренгейта отличается от шкалы Цельсия не только температурой, принятой за ноль, но еще и разницей между величиной одного градуса. Для перевода градусов Цельсия в градусы Фаренгейта используют формулу:
°C = 5/9 (°F – 32).
Температура замерзания воды равна 32 °F.
В системе СИ используются градусы шкалы Кельвина, называемые кельвинами (К).
Электрический разряд в плазменной лампе
Температура в физике и химии
Агрегатное состояния веществ (плазма, газ, жидкость, или твердое тело) определяется температурой. В любом теле молекулы колеблются, причем при увеличении температуры это движение ускоряется, так же, как и кинетическая энергия этих молекул. Чем больше скорость колебания молекул, тем легче им разойтись на большее расстояние друг от друга. Для каждого агрегатного состояния вещества существует определенный порог расстояния между молекулами.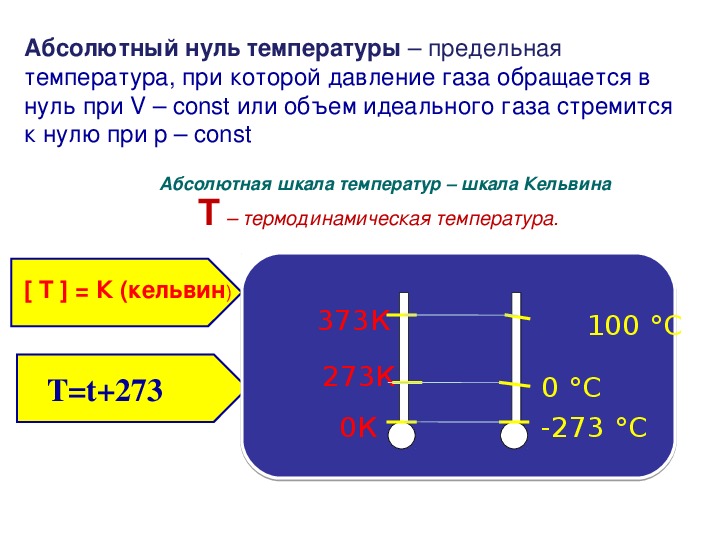 Это расстояние самое маленькое в твердых телах, и самое большое в газах и плазме. Материалы, которые не изменяют агрегатное состояние при высоких температурах, называются огнеупорными материалами. Например, многие керамические смеси огнеупорны, потому что не плавятся при температурах до 1000 °C. Их часто используют на производстве, например в печах с очень высокой температурой. Некоторые материалы плавятся при высокой температуре, в то время как другие материалы, как например, дерево, сгорают. Диапазон температур, при которых вещества могут находиться в состоянии жидкости, невелик. При переходе этого порога, жидкости превращаются в газы. При дальнейшем нагревании, атомы разлагаются на заряженные частицы, ионы и электроны — процесс, называемый ионизацией. Частично или полностью ионизированный газ называется плазмой. Большая часть материи во вселенной находится именно в состоянии плазмы.
Это расстояние самое маленькое в твердых телах, и самое большое в газах и плазме. Материалы, которые не изменяют агрегатное состояние при высоких температурах, называются огнеупорными материалами. Например, многие керамические смеси огнеупорны, потому что не плавятся при температурах до 1000 °C. Их часто используют на производстве, например в печах с очень высокой температурой. Некоторые материалы плавятся при высокой температуре, в то время как другие материалы, как например, дерево, сгорают. Диапазон температур, при которых вещества могут находиться в состоянии жидкости, невелик. При переходе этого порога, жидкости превращаются в газы. При дальнейшем нагревании, атомы разлагаются на заряженные частицы, ионы и электроны — процесс, называемый ионизацией. Частично или полностью ионизированный газ называется плазмой. Большая часть материи во вселенной находится именно в состоянии плазмы.
Температура влияет на электропроводимость веществ и служит катализатором химических реакций. Изменение температуры замедляет или, наоборот, ускоряет их.
Изменение температуры замедляет или, наоборот, ускоряет их.
Тройная точка воды
Тройная точка воды — температура и давление, при которых вода может одновременно и равновесно существовать в виде трёх фаз — в твердом (лед), жидком и газообразном (пар) состояниях. Тройная точка воды — температура 0,01°С (273,16 К) и парциальное давление водяного пара 611,73 Па. При таких условиях для превращения всей воды в пар, лед или жидкое состояние достаточно только чуть-чуть изменить давление или температуру.
Тройная точка воды соответствует минимальному давлению, при котором жидкая вода может существовать. При давлении ниже тройной точки (например, в открытом космосе) твердый лед сублимируется в пар, минуя жидкое состояние. При параметрах выше тройной точки лед при нагревании вначале переходит в жидкое состояние и только потом, при более высоких температурах, вода кипит и испаряется.
Тройная точка воды иногда используется как опорная, например, для калибровки измерительной аппаратуры и термометров.
Кривые потока излучения абсолютно чёрных тел с разной температурой. Источник: wikipedia.org. Автор: 4C
Эффективная температура
Эффективной температурой тела называется температура такого абсолютно черного тела, каждый квадратный сантиметр которого излучает во всем спектре такой же поток, как и квадратный сантиметр данного тела.
Абсолютно черное тело – тело, которое поглощает падающее на него излучение во всем диапазоне спектра.
Такую температуру можно вычислить из закона Стефана-Больцмана, который гласит, что мощность излучения абсолютно черного тела пропорциональна четвертой степени температуры. Так, например, для Земли это значение достигает примерно 250 К, что составляет –23 °C, но с другой стороны известно, что у поверхности Земли температура в среднем выше, в районе +15 °C. Данное несоответствие со значением эффективной температуры объясняется тем, что Земля имеет атмосферу, а значит есть воздействие парникового эффекта, который помогает Земле сохранять тепло. Таким образом значение в 250 К, это температура верхних слоев атмосферы нашей планеты. То есть, эффективная температура Земли — это температура, которая видна из космоса.
Таким образом значение в 250 К, это температура верхних слоев атмосферы нашей планеты. То есть, эффективная температура Земли — это температура, которая видна из космоса.
Зная эффективную температуру звезды, можно узнать к какому спектральному классу она относится, иначе говоря, определить в каком диапазоне длин волн или частот звезда излучает. У Солнца эффективная температура около 6000 К, и максимум энергии излучения приходится на 470 нм, что соответствует зеленой части спектра, а не желтой, как кажется человеческому глазу.
15-метровая рупорно-параболическая антенна, с помощью которой А. Пензиасом и Р. Вильсоном было зарегистрировано реликтовое излучение. За это открытие им была вручена Нобелевская премия. Источник: НАСА
Температура во Вселенной
В астрономии используется очень широкий диапазон значений температур — от невероятно низких до очень высоких.
Например, реликтовое излучение – остаточное электромагнитное излучение, возникшее в следствие Большого взрыва, имеет эффективную температуру всего лишь 2,7 К — значение очень близкое к абсолютному нулю.
Сравнение размеров Солнца и голубого сверхгиганта — звезды Альнитак. Источник: wikipedia.org. Автор: CWitte
Напротив, температуры звезд могут достигать высоких значений более 40000 К. Такие звезды, как правило, имеют большие радиусы, измеряющиеся в десятках радиусов Солнца. Примером такой звезды является Альнитак А – голубой сверхгигант в созвездии Ориона с диаметром в 20 раз больше солнечного.
Еще более высокие температуры можно встретить в ядрах звезд, так как для того, чтобы там протекали термоядерные реакции, требуются колоссальные значения температур. Например, чтобы произошла реакция превращения более легких элементов в более тяжелые, нужно, чтобы ядра имели высокую кинетическую энергию. Следовательно, и высокую температуру. У нашего Солнца в ядре значение температуры достигает 15 000 000 К.
Температура в биологии
Типичная температура тела японского пятнистого оленя Cervus nippon равна 313ºK или 39.8ºC. Парк Нара в городе Нара (Япония) у подножия горы Вакакуса.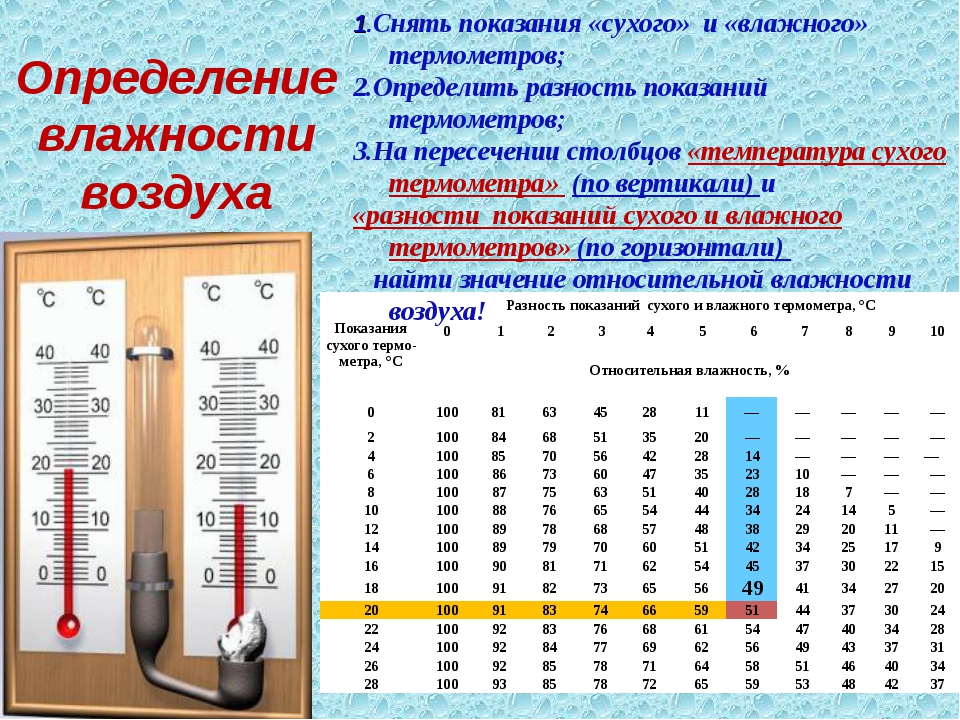
Температура влияет на жизненные процессы всех живых существ. Сложные организмы обычно регулируют температуру тела, и стараются поддерживать одинаковую температуру. Температура используется животными как защитный механизм. Например, чтобы избавиться от бактерий и вирусов, у людей поднимается температура выше, чем эти инородные тела могут перенести. А грызуны и некоторые другие млекопитающие, такие как медведи, понижают температуру, тем самым замедляя обмен веществ, дыхание, и сердцебиение, впадая в спячку. Замедленный обмен веществ позволяет животным выжить с меньшими затратами энергии, чем в обычном состоянии. Этот защитный механизм предназначен для того, чтобы пережить время, когда недостаточно или вообще нет еды. Примеры таких замедлений жизнедеятельности — зимняя и летняя спячки. Температура тела у некоторых животных, впадающих в спячку, опускается очень низко, иногда ниже 0°C. Например, у некоторых видов сусликов, проживающих в арктических регионах, температура тела в районе брюшной полости понижается до –2,9°C.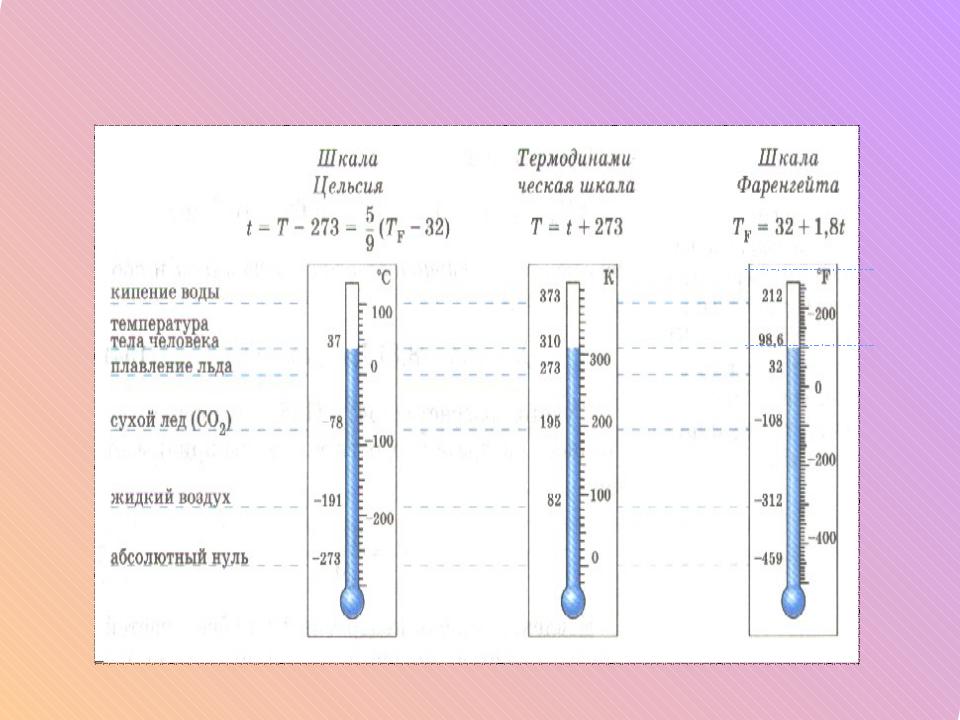 Растения также могут находиться в состоянии покоя во время зимних холодов.
Растения также могут находиться в состоянии покоя во время зимних холодов.
Анабиоз
Анабиоз — состояние организма, в котором замедлены жизненные процессы почти до состояния смерти. Организм сам может перейти в такое состояние, но анабиоз также можно инициировать при понижении температуры окружающей среды, и другими способами. Некоторые организмы находятся в естественном состоянии анабиоза во время определенных периодов их жизни. Состояние анабиоза граничит со смертью, но исследования показали, что животных в этом состоянии можно вернуть к жизни без повреждения нервных клеток и тканей. Ученые надеются, что в ближайшем будущем это будет возможно и для людей. Надежда заключается в том, что анабиоз позволит оказывать первую медицинскую помощь и спасать людей с травмами и заболеваниями, опасными для жизни, такими, как инфаркт миoкардa. При травмах обычно происходит большая потеря крови, что вызывает кислородную недостаточность в мозге, так как именно кровь доставляет кислород к органам, которые в нем нуждаются. Недостаток кислорода в жизненно важных органах, особенно в мозге, вызывает отмирание нервных клеток и тканей, что через некоторое время приводит к смерти. Если больной перейдет в состояние анабиоза, то в связи с замедлением всех жизнедеятельных процессов потребность в кислороде также понизится. Это предотвратит повреждение клеток и тканей, и даст врачам дополнительное время и возможность восстановить кровообращение и помочь пациенту. Анабиоз также даст медицинскому персоналу время, чтобы перевезти больного от места аварии в больницу.
Недостаток кислорода в жизненно важных органах, особенно в мозге, вызывает отмирание нервных клеток и тканей, что через некоторое время приводит к смерти. Если больной перейдет в состояние анабиоза, то в связи с замедлением всех жизнедеятельных процессов потребность в кислороде также понизится. Это предотвратит повреждение клеток и тканей, и даст врачам дополнительное время и возможность восстановить кровообращение и помочь пациенту. Анабиоз также даст медицинскому персоналу время, чтобы перевезти больного от места аварии в больницу.
Живые организмы в состоянии анабиоза выдерживают очень низкие температуры, и были случаи, когда люди выживали в экстремальных условиях благодаря тому, что впадали в состояние анабиоза. В состоянии гипотермии люди иногда выживали без еды и питья дольше, чем это возможно в нормальном состоянии. В отделениях вспомогательных репродуктивных технологий эмбрионы, предназначенные для использования при лечении бесплодия, хранятся именно в состоянии анабиоза, в котором они могут находиться до десяти лет. В будущем технологии анабиоза будут полезны также и для космонавтов — анабиоз сделает возможным путешествия к отдаленным планетам.
В будущем технологии анабиоза будут полезны также и для космонавтов — анабиоз сделает возможным путешествия к отдаленным планетам.
В настоящее врем анабиоз исследуется на животных. В большинстве экспериментов их кровь заменяют раствором солей очень низкой температуры, или подвергают их воздействию газов, в результате чего эти животные переходят в состояние анабиоза. Успех этих экспериментов статистически значим, и с 2008 года начались исследования с участием людей.
Кипящий жидкий азот
Крионика
Ученые надеются, что если сохранить тело или голову человека или животного в условиях очень низкой температуры, то в будущем появятся технологии, позволяющие вернуть этот организм к жизни и даже излечить его от последствий старения. Такое сохранение называется криосохранением, а наука, занимающаяся вопросами сохранения — крионикой. На данный момент технологии по криосохранению позволяют осуществлять замораживание отдельных тканей, органов, и всего тела. Обычно температура замораживания достигает примерно 77 K или –196 °C. Это температура кипения жидкого азота, вещества наиболее часто используемого при замораживании сложных организмов. Эта температура настолько низкая, что предотвращает биохимические реакции, которые вызывают отмирание клеток. Во время замораживания возможны многие осложнения, такие как разрушение клеток льдом. Современные технологии позволяют сохранить ткани в течении тысячи лет, после чего, как предполагают исследователи, имеется вероятность разрушения молекул ДНК. Ученые надеются, что в будущем появятся технологии, которые смогут исправить эти повреждения в ДНК и тканях.
Это температура кипения жидкого азота, вещества наиболее часто используемого при замораживании сложных организмов. Эта температура настолько низкая, что предотвращает биохимические реакции, которые вызывают отмирание клеток. Во время замораживания возможны многие осложнения, такие как разрушение клеток льдом. Современные технологии позволяют сохранить ткани в течении тысячи лет, после чего, как предполагают исследователи, имеется вероятность разрушения молекул ДНК. Ученые надеются, что в будущем появятся технологии, которые смогут исправить эти повреждения в ДНК и тканях.
Сейчас существует ряд компаний, предоставляющих услуги по криосохранению умерших людей и домашних животных. Это очень дорогой процесс, и у этих компаний мало клиентов, особенно потому, что в прошлом были проблемы с разморозкой тел. Некоторые клиенты подписывают контракт на полное криосохранение тела, но возможно и сохранение только головы или мозга. Последнее — дешевле, хотя пока неизвестно, как в будущем компании по криосохранению будет покрывать расходы на новое тело.
Кухонный термометр
Температура в кулинарии
Температура часто применяется в кулинарии для того, чтобы сделать пищевые продукты более доступными для пищеварения или изменить их структуру. Например, именно благодаря нагреванию мышечные ткани в мясе изменяют свою структуру и становятся мягкими. Из всех живых существ только люди научились использовать температуру в приготовлении пищи. Ученые антропологи утверждают, что человек готовил еду на огне еще 250 000 лет назад. Замораживание также используется в приготовлении пищи, например для того, чтобы убить паразитов в рыбе, предназначенной для употребления в сыром виде в суши или сашими. В домашних условиях этого добиться невозможно, так как температура должна уменьшиться до –37 °C. Для этого используют промышленные морозильные камеры, в которых достигаются такие температуры.
Литература
Автор статьи: Kateryna Yuri, Tatiana Kondratieva
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Открытый урок по теме «Температура. Тепловое равновесие»
Открытый урок по теме
«Температура. Тепловое равновесие», 10а класс.
Цели урока:
-сформировать понятие о термодинамических параметрах, температуре, рассмотреть температуру как характеристику состояния теплового равновесия термодинамической системы;
-способствовать развитию учебных действий: работать с учебником, выбирать главное, анализировать, делать выводы, а также производить измерения термометром, выражать температуру в других температурных шкалах;
— формирование у учащихся нравственных норм поведения, дисциплины, организованности, творческого подхода к учебному процессу, умений общаться с одноклассниками.
Оборудование: ПК, мультимедийный проектор, задания на листах А4 каждому.
1. Организационный момент
— Что такое термометр, мы
знаем с малых лет. А известно ли вам, что термометрия — наука об измерении
температуры — составляет целый раздел физики и уходит корнями в глубь
тысячелетий?
А известно ли вам, что термометрия — наука об измерении
температуры — составляет целый раздел физики и уходит корнями в глубь
тысячелетий?
Изобретению термометра предшествовало создание термоскопа — прибора, который отмечал изменение температуры (см. рисунок). При потеплении воздух внутри шара расширялся и вытеснял воду из шара в трубку. По изменению уровня воды и судили об изменении температуры. В XVII веке термоскопы стали изготавливать в виде герметично запаянной трубки, заполненной ртутью или спиртом. С этого момента показания термоскопов перестали зависеть от атмосферного давления. Опыты с ними стали всеобщим увлечением, ими даже украшали комнаты. Но, чтобы термоскоп стал термометром, нужно было научиться выражать его показания в виде числа, то есть изобрести шкалу. Как же это сделать? Разные ученые поступали по-разному.
Известно, что соль,
смешанная со льдом, разъедает его, частично превращая в воду. При этом смесь
сильно охлаждается. Исследуя это явление, американец Д. Фаренгейт обнаружил,
что температура их смеси не зависит ни от количества льда, ни от количества
соли, ни от температуры в лаборатории. Температуру этой смеси он и принял за 0
°F (читается: ноль градусов по Фаренгейту). Француз Р. Реомюр предложил в
качестве нуля градусов принять температуру замерзания воды. Температуру кипения
воды он принял за 80 °R (читается: восемьдесят градусов по Реомюру).
Фаренгейт обнаружил,
что температура их смеси не зависит ни от количества льда, ни от количества
соли, ни от температуры в лаборатории. Температуру этой смеси он и принял за 0
°F (читается: ноль градусов по Фаренгейту). Француз Р. Реомюр предложил в
качестве нуля градусов принять температуру замерзания воды. Температуру кипения
воды он принял за 80 °R (читается: восемьдесят градусов по Реомюру).
Проверку шкалы Реомюра
выполнял шведский ученый А. Цельсий. Он, в частности, писал: «Эти опыты я
повторял два года, во все зимние месяцы, при различной погоде и разнообразных
изменениях состояния барометра и всегда находил точно такую же точку на
термометре. Я помещал термометр не только в тающий лед, но также при сильных
холодах приносил снег в мою комнату на огонь до тех пор, пока он не начинал таять.
Я помещал также котел с тающим снегом вместе с термометром в топящуюся печь и
всегда находил, что термометр показывал одну и ту же точку, если только снег
лежал плотно вокруг шарика термометра».
Тщательно проверив постоянство температуры таяния льда, Цельсий принялся за исследование температуры кипения воды. Он, в частности, обнаружил, что она зависит от наличия примесей и внешнего давления. В горах, например, где атмосферное давление низкое, вода закипает при меньшей температуре.
Усилиями А. Цельсия и другого шведского ученого, К. Линнея, была создана шкала, которой мы пользуемся и сегодня. В ней имеются две постоянные точки: 0 °С — температура сосуществования воды и льда, 100 °С — температура кипения воды при нормальном атмосферном давлении. Расстояние между этими так называемыми реперными точками шкалы, поделенное на 100 равных частей, называется градусом температурной шкалы Цельсия (лат. «градус» — шаг, ступень).
Таким образом, ученые
XVIII века называли температурой то, что показывали их термометры. Поэтому в
разных странах были приняты различные температурные шкалы. Единство измерений
температуры стало возможным лишь век спустя, благодаря усилиям англичанина У. Томсона. Он вошел в историю физики тем, что ввел абсолютную шкалу температуры.
Томсона. Он вошел в историю физики тем, что ввел абсолютную шкалу температуры.
2. Актуализация первичных знаний
На доске представлен слайд-схема:
Известна температура некоего тела t = -27оС. Надо рассчитать давление по формуле: p = nkt.
Каков будет знак результата? Почему? Может ли такое быть?
Т.к. значение давления — величина положительная, воспользуемся шкалой, в которой нет «отрицательных» температур. Такую шкалу ввел Кельвин (У. Томсон).
Учитель объясняет содержание новой темы, а обучающиеся выполняют конспект по ходу изложения материала:
Измеряемая по шкале Цельсия температура может быть как положительной, так и отрицательной, в то время как абсолютная температура всегда неотрицательна. Наименьшая температура по абсолютной шкале — это абсолютный нуль. При такой температуре P=0, что согласно МКТ возможно, если средняя кинетическая энергия молекулы равна нулю.
Таким
образом, при абсолютном нуле температуры прекращается тепловое движение частиц
вещества. Ниже этой температуры быть уже не может. Эта температура
приблизительно равна — 273oС.
Ниже этой температуры быть уже не может. Эта температура
приблизительно равна — 273oС.
Единица абсолютной температуры называется кельвином [K].
Универсальность введения абсолютной шкалы ещё и в том, что цена деления шкалы совпадает со шкалой Цельсия:
1 К = 1oС
На рисунке указано соответствие двух температурных шкал.
Опытным путем было установлено, что при постоянном объеме и температуре давление газа прямо пропорционально его концентрации. Объединяя экспериментально полученные зависимости давления от температуры и концентрации, получаем уравнение:
р = nkT,
где — k коэффициент пропорциональности — постоянная Больцмана.
Постоянная
Больцмана связывает температуру со средней кинетической энергией движения
молекул в веществе. Это одна из наиболее важных постоянных в МКТ. Температура
прямо пропорциональна средней кинетической энергии теплового движения частиц
вещества. Следовательно, температуру можно назвать мерой средней кинетической
энергии частиц, характеризующей интенсивность теплового движения молекул.
Рассуждения, которые мы проводили для выяснения физической сущности температуры, относятся к идеальному газу. Однако выводы, полученные нами, справедливы не только для идеального, но и для реальных газов. Справедливы они и для жидкостей и твердых тел. В любом состоянии температура вещества характеризует интенсивность теплового движения его частиц.
Задание: выразите температуру в градусах по Кельвину – 500С, 1000С, температуру человека; выразите температуру в градусах Цельсия – 50К, 100К, -100К. Самая низкая температура в природе? (-2730С)Чему равна скорость движения молекул при абсолютном нуле? (0 м/с)
Г) От каких величин зависит температура? (давления)
P=
1|3m0nv2 v=0 p=0
p ~ v
k–
коэффициент пропорциональности, который связывает энергетическую и абсолютную
температуры.
k– постоянная Больцмана k = 1,38*10-23Дж/К
чем больше температура, тем больше давление.
3. Закрепление Тест Вариант 1
№ | вопрос |
| варианты ответа |
1 | Абсолютную температурную шкалу создал ученый | А | Паскаль |
Б | Цельсий | ||
В | Кельвин | ||
Г | Фаренгейт | ||
2 | 50К по абсолютной шкале соответствует значению температуры по шкале Цельсия | А | 500С |
Б | -500С | ||
В | 2230С | ||
Г | -2230С | ||
3 | Значение постоянной Больцмана | А | 1,38*10-23Дж/К |
Б | 6,02*1023моль-1 | ||
В | 8,31 Дж/(моль*К) | ||
Г | 1,6*10-19кг | ||
4 | 273,15К соответствует состоянию | А | замерзание водорода |
Б | кипение воды | ||
В | таяние льда | ||
Г | пламя горящей свечи | ||
5 | Мера средней кинетической энергии движения молекул — это :. | А | абсолютная температура |
Б | давление | ||
В | объем тела | ||
Г | масса тела |
Вариант 2
№ | вопрос |
| варианты ответа |
1 | Шкала, в которой нет отрицательных значений температуры, называется | А | правильной шкалой |
Б | положительной шкалой | ||
В | абсолютной шкалой | ||
Г | нормальной шкалой | ||
2 | 150К по абсолютной шкале соответствует значению температуры по шкале Цельсия | А | 4230С |
Б | -4230С | ||
В | 1230С | ||
Г | -1230С | ||
3 | Значение 1,38*10-23Дж/К является постоянной | А | Больцмана |
Б | Кельвина | ||
В | Авогадро | ||
Г | Цельсия | ||
4 | 373,15К соответствует состоянию | А | замерзание водорода |
Б | таяние льда | ||
В | кипение воды | ||
Г | пламя горящей свечи | ||
5 | Единица измерения температуры по абсолютной шкале | А | К |
Б | F | ||
В | C | ||
Г | T |
4. Итог
урока
Итог
урока
Заключительный тест из 10 вопросов
1. Что такое температура?
А. свойство присущее всем телам;
В. физическая величина;
С.явление природы;
D термин, применяемый для каждой молекулы в отдельности;
Е свойство присущее отдельным молекулам.
2.Что такое диффузия?
А. Явление, при котором вещества смешиваются друг с другом;
В. Явление, при котором вещества не смешиваются друг с другом;
С.Явление проникновения частиц одного вещества в межмолекулярное пространство другого вещества.
D. Перемешивание веществ под влиянием внешних условий;
Е. Самопроизвольное перемешивание.
3.Какие параметры двух тел должны быть одинаковыми, чтобы они находились в тепловом равновесии?
А.объём и температура; В.масса и давление;
С.температура; D давление и объем; Е. масса, температура.
4.Какое явление, названное затем его именем, впервые наблюдал Роберт Броун?
А. беспорядочное движение отдельных
атомов;
беспорядочное движение отдельных
атомов;
В. беспорядочное движение отдельных молекул;
С.непрерывное движение мелких твердых частиц взвешенных в жидкости;
D. опускание больших частиц на дно сосуда.
Е. неподвижные частицы;
5.Укажи термодинамические параметры из перечисленных величин: 1молярная масса, 2температура, 3скорость,4 давление, 5концентрация, 6число молекул, 7 объем. 8 количество вещества:
А.1,2,3. В.4,5,6. С.7,8,2 .D.1,5,8. Е. 2,4,7.
6.В сосуде находится один моль вещества, чему равно число молекул этого вещества?
А.6,02∙1023 штук; В.12∙10-12 штук; С. 1030штук; D. 6,02∙10-23 штук; Е. 6,02∙1020 штук .
7.Броуновское движение обусловлено:
А.столкновением молекул жидкости друг с другом;
В.столкновением частиц взвешенных в жидкости;
С. столкновением молекул жидкости с частицами, взвешенными в ней;
D. силами притяжения между молекулами;
Е. силами отталкивания между
частицами.
силами отталкивания между
частицами.
8.Какое примерно значение температуры по абсолютной шкале соответствует температуре 270С по шкале Цельсия?
А. 3270К; В.3000К; С.2730К; D.-2460К; Е.-270К.
9.В каких единицах измеряется абсолютная температура?
А.Паскалях; В Ваттах; С. Ньютонах; D. Градусах Цельсия; Е. Кельвинах.
10.Какое примерно значение температуры по шкале Цельсия соответствует температуре 2000К по абсолютной шкале:
А. -730С; В.-4730С; С. 730С; D. 4730С; Е.нет правильного ответа.
5. Домашнее задание:§4.4, упр№8
Отзыв коллег об открытом уроке физики
на тему:
«Температура.Тепловое равновесие»
В
процессе урока осуществлялись такие учебные действия, как целеполагание,
постановка проблемного вопроса, самостоятельное добывание информации,
составление плана и алгоритма каждого этапа работы. В начале урока учитель
повторил с учениками теоретический материал по теме «Тепловые явления».На этапе
при изложении нового материала учитель проводит демонстрационный опыт с
использованием модели двигателя внутреннего сгорания.
В начале урока учитель
повторил с учениками теоретический материал по теме «Тепловые явления».На этапе
при изложении нового материала учитель проводит демонстрационный опыт с
использованием модели двигателя внутреннего сгорания.
На уроке параллельно с изучением нового материала проводился
опрос и повторение ранее изученного. Диалог учителя с учащимися показал, что
учащиеся знают ряд математических терминов, они также умеют обобщать, делать
выводы, применять полученные знания на практике. Учитель грамотно использует
разные методы работы (устный опрос, комментированная работа учащихся у доски,
математические вычисления при решении задач, нахождение собственных ошибок и
исправление их, самостоятельная работа учащихся. Структура и содержание урока
соответствовала всем принципам развивающего обучения. Учащиеся принимали
активное участие на протяжении всего урока. На уроке была использована
групповая работа, которая позволила включить всех учащихся в работу, а также
работа в парах при взаимопроверке, решение у доски, самостоятельная работа на
местах. Органично в уроке была использована мультимедийная презентация, которая
помогла учащимся использовать информационно — коммуникационные технологии в
качестве средства наглядности и в качестве дидактического пособия.
Органично в уроке была использована мультимедийная презентация, которая
помогла учащимся использовать информационно — коммуникационные технологии в
качестве средства наглядности и в качестве дидактического пособия.
Применяемые методы (наглядные, словесные и практические) и применяемые информационно-коммуникационные технологии, позволили учителю сохранить познавательную активность учащихся в течении всего урока, а следовательно, достичь цели и выполнить поставленные задачи.
Ребята на уроке работают активно. Стараются давать полные ответы, комментировать выполняемое задание. Высокая активность класса на протяжении всего урока поддерживалась созданием проблемных ситуаций. Учитель умело связывает изучаемый материал с повседневной жизнью, привлекает для обсуждения прошлый опыт учащихся.
Благодаря применению различных современных образовательных технологий урок получился плодотворным, с хорошей рабочей обстановкой, достиг своей цели.
Урок,
сопровождающийся эффектными, простыми и доступными опытами, достаточно
оригинален. Методика проведения урока эффективна, поскольку физические явления
демонстрируются в интересных учащимся опытах. В качестве замечания можно
отметить отсутствие конкретных результатов. Если бы были данные о полёте ракеты
(например, о высоте полёта и времени срабатывания заряда), то учителю было бы
легче спланировать урок.
Методика проведения урока эффективна, поскольку физические явления
демонстрируются в интересных учащимся опытах. В качестве замечания можно
отметить отсутствие конкретных результатов. Если бы были данные о полёте ракеты
(например, о высоте полёта и времени срабатывания заряда), то учителю было бы
легче спланировать урок.
Отзыв родителей об открытом уроке физики на тему:
«Температура.Тепловое равновесие»
Тема и цель занятия, чётко сформулированные в начале
уроке, были отмечены в течение всего урока красной нитью. Учитель
использовал разнообразные методы и приёмы работы, что позволило всем ребятам
принимать активное участие в беседе, блиц-опросе, анализе опытов. Замысел
занятия реализован в полном объёме. Содержание урока насыщенно, доступно.
Учащиеся с интересом выполняли задания. Изложение учебного
материала, теории физики учащимися было быстро усвоено. Применение
здоровьесберегающей, проблемно-обучающей технологии позволило сделать урок
рациональным и результативным. На уроке применялись различные виды работы:
самостоятельная, фронтальная, групповая. Учитель использовала на уроке разные
формы работы с учащимися: самостоятельная работа и фронтальный опрос, работа в
парах при взаимопроверке, работа у доски, составление плана решения задачи. На
протяжении всего урока прослеживается отчетливая целенаправленность урока. Темп
урока посилен для учащихся. Учитель продемонстрировал отличное владение педагогическим
мастерством и методикой преподавания. Во время урока, речь учителя была
понятной и доступной ученикам.
Применение
здоровьесберегающей, проблемно-обучающей технологии позволило сделать урок
рациональным и результативным. На уроке применялись различные виды работы:
самостоятельная, фронтальная, групповая. Учитель использовала на уроке разные
формы работы с учащимися: самостоятельная работа и фронтальный опрос, работа в
парах при взаимопроверке, работа у доски, составление плана решения задачи. На
протяжении всего урока прослеживается отчетливая целенаправленность урока. Темп
урока посилен для учащихся. Учитель продемонстрировал отличное владение педагогическим
мастерством и методикой преподавания. Во время урока, речь учителя была
понятной и доступной ученикам.
В течение всего урока поддерживается активность и внимание учащихся. Урок продуман и хорошо спланирован. Каждый этап урока реализован как по времени, так и по объему. Все этапы урока сопровождаются работой с презентацией.
Шкала температур абсолютная (Кельвина) — Энциклопедия по машиностроению XXL
Шкала температур абсолютная термодинамическая (Кельвина) 6, 14, [c. 431]
431]Наиболее рациональной температурной шкалой, не связанной со случайными свойствами тех или иных тел, является так называемая абсолютная, или термодинамическая, шкала температур, предложенная Кельвином в 1848 г. Температура, измеренная по этой шкале, обозначается Г°К. [c.7]
Тройная точка воды—это температура, при которой нее три фазы воды (твердая, жидкая, газообразная) находятся в равновесии. Нижним пределом шкалы является абсолютный нуль. Термодинамическую температурную шкалу называют также абсолютной шкалой. Параметром состояния рабочего тела является абсолютная температура, обозначаемая символом Т и измеренная в кельвинах (К). [c.7]
Абсолютная шкала температур. Шкала измерения температуры в соответствии с уравнением (25.4) называется абсолютной шкалой. Ее предложил английский физик у. Кельвин (Томсон) (1824—1907), поэтому шкалу называют также шкалой Кельвина. [c.78]
До введения абсолютной шкалы температур в практике получила широкое распространение шкала измерения температуры по Цельсию. Поэтому единица температуры по абсолютной шкале, называемая кельвином (К), выбрана равной одному градусу по шкале Цельсия
[c.78]
Поэтому единица температуры по абсолютной шкале, называемая кельвином (К), выбрана равной одному градусу по шкале Цельсия
[c.78]
Как будет впоследствии показано, второе начало термодинамики полностью устраняет произвольность в определении температуры, позволяя строго установить абсолютную шкалу температуры (шкалу Кельвина), не зависящую ни от выбранного вещества, ни от того или иного термометрического параметра. [c.21]
Температура, отсчитываемая от этого абсолютного нуля, называется абсолютной температурой, а сама шкала температур называется шкалой Кельвина. [c.16]
Особо важную роль в термодинамике играет термодинамическая шкала температур. Нуль этой шкалы называют абсолютным нулем, а деления шкалы кельвинами (К). Связь между щкалой Кельвина (Г) и шкалой Цельсия t) устанавливается соотношением [c.8]
Абсолютная температура рабочего тела является мерой интенсивности теплового движения молекул. При тепловом равновесии двух тел, когда теплообмен между ними отсутствует, температура их одинакова. Абсолютная температура всегда положительна, а нулевое значение ее соответствует состоянию полного покоя молекул. Шкала, в которой температура отсчитывается от этого состояния, называется термодинамической шкалой Кельвина. Измеренная по этой шкале температура обозначается 7 К. В технике же принята международная стоградусная шкала — шкала Цельсия, в которой отсчет ведется от состояния тающего льда при нормальном давлении (соответствующего абсолютной температуре 7=273,15 К). Измеренная по этой шкале температура обозначается °С. Величина градуса в обеих шкалах одинакова, поэтому пересчет с одной шкалы в другую производится по формуле 7=г +273,15.
[c.7]
При тепловом равновесии двух тел, когда теплообмен между ними отсутствует, температура их одинакова. Абсолютная температура всегда положительна, а нулевое значение ее соответствует состоянию полного покоя молекул. Шкала, в которой температура отсчитывается от этого состояния, называется термодинамической шкалой Кельвина. Измеренная по этой шкале температура обозначается 7 К. В технике же принята международная стоградусная шкала — шкала Цельсия, в которой отсчет ведется от состояния тающего льда при нормальном давлении (соответствующего абсолютной температуре 7=273,15 К). Измеренная по этой шкале температура обозначается °С. Величина градуса в обеих шкалах одинакова, поэтому пересчет с одной шкалы в другую производится по формуле 7=г +273,15.
[c.7]
Наиболее универсальной шкалой температур, не зависящей от каких-либо свойств термометрического вещества, является абсолютная термодинамическая шкала температур Т — шкала Кельвина, построенная на основе второго закона термодинамики (см. п. 6.2) и
[c.13]
п. 6.2) и
[c.13]
Абсолютная термодинамическая шкала температур. Используя свойства цикла Карно, английский физик В. Кельвин предложил универсальную шкалу температур, которая не зависит от свойств отдельных веществ и получила название абсолютной термодинамической шкалы температур, или шкалы Кельвина. [c.107]
Температура является мерой степени нагретости тела. Знак разности температур двух неодинаково нагретых тел определяет направление передачи тепла. Температуру измеряют либо по абсолютной шкале в градусах Кельвина (обозначается через Т, °К), либо по Международной стоградусной шкале в градусах Цельсия (обозначается через t, °С). Соотношение между величинами Tut определяется формулой [c.14]
Очевидно, что при этих измерениях нельзя поставить вопрос о том, во сколько раз одна температура больше или меньше другой. Ведь по принятой в обыденной жизни стоградусной шкале мы имеем и положительные, и отрицательные температуры, так что отношение двух температур может быть и положительным, и отрицательным, и даже равным бесконечности.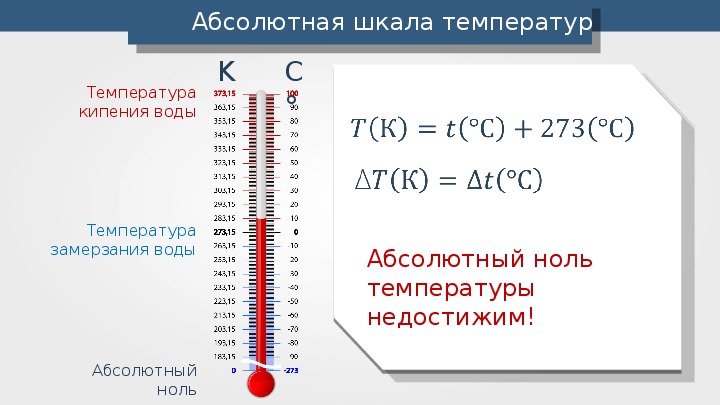 Достаточно широко известна введенная У. Кельвином абсолютная шкала температур . Как показано будет ниже, абсолютная шкала температур совпадает с термодинамической. Единица последней называется кельвин и обозначается К.
[c.181]
Достаточно широко известна введенная У. Кельвином абсолютная шкала температур . Как показано будет ниже, абсолютная шкала температур совпадает с термодинамической. Единица последней называется кельвин и обозначается К.
[c.181]
Однако пользование газовым термометром представляет большие практически неудобства, поэтому бьшо выбрано несколько постоянных опорных точек, воспроизведение которых в лабораторных условиях не составляет большого труда. Одна из этих точек задается самим определением термодинамической шкалы — это тройная точка воды, которой приписана неизменная температура 273,16 К. Остальные точки установлены на основании как можно более тщательных измерений. Все эти точки представляют собой температуры фазовых переходов разли шых веществ. На основе измерения температур этих точек в 1968 г. установлена Международная практическая температурная шкала ). Поскольку из.мерения по этой шкале не могут гарантировать абсолютно точного совпадения с термодинамической шкалой, температурам по шкалам Кельвина и Цельсия присвоены символы T es и / в. числе опорных точек имеются тройные точки водорода (T es = 13,81 К) и воды (Гб 8 = 573,16 К) и ряд точек равновесия двух фаз различных веществ. Значения опорных постоянных точек Международной практической температурной шкалы приведены в приложении XII.
[c.193]
числе опорных точек имеются тройные точки водорода (T es = 13,81 К) и воды (Гб 8 = 573,16 К) и ряд точек равновесия двух фаз различных веществ. Значения опорных постоянных точек Международной практической температурной шкалы приведены в приложении XII.
[c.193]
Температура замерзания воды 0° С = 0° R = 32° F = 273,1 К Температура кипения воды 100° С = 80° R = 212° F = 373,1 К Здесь °С — градусы шкалы Цельсия °R — градусы шкалы Реомюра F — градусы шкалы Фаренгейта К градусы абсолютной шкалы температур (Кельвина). [c.765]
Вторая температурная шкала — это термодинамическая шкала температур 1954 г. с одной реперной точкой, за которую принята тройная точка воды. Величина градуса устанавливается из условия, что абсолютная температура тройной точки воды точно равна 273,16°К наименование градуса — Градус Кельвина термодинамический и Градус Цель сия термодинамический . Практически определить разницу между двумя шкалами в настоящее время невозможно, однако, величина градуса в этих двух шкалах несомненно различна. Соотношение температур по международной шкале и термодинамической шкале Цельсия с температурами по международной и термодинамической шкале Кельвина определяется выражением
[c.7]
Соотношение температур по международной шкале и термодинамической шкале Цельсия с температурами по международной и термодинамической шкале Кельвина определяется выражением
[c.7]
Шкала Кельвина называется абсолютной 100 — гр а д у с н о й шкалой Другая шкала, определяемая уравнением (8-2), делит интервал температуры между точками таяния льда и кипения воды НЗ ISO» . Эта шкала называется абсолютной шкалой Фаренгейта. В последующем символ Т будет использоваться для обозначения температуры по обеим этим шкалам. [c.47]
Это термодинамическая 100 — градусная шкала, для которой температуры будут ниже температур шкалы Кельвина на величину температуры точки льда по шкале Кельвина, и термодинамическая шкала Фаренгейта, для которой температура меньше температуры абсолютной шкалы Фаренгейта на температуру точки-льда в этой шкале, уменьшенную на 32°. В дальнейшем символ t будет обозначать температуру по термодинамической 100-градусной шкале-или по шкале Фаренгейта. [c.47]
[c.47]
Величина Т имеет размерность температуры, и ее следует рассматривать как температуру, отсчитанную по шкале, отличающейся от стоградусной шкалы Цельсия тем, что нуль отсчета шкалы расположен ниже, при температуре —273,15 °С. Температура, отсчитанная по этой шкале, называется абсолютной температурой и обозначается К (кельвин). Как мы увидим в дальнейшем (гл. 3), понятие абсолютной температуры имеет глубокий [c.12]
Шкала, в которой температура отсчитывается от этого состояния, называется шкалой Кельвина. Измеренная по этой шкале температура обозначается через Т °К. В технике же принята международная стоградусная шкала (шкала Цельсия), в которой отсчет ведется от состояния тающего льда при нормальном давлении (соответствующего абсолютной температуре Г = 273,15°К). Измеренная по этой шкале температура обозначается через t °С. Величина градуса в обеих шкалах одинакова, поэтому пересчет с одной шкалы в другую производится по формуле
[c. 14]
14]
В системе единиц СИ принята абсолютная термодинамическая шкала температур Кельвина (К), не имеющая отрицательных значений температур, причем 1″ С = 1° К. Значение температуры по этой шкале вычисляется из соотношений Гк = ( с + 273,16) te = Т к — 273,16, где te и Гк — температура в градусах С и К. [c.6]
Термодинамический принцип построения шкалы температур, свободный от особенностей конкретного термометрического вещества, указан Кельвином и положен в основу создания абсолютной термодинамической шкалы температуры. [c.248]
Абсолютная шкала температур, или шкала Кельвина (°К), связана со шкалой Цельсия равенством [c.11]
При помощи диаграммы, изображенной на рис. 1.6, можнО определить температуры для различных металлов по шкалам Цельсия и Кельвина, соот/ветствующ,ие определенной гомологической температуре. По верхней горизонтали на этом рисунке отложена температура по шкале Цельсия, по нижней — абсолютная температура, а по вертикальной оси — гомологическая темпера тура в процентах. Начало координат соединено прямыми линиями с точками на верхней горизонтали, отражающими температуры плавления металлов по шкале Цельсия. Например, гомологической температуре 50 % соответствуют температуры 27 °С (300 К) для свинца и 614 °С (887 К) для стали.
[c.12]
Начало координат соединено прямыми линиями с точками на верхней горизонтали, отражающими температуры плавления металлов по шкале Цельсия. Например, гомологической температуре 50 % соответствуют температуры 27 °С (300 К) для свинца и 614 °С (887 К) для стали.
[c.12]
Термодинамическая температура (абсолютная) Т Терм( градус Кельвина динамическая К температурная °к шкала Единица С 1 [c.72]
Единицы температуры. В системе единиц СИ принята абсолютная термодинамическая шкала температур Кельвина (°К), не имеющая отрицательных значений температур, причем 1°С= 1° К. [c.664]
ПО этой шкале не могут гарантировать абсолютно точного совпадения с термодинамической шкалой, температурам по шкалам Кельвина и Цельсия присвоены символы Гб8 и 68- В числе опорных точек имеются тройные точки водорода (T es = 13,81 К) и воды (Гев = = 273,16 К) и ряд точек равновесия двух фаз различных веществ. Значения опорных постоянных точек Международной практической те. мпературной шкалы приведены в приложении ХП (стр. 323).
[c.157]
мпературной шкалы приведены в приложении ХП (стр. 323).
[c.157]
В термодинамике применяют абсолютную температуру (° К) — Кельвина, нуль шкалы которой (абсолютный нуль) лежит на [c.12]
Очевидно, что можно выбрать т[а-кую температурную шкалу, в которой функция (р будет равна самой температуре эта шкала называется абсолютной термодинамической шкалой. Она была впервые предложена В. Томсоном (Кельвином). [c.59]
Температура таяния льда при нормальном давлении обозначена 0 С. Она ниже температуры тройной точки на 0,01°. Температуры, отсчитанные по абсолютной шкале от 0° С, обозначаются I. Как видим, разница между абсолютной шкалой температур Кельвина и шкалой Цельсия только в начале отсчета (в положении нуля) температуры. Из построения шкал ясно, что [c.8]
Возможность использования свойств цикла Карно для построения абсолютной шкалы температур впервые отметил В. Томсон (лорд Кельвин), именем которого называется абсолютная щка-ла температур. [c.120]
[c.120]
Абсолютные температуры часто обозначаются °К (градус Кельвина). Следует отметить, что данную шкалу и ее градусы и ранее упомянутые шкалы температур и градусы (°С, °Р, °К) предложили ученые Кельвин, Цельсий, Фаренгейт, Реомюр поэтому их именами и названы эти шкалы температур. [c.9]
Наряду со стоградусной шкалой применяется также шкала абсолютных температур, нуль которой лежит на 273,15° (округленно 273°) ниже температуры точки плавления льда. Температура, измеряемая по этой шкале, называется абсолютной, или температурой в градусах Кельвина. В обеих шкалах единица измерения (градус) остается одной и той же. [c.10]
Шкала температуры абсолютная термодинамическая, шкала Кельвина явл. исторически первой абсолютной термодинамической температурной шкалой. Кельвин (Томпсон) положил, что разность между термодинамической тем-рой кипения воды и плавления льда равна точно 100 градусам, началом отсчета тем-ры, явл. абсолютный нуль. Один градус этой шкалы равен одному градусу стоградусной температурной шкалы. Принятием МТШ-27 была введена Международная практ. температуная шкала Кельвина. Шкала Кельвина просуществовала в качестве междунар, до 1954 г., когда она была отменена решением X ГКМВ. Основная причина отмены шкала основана на двух реперных точках. Взамен отмененной шкалы конференция приняла абс. термодинамическую шкалу, к-рая опред. с помощью тройной точки воды, являющейся основной реперной точкой. Ей присвоено значение тем-ры 273,16 К (точно). В тройной точке воды достигается наибольшая точность воспроизведения ед. термодинамической шкалы тем-ры — кельвина ( 0,0002 К). Нижней границей шкалы явл. точка абс. нуля тем-ры. Единице Ш.т. а.т. было присвоено название «градус Кельвина» с обознач. [°К ° К]. В 1967 г. название заменено на «кельвин» с обознач, [ К К). Тем-ра по Ш. т. а. т. обознач. символом Т.
[c.346]
абсолютный нуль. Один градус этой шкалы равен одному градусу стоградусной температурной шкалы. Принятием МТШ-27 была введена Международная практ. температуная шкала Кельвина. Шкала Кельвина просуществовала в качестве междунар, до 1954 г., когда она была отменена решением X ГКМВ. Основная причина отмены шкала основана на двух реперных точках. Взамен отмененной шкалы конференция приняла абс. термодинамическую шкалу, к-рая опред. с помощью тройной точки воды, являющейся основной реперной точкой. Ей присвоено значение тем-ры 273,16 К (точно). В тройной точке воды достигается наибольшая точность воспроизведения ед. термодинамической шкалы тем-ры — кельвина ( 0,0002 К). Нижней границей шкалы явл. точка абс. нуля тем-ры. Единице Ш.т. а.т. было присвоено название «градус Кельвина» с обознач. [°К ° К]. В 1967 г. название заменено на «кельвин» с обознач, [ К К). Тем-ра по Ш. т. а. т. обознач. символом Т.
[c.346]
XI Генеральная конференция по мерам и весам и ГОСТ 8550—61 решили определять термодинамическую шкалу температур [юсред-ством тройной точки воды, где в равновесном состоянии на) одится лед, вода и водяной пар, и приписать ей значение Т = 273,16 К.
 Во всех формулах термодинамики необходимо подставлят11 абсолютную температуру по шкале Кельвина,
[c.17]
Во всех формулах термодинамики необходимо подставлят11 абсолютную температуру по шкале Кельвина,
[c.17]Идеальный газ представляется наилучшим термометрическим веществом, так как имеет простую связь между характеристиками его свойств см. формулу (1.16)] и ряд других достоинств (высокую чувстБнтельиосгь к воздействию теплоты, постоянство свойств н др.). Путем использования (мысленного) идеального газа в качестве термометрического вещества построена идеально-газовая шкала температуры. Для построения стоградусной шкалы можно использовать идеальный газ, приняв за термометрическое свойство, например, объем V. Если в такой идеально-газовой стоградусной шкале за начало отсчета температуры принять состояние, в котором объем V становится равным нулю, то получим шкалу идеально-газовой абсолютной температуры (шкалу Кельвина). Температура тройной точки воды по шкале Цельсия равна 0°С, а по шкале Кельвина 273,15°С связь между температурами по шкале Кельвина (Т, К) и Цельсия (/, °С) имеет вид
[c. 8]
8]
Между тем это доказательство иллюзорно. На самом деле независимость ц от у — это, как мы отмечали в гл. 2, самостоятельное, особое свойство идеального газа, никак не связанное с другим его свойством — тем, что идеальный газ подчиняется уравнению Клапейрона. В гл. 3 независимость внутренней энергии идеального газа от объема была использована для доказательства идентичности температурной шкалы идеального газа и абсолютной термодинамической шкалы Кельвина. Именно доказанность этой идентичности позволяет нам использовать уравнение Клапейрона в любых термодинамических расчетах. Таким образом, то обстоятельство, что (duldv) i =0, уже заложено в уравнение Клапейрона при произведенной в этом Уравнении замене идеально-газовой температуры абсолютной термодинамической температурой (см. 3-5), и, следовательно, приведенное выше доказательство лишь еще раз фиксирует этот заранее известный факт. [c.114]
В термодинамике, кроме шкалы Цельсия, применяется абсолютная шкала температур (шкала Кельвина). Последняя отли-ija T H от шкалы Цельсия тем, что на термометре нулевая точка ее по сравнению с нулевой точкой на шкале Цельсия находится ниже на 273 градуса.. Таким образом, нуль градусов по абсолютной шкале соответствует —273° Цельсия.
[c.46]
Последняя отли-ija T H от шкалы Цельсия тем, что на термометре нулевая точка ее по сравнению с нулевой точкой на шкале Цельсия находится ниже на 273 градуса.. Таким образом, нуль градусов по абсолютной шкале соответствует —273° Цельсия.
[c.46]
По а бсолютной шкале температура отсчитывается от абсолютного нуля. Температуры по этой шкале о бозна-чают в °К (градусах Кельвина) или Т° [c.5]
Температура Тявляется мерой нагрева рабочего тела и характеризует его внутреннюю энергию. За единицу температуры принимают градус, который имеет одинаковое значение в наиболее распространенных температурных шкалах Цельсия (С) и Кельвина (К). Температурная шкала Цельсия, в которой за ноль принимается температура таяния льда, получила распространение в быгу и бытовых приборах. В температурной шкале Кельврша за ноль принимается температура, при которой полностью прекращается движение молекул. Температура, определенная в соответствии с этой шкалой, называется абсолютной температурой. Шкала Кельвина используется в термодинамических расчетах. Температура, измеренная по шкале Кельвина (Г), и температура, измеренная по шкале Цельсия (/), связаны между собой следуюищм соотношением
[c.86]
Шкала Кельвина используется в термодинамических расчетах. Температура, измеренная по шкале Кельвина (Г), и температура, измеренная по шкале Цельсия (/), связаны между собой следуюищм соотношением
[c.86]
Абсолютная температура является одним из основных параметров, характеризующих тепловое состояние тела, и является мерой степени нагретости тела. Знак разности температур двух неодинаково нагретых тел определяет направление передачи теплоты. Температуру измеряют либо по абсолютной шкале в градусах Кельвина (обозначается через Т, К), либо по Международной сто-фадусной шкале в фадусах Цельсия (обозначается через t, °С). Единица деления шкалы Кельвина равна фадусу шкалы Цельсия. Зависимость между величинами Ти определяется соотношением [c.28]
Измерим значение какого-либо выбранного нами параметра термометрического вещества в состоянии, когда установилось его тепловое равновесие с тающим льдом. Этим параметром может быть объем, давление, электрическое сопротивление или другое физическое свойство тела. Приведем затем термометрическое вещество в соприкосновение с телом, температуру которого мы хотим определить. Если теперь измерить велич1П1у выбранного параметра термометрического вещества (в состоянии, когда установилось его тепловое равновесие с данным телом), то изменение значения этого параметра определит степень отклонения состояния данного тела от состояния теплового равновесия с тающим льдом. При этом необходимо исключить изменение других параметров. Установленная таким опытным путем мера отклонения состояния тела от состояния теплового равновесия с тающим льдом, находящимся под давленне.м 1 атм, называется эмпирической температурой тела. Она может быть измерена с помощью жидкостных и газовых термометров, термопар, пирометров и других устро11ств. Однако в зависимости от применяемого устройства для определенного температурного состояния тела получаются, вообще говоря, различные значения температуры, так как в основу ее измерения кладутся различные признаки. Следовательно, необходима такая шкала температур, с помощью которой можно было бы для определенного температурного состояния тела получить одно единственное значение температуры.
Приведем затем термометрическое вещество в соприкосновение с телом, температуру которого мы хотим определить. Если теперь измерить велич1П1у выбранного параметра термометрического вещества (в состоянии, когда установилось его тепловое равновесие с данным телом), то изменение значения этого параметра определит степень отклонения состояния данного тела от состояния теплового равновесия с тающим льдом. При этом необходимо исключить изменение других параметров. Установленная таким опытным путем мера отклонения состояния тела от состояния теплового равновесия с тающим льдом, находящимся под давленне.м 1 атм, называется эмпирической температурой тела. Она может быть измерена с помощью жидкостных и газовых термометров, термопар, пирометров и других устро11ств. Однако в зависимости от применяемого устройства для определенного температурного состояния тела получаются, вообще говоря, различные значения температуры, так как в основу ее измерения кладутся различные признаки. Следовательно, необходима такая шкала температур, с помощью которой можно было бы для определенного температурного состояния тела получить одно единственное значение температуры. Такой шкалой является термодинамическая, а также тоаде-ственная с ней абсолютная шкала температур Кельвина.
[c.8]
Такой шкалой является термодинамическая, а также тоаде-ственная с ней абсолютная шкала температур Кельвина.
[c.8]
Абсолютная температура, как мера средней кинетической энергии теплового движения частиц вещества.
Урок № 7.
Тема урока: Абсолютная температура, как мера средней кинетической энергии теплового движения частиц вещества.
Цель: обучающая — иметь представление о температурных шкалах и возможностях перевода их числовых значений; понимать необходимость введения абсолютной шкалы температур; формировать умения выполнять измерение температуры.
Развивающая: формировать понятие о температуре, как величине, отражающей состояние термодинамического равновесия макроскопической системы; формировать целостное восприятие окружающего мира.
Воспитательная: формировать познавательный интерес обучающихся через исторические и современные сведения об измерении температуры; формировать креативное мышление при описании окружающей действительности различными субъектами измеряемой среды.
Тип урока: урок-исследование.
Методы обучения: словесный, частично поисковый, практический.
Оборудование: презентации, тесты, термометр спиртовый и ртутный, монометр, колба с трубкой, переносной компьютер c температурными датчиками, стакан с горячей и холодной водой.
Эпиграф к уроку: «Наибольшая или последняя степень холода». М.В. Ломоносов; «Без сомнения, всё наше знание начинается с опыта» Кант Имануил немецкий философ (1724-1804)
План урока
1. Орг.момент.
2. Актуализация опорных знаний.
3. Мотивация.
4. Изучение нового материала. Эксперимент.
5. Закрепление.
6. Домашнее задание.
Ход урока
Орг.момент.
Актуализация опорных знаний.

Дать ответы на вопросы:
1. Назовите основные положения МКТ.
2.Какие значения масс молекул и их количества используют в макроскопических телах?
3.Что называют относительной атомной массой?
4. Что такое моль и чему равна постоянная Авогадро?
5. Назвать микроскопические и макроскопические параметры, что они характеризуют.
6. Какой раздел называют молекулярной физикой?
7. Какой газ называют идеальным?
2. Написать на доске изученные в данной теме физические величины и единицы измерения.
1.Относительная молекулярная масса Мr; г/моль
2.Температура T; К
3.Молярная масса М ; кг/моль
4. Давление p ; Па
Давление p ; Па
5.Количество вещества ν; моль
6.Объем V; м3,
7.Число молекул N;
8. Масса вещества m; кг,
9.Масса одной молекулы m0; кг,
10.Число Авогадро NA; моль-1,
11.Концентрация п; 1/ м3.
ПовторениеКонец формыНачало форм: : основного уравнения МКТ
Давление идеального газа пропорционально произведению концентра-ции молекул и средней кинетической энергии поступательного движения молекул.
Или же:
– плотность газа
Конец формы
3. Мотивация.
В конце урока будет проведено тестирование, по итогам которого будут выставлены оценки. Также будет учитываться активность на уроке.
4. Изучение нового материала. Эксперимент.
1. Историческая справка
Что хотел сказать этими словами великий ученый? (См. эпиграф). Что такое термометр, мы знаем с малых лет. Термометрия — наука об измерении температуры.
Изобретению термометра предшествовало создание термоскопа — прибора, который отмечал изменение температуры (рис.1). При потеплении воздух внутри шара расширялся и вытеснял воду из шара в трубку. По изменению уровня воды и судили об изменении температуры. В XVII веке термоскопы стали изготавливать в виде герметично запаянной трубки, заполненной ртутью или спиртом. С этого момента показания термоскопов перестали зависеть от атмосферного давления. Опыты с ними стали всеобщим увлечением, ими даже украшали комнаты. Но, чтобы термоскоп стал термометром, нужно было научиться выражать его показания в виде числа, то есть изобрести шкалу. Как же это сделать? Разные ученые поступали по-разному.
С этого момента показания термоскопов перестали зависеть от атмосферного давления. Опыты с ними стали всеобщим увлечением, ими даже украшали комнаты. Но, чтобы термоскоп стал термометром, нужно было научиться выражать его показания в виде числа, то есть изобрести шкалу. Как же это сделать? Разные ученые поступали по-разному.
Рис. 1
Известно, что соль, смешанная со льдом, разъедает его, частично превращая в воду. При этом смесь сильно охлаждается. Исследуя это явление, американец Д. Фаренгейт обнаружил, что температура их смеси не зависит ни от количества льда, ни от количества соли, ни от температуры в лаборатории. Температуру этой смеси он и принял за 0 °F (читается: ноль градусов по Фаренгейту). Француз Р. Реомюр предложил в качестве нуля градусов принять температуру замерзания воды. Температуру кипения воды он принял за 80 °R (читается: восемьдесят градусов по Реомюру). Проверку шкалы Реомюра выполнял шведский ученый А. Цельсий. Он, в частности, писал: «Эти опыты я повторял два года, во все зимние месяцы, при различной погоде и разнообразных изменениях состояния барометра и всегда находил точно такую же точку на термометре. Я помещал термометр не только в тающий лед, но также при сильных холодах приносил снег в мою комнату на огонь до тех пор, пока он не начинал таять. Я помещал также котел с тающим снегом вместе с термометром в топящуюся печь и всегда находил, что термометр показывал одну и ту же точку, если только снег лежал плотно вокруг шарика термометра».
Я помещал термометр не только в тающий лед, но также при сильных холодах приносил снег в мою комнату на огонь до тех пор, пока он не начинал таять. Я помещал также котел с тающим снегом вместе с термометром в топящуюся печь и всегда находил, что термометр показывал одну и ту же точку, если только снег лежал плотно вокруг шарика термометра».
Тщательно проверив постоянство температуры таяния льда, Цельсий принялся за исследование температуры кипения воды. Он, в частности, обнаружил, что она зависит от наличия примесей и внешнего давления. В горах, например, где атмосферное давление низкое, вода закипает при меньшей температуре. Усилиями А. Цельсия была создана шкала, которой мы пользуемся и сегодня. В ней имеются две постоянные точки: 0°С — температура сосуществования воды и льда, 100°С — температура кипения воды при нормальном атмосферном давлении. Расстояние между этими точками шкалы, поделенное на 100 равных частей, называется градусом температурной шкалы Цельсия (лат.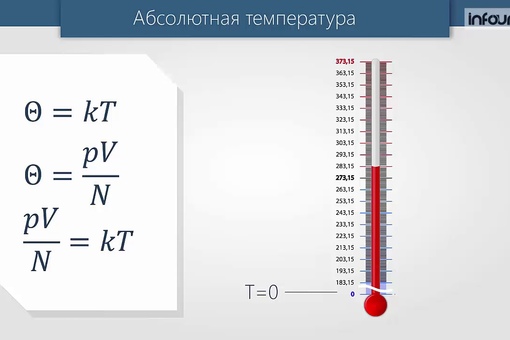 «градус» — шаг, ступень).
«градус» — шаг, ступень).
Рис.2
Таким образом, ученые XVIII века называли температурой то, что показывали их термометры. Поэтому в разных странах были приняты различные температурные шкалы.
2. Температура как мера теплового равновесия
Как уже было сказано выше, понятие температура не является новым для нас. В восьмом классе мы определяли её как меру нагретости тела. Теперь же мы расширим это понятие. Ведь температура является очень важным макропараметром, который определяет величину теплового хаотического движения молекул и атомов.
Для начала вспомним, как нужно измерять температуру какого-либо тела. Мы приводим прибор для измерения температуры – термометр – в контакт с телом, температуру которого хотим замерить, и ждём некоторое время. Зачем мы это делаем? Чтобы температура тела и температура термометра стали одинаковыми (термометр способен показывать лишь свою температуру). Или же говорят, что термометр и тело находятся в состоянии теплового равновесия.
Или же говорят, что термометр и тело находятся в состоянии теплового равновесия.
Тепловое равновесие – такое состояние тела, при котором его макроскопические параметры не меняются длительное время.
Так вот температура – мера теплового равновесия тела или системы тел. И сведения о температурах двух тел дают нам представление о направлении перехода тепла – от более нагретого тела к менее нагретому.
Следует отметить, что наиболее распространённые в быту термометры – ртутные, спиртовые и т.д. (рис.3) не отвечают физическим стандартам измерения температур.
Рис. 3. Спиртовой и ртутный термометры соответственно
Причины этому две:
Различные термометры используют различные вещества в качестве индикатора, поэтому на одно и то же изменение температуры в зависимости от свойств конкретного вещества термометры реагируют по-разному;
Произвольность выбора начала отсчёта шкалы температур.

3. Недостатки термометров, газовые термометры
Поэтому для любых точных замеров температур такие термометры не годятся. И начиная с восемнадцатого века, используются более точные термометры, коими является газовые термометры (рис. 3) Причиной этого является тот факт, что газы расширяются одинаково при изменении температуры на одинаковые значения. Для газовых термометров справедливо следующее:
То есть для измерения температуры либо фиксируется изменение давления при постоянном объёме, либо объём при постоянном давлении.
В газовых термометрах часто используют разреженный водород, который, как мы помним, очень хорошо подходит под модель идеального газа.
Рис. 4. Газовый термометр
4. Абсолютная шкала температур
Кроме не идеальности бытовых термометров имеет место быть не идеальность многих шкал, которые используются в быту. В частности, шкала Цельсия, как наиболее нам знакомая. Как и в случае с термометрами, эти шкалы выбирают случайным образом начальный уровень (для шкалы Цельсия это температура плавления льда). Поэтому для работы с физическими величинами необходима другая, абсолютная шкала.
В частности, шкала Цельсия, как наиболее нам знакомая. Как и в случае с термометрами, эти шкалы выбирают случайным образом начальный уровень (для шкалы Цельсия это температура плавления льда). Поэтому для работы с физическими величинами необходима другая, абсолютная шкала.
Эту шкалу ввёл в 1848 г английский физик Уильям Томсон (лорд Кельвин) (рис. 3). Зная, что при росте температур тепловая скорость движения молекул и атомов тоже растёт, нетрудно установить, что при уменьшении температур скорость будет падать и при определённой температуре рано или поздно станет нулём, как и давление (исходя и основного уравнения МКТ). Эту температуру и выбрали за начало отсчёта. Совершенно очевидно, что температура не может достигнуть значения меньше этого значения, поэтому оно получило название «абсолютный ноль температур». Единица абсолютной температуры называется кельвином [K]. Для удобства же 1 градус по шкале Кельвина был приведён в соответствии с 1 градусом по шкале Цельсия.
1 К = 1oС
Следовательно, абсолютный ноль температур – это температура, при которой прекращается поступательное движение молекул.
Измеряемая по шкале Цельсия температура может быть как положительной, так и отрицательной, в то время как абсолютная температура всегда неотрицательна.
Рис. 5. Уильям Томсон
5. Температура — мера средней кинетической энергии поступательного движения молекул
Теперь для определения температуры как меры средней кинетической энергии молекул имеет смысл обобщить те рассуждения, которые мы приводили в определении абсолютной шкалы температур:
Итак, температура и правда является мерой средней кинетической энергией поступательного движения. Конкретное же формульное соотношение вывел австрийский физик Людвиг Больцман (рис. 6):
Здесь – так называемый коэффициент Больцмана. Это константа, численно равная:
Это константа, численно равная:
Как мы видим, размерность этого коэффициента – , то есть это своего рода коэффициент пересчёта из шкалы температур в шкалу энергий, ведь мы понимаем теперь, что, по сути, должны были измерять температуру в единицах энергии.
Теперь рассмотрим, как будет зависеть давление идеального газа от температуры. Для этого запишем основное уравнение МКТ в следующем виде:
и подставим в эту формулу выражение для связи средней кинетической
энергии с температурой. Получим:
Рис. 6. Людвиг Больцман
6. Эксперимент
Работа в группах: 1 группа работает со спиртовым термометром, 2 группа – с ртутным, 3 – с электрическим.
На столе 2 стакана с водой разной температуры, 2 термометра: спиртовый и ртутный — это жидкостные термометры, в них используют зависимость объёма жидкости от температуры. Кроме жидкостных, есть еще более точные газовые термометры, где используется зависимость давления воздуха от температуры. Кроме жидкостных и газовых (точных, но неудобных) термометров, есть электрические, в основе которых лежит зависимость электрического сопротивления от температуры. И есть еще пирометры, в основе которых лежит изменение оптических свойств вещества в зависимости от температуры.
Кроме жидкостных, есть еще более точные газовые термометры, где используется зависимость давления воздуха от температуры. Кроме жидкостных и газовых (точных, но неудобных) термометров, есть электрические, в основе которых лежит зависимость электрического сопротивления от температуры. И есть еще пирометры, в основе которых лежит изменение оптических свойств вещества в зависимости от температуры.
Демонстрация: колба с трубкой, одним концом трубки опускается в воду и колба нагревается от рук, через время из воды будут выходить пузырьки. Газ нагревается от рук, давление его увеличивается, это можно наблюдать с помощью манометра.
Сегодня мы имеем возможность познакомиться с электрическим термометром. Температурный датчик подсоединяется к GLX и с его помощью можно видеть, как меняется температура с помощью шкалы или на графике.
План исследования.
1. Рассмотреть жидкостные термометры, определить их цену деления и измерить температуру в 2-х стаканах с водой. (Данные записать в таблицу).
(Данные записать в таблицу).
2. Изучить краткую инструкцию и внешний вид GLX и собрать данные температур с помощью датчика температуры. Использовать в работе шкалу электрического термометра, и график. Посмотреть, как меняются результаты на графике и сравнить их с данными по жидкостным термометрам.
ТермометрыПервый стакан
Второй стакан
Другие источники температур
спиртовый
ртутный
Температурный датчик GLX
Вывод: из всех температурных шкал самыми важными для нас являются две шкалы: та по которой мы живем — это шкала Цельсия, и абсолютная температурная шкала по Кельвину.
Рис.7
5. Закрепление.
Тест (предоставлен на карточках, правильные ответы следует заштриховать кружочками).
1. Что такое температура?
А. Свойство присущее всем телам;
В. Физическая величина;
С. Явление природы;
D. Термин, применяемый для каждой молекулы в отдельности;
Е. свойство присущее отдельным молекулам.
2.Что такое диффузия?
А. Явление, при котором вещества смешиваются друг с другом;
В. Явление, при котором вещества не смешиваются друг с другом;
С. Явление проникновения частиц одного вещества в межмолекулярное пространство другого вещества.
D. Перемешивание веществ под влиянием внешних условий;
Е. Самопроизвольное перемешивание.
3.Какие параметры двух тел должны быть одинаковыми, чтобы они находились в тепловом равновесии?
А. объём и температура; В. масса и давление;
С. температура; D. давление и объем; Е. масса, температура.
температура; D. давление и объем; Е. масса, температура.
4.Какое явление, названное затем его именем, впервые наблюдал Роберт Броун?
А.Беспорядочное движение отдельных атомов;
В. Беспорядочное движение отдельных молекул;
С. Непрерывное движение мелких твердых частиц взвешенных в жидкости;
D. Опускание больших частиц на дно сосуда.
Е. Неподвижные частицы;
5.Укажите термодинамические параметры из перечисленных величин:
1. молярная масса, 2. температура, 3. скорость,4. давление, 5. концентрация, 6. число молекул, 7. объем. 8. количество вещества:
А. 1,2,3. В. 4,5,6. С. 7,8,2. D. 1,5,8. Е. 2,4,7.
6. В сосуде находится один моль вещества, чему равно число молекул этого вещества?
А. 6,02∙1023 штук; В.12∙10-12 штук; С. 1030штук; D. 6,02∙10-23 штук; Е. 6,02∙1020 штук .
1030штук; D. 6,02∙10-23 штук; Е. 6,02∙1020 штук .
7.Броуновское движение обусловлено:
А. Столкновением молекул жидкости друг с другом;
В. Столкновением частиц взвешенных в жидкости;
С. Столкновением молекул жидкости с частицами, взвешенными в ней;
D. Силами притяжения между молекулами;
Е. Силами отталкивания между частицами.
8. Какое примерно значение температуры по абсолютной шкале соответствует температуре 270С по шкале Цельсия?
А. 3270К; В.3000К; С.2730К; D.-2460К; Е.-270К.
9. В каких единицах измеряется абсолютная температура?
А.Паскалях; В Ваттах; С. Ньютонах; D. Градусах Цельсия; Е. Кельвинах.
10. Какое примерно значение температуры по шкале Цельсия соответствует температуре 2000 К по абсолютной шкале:
А. -730С; В.-4730С; С. 730С; D. 4730С; Е .нет правильного ответа.
-730С; В.-4730С; С. 730С; D. 4730С; Е .нет правильного ответа.
После ответа обучающиеся обмениваются заданиями и выполняют взаимопроверку. Учитель озвучивает правильные ответы задач для того, чтобы обучающиеся смогли оценить правильность своего решения.
Решение задач.
Задача 1: Известна температура некоего тела t = -27оС. Надо рассчитать давление по формуле: p = nkt.
Задача 2: В закрытом сосуде содержится газ при температуре 320 К. Какой должна быть конечная температура, чтобы давление газа возросло в три раза?
Устный экспресс-опрос.
— Самая низкая температура в природе, указанная Ломоносовым? (-2730С)
— Чему равна средняя температура человека, выраженная в Кельвинах? (309,6К)
— Чему равна скорость движения молекул при абсолютном нуле? (0 м/с)
6. Домашнее задание:
Домашнее задание:
1. Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский. Физика, 10 класс, М., «Просвещение», 2016. Повторить §59, 60 (с.195-197).
2. Выполнить письменно задания А1 – А4 (с.203).
3. По желанию: доклад о вкладе ученых в развитии физики: (Цельсий, Кельвин, Больцман).
Абсолютная температура связь с, термодинамикой
Абсолютная температура связь с термодинамикой 137 [c.137] Третий закон термодинамики не имеет такого общего характера, как первый закон термодинамики (на его основе получены две термодинамические функции V и Н) и второй закон термодинамики, который вводит в термодинамику новую функцию-энтропию 5. Третий закон термодинамики определяет только нижнее граничное значение энтропии для начала отсчета температуры. Отклонение энтропии от нулевого значения при температурах, близких к абсолютному нулю, связано с частичной аморфизацией твердого тела (дефекты в решетке) или с тем, что вещество содержит примеси (появление энтропии смешения). Однако эти отклонения не исключают возможности расчета изменения энтропий при химических реакциях, так как ошибка в расчете будет составлять значение Р п 2. [c.216]
Однако эти отклонения не исключают возможности расчета изменения энтропий при химических реакциях, так как ошибка в расчете будет составлять значение Р п 2. [c.216]
Абсолютная температура Т (47. 48) — обобщенная сила для явлений теплообмена (И, 18, 37). Отличается от температуры, определяемой произвольными термометрическими шкалами, тем что 1/Г — интегрирующий множитель для dQ. Связана с i — температурой по шкале Цельсия (7 = 273,15 К + i) и совпадает с температурой, входящей в уравнение состояния идеального газа. Во все уравнения термодинамики входит только Т. Термодинамически определена В. Томсоном (Кельвином) с помощью цикла Карно. [c.307]
Объемная скорость возникновения энтропии диссипации, умноженная на абсолютную температуру, согласно нестатической термодинамике связана с потенциалом, вызывающим плотность потока массы, [c.154]
Согласно принципам термодинамики для любого тела работа А, необ. ходимая для изотермической деформации, равна изменению его энергии Гельмгольца (свободной энергии) с1Р, которая, в свою очередь, связана с изменениями внутренней энергии сШ и энтропии 5 (Т — абсолютная температура) [c.303]
ходимая для изотермической деформации, равна изменению его энергии Гельмгольца (свободной энергии) с1Р, которая, в свою очередь, связана с изменениями внутренней энергии сШ и энтропии 5 (Т — абсолютная температура) [c.303]
Температура определяет возможность и направленность протекания холодильного процесса. В связи с этим для характеристики теплового процесса рабочего тела в термодинамике пользуются специальной функцией, называемой энтропией и обозначаемой буквой 5. Изменение энтропии при переходе рабочего тела из одного состояния в другое, близкое к нему, численно равно отношению количества подведенной теплоты к абсолютной температуре тела. [c.8]
Небольшая книга В. Ф. Леоновой глубоко своеобразна. Она представляет собой одну из первых попыток систематического изложения новой системы термодинамики, суш,ественно отличающейся от общепринятой и по своей логической структуре и по принципам построения. Характерная особенность этой системы заключается в том, что в ее основе лежит идея о полной тождественности форм представления всех равновесных взаимодействий независимо от их рода. Специфические особенности взаимодействий разного рода рассматриваются только в связи с необратимостью. Термодинамика обратимых процессов предстает как некоторая обобщенная универсальная статика. Это создает возможность просто и естественно ввести термодинамические параметры — в том числе и такие, как энтропия, абсолютная температура, химический потенциал — и столь же естественно определить их место в кругу исходных понятий термодинамики. [c.3]
Специфические особенности взаимодействий разного рода рассматриваются только в связи с необратимостью. Термодинамика обратимых процессов предстает как некоторая обобщенная универсальная статика. Это создает возможность просто и естественно ввести термодинамические параметры — в том числе и такие, как энтропия, абсолютная температура, химический потенциал — и столь же естественно определить их место в кругу исходных понятий термодинамики. [c.3]
В связи с тем, что нами для расчетов термодинамики химических реакций, использовались исходные данные, взятые из различных источников, возникает вопрос о различии этих данных для графита, водорода, кислорода и получаемых из них углеводородов. В табл. I приведены значения приращения энтальпии, функции энергии Гиббса и энтропий кислорода, водорода, графита, метана, этилена и ацетилена при температурах 298, 15,500, 1000 и 1500° К по двум источникам [34] и [55], а также показана разность между ними.
 Расхождения между этими величинами для кислорода и водорода сравнительно небольшие, в четвертом знаке. Для графита и углеводородов погрешности несколько большие. Абсолютная погрешность термодинамических величин для углеводородов с повышением температуры обычно увеличивается. [c.144]
Расхождения между этими величинами для кислорода и водорода сравнительно небольшие, в четвертом знаке. Для графита и углеводородов погрешности несколько большие. Абсолютная погрешность термодинамических величин для углеводородов с повышением температуры обычно увеличивается. [c.144] Анализируя поведение различных термодинамических систем при низких температурах вблизи абсолютного нуля. В. Нернст в 1906 г. сформулировал свою знаменитую тепловую теорему, которая и стала основой третьего начала термодинамики. В форме, первоначально предложенной Нернстом, теорема применялась только к конденсированным системам. Однако, несмотря на имеющиеся отступления (СО, стекла, аморфные твердые тела), можно считать, что теорема Нернста является законом, имеющим общее значение, а не только частное применение к некоторым системам или к отдельным химическим реакциям. К выводу тепловой теоремы Нернст пришел в связи с обсуждением вопроса о химическом сродстве при низких температурах. Как уже отмечалось (гл. VII), Томсоном и Бертло был установлен принцип, согласно которому возможность протекания реакции между конденсированными фазами определяется тепловым эффектом. Поскольку истинной мерой химического сродства в зависимости от условия протекания химической реакции является убыль либо свободной энергии Гиббса, либо свободной энергии Гельмгольца, то для изохорно-изо- [c.183]
VII), Томсоном и Бертло был установлен принцип, согласно которому возможность протекания реакции между конденсированными фазами определяется тепловым эффектом. Поскольку истинной мерой химического сродства в зависимости от условия протекания химической реакции является убыль либо свободной энергии Гиббса, либо свободной энергии Гельмгольца, то для изохорно-изо- [c.183]
В рамках термодинамики это был новый постулат, в связи с которым впоследствии возник вопрос о недостижимости абсолютного нуля температуры. Планк обобщил это положение, приняв 5а = 0. [c.64]
Поскольку Р У, Т)—характеристическая функция, из (УП.27) можно найти любые термодинамические величины, выражая их через 1п 2 и соответствующие производные от 1п2. Этим определяется особая роль суммы по состояниям 2 в статистической термодинамике. Хорошая модель системы в статистической термодинамике отличается от плохой в первую очередь возможностью или невозможностью вычислить сумму по состояниям 2. При этом пе всегда нужно искать полное выражение для 2. Для нахождения энергии и теплоемкости достаточно найти зависимость 1п2 от температуры расчет давления при заданной температуре связан только с определением зависимости 1п2 от объема системы и т. п. Это позволяет при решении отдельных задач использовать даже такие модели системы, для которых не удается полностью определить сумму по состояниям 2, но можно установить ее зависимость от Т или V. Однако вычисление энтропии, энергии Гельмгольца или химического потенциала связано с нахождением абсолютной величины 2. [c.208]
При этом пе всегда нужно искать полное выражение для 2. Для нахождения энергии и теплоемкости достаточно найти зависимость 1п2 от температуры расчет давления при заданной температуре связан только с определением зависимости 1п2 от объема системы и т. п. Это позволяет при решении отдельных задач использовать даже такие модели системы, для которых не удается полностью определить сумму по состояниям 2, но можно установить ее зависимость от Т или V. Однако вычисление энтропии, энергии Гельмгольца или химического потенциала связано с нахождением абсолютной величины 2. [c.208]
Согласно третьему закону термодинамики энтропия жидкой фазы, так же как и твердой, при абсолютном нуле температуры должна обращаться в нуль. В связи с этим приобретает большой интерес вопрос о распределении атомов в жидком гелии, особенно при наиболее низких температурах. Плотность жидкого гелия мала, под давлением насыщенных паров она составляет всего около 0,14 г/мл, что в значительной мере объясняется малой молекулярной массой гелия (заметим, что плотность жидкого водорода примерно в два раза меньше плотности жидкого гелия). Необычна зависимость плотности Не от температуры (рис. 61). Там же представлена температурная зависимость теплоемкости С вдоль линии равновесия жидкость — пар. При температуре 2,173 К и 49,80 10 Па плотность жидкого Не проходит через максимум, после чего функция р = /(Г) резко меняет свое направление, плотность быстро уменьшается. Теплоемкость тоже аномально зависит от температуры. Кривая теплоемкости похожа на греческую букву X. При 2,182 К теплоемкость является разрывной функцией. Здесь в жидком Не происходит фазовый переход второго рода. Температура этого фазового перехода ( Х-точки ) немного снижается при увеличении давления. Жидкую фазу при температурах, соответствующих Х-точкам и ниже, принято называть гелий II . Жидкая фаза при температурах, лежащих выше Х-точек, названа гелий 1 . [c.229]
Необычна зависимость плотности Не от температуры (рис. 61). Там же представлена температурная зависимость теплоемкости С вдоль линии равновесия жидкость — пар. При температуре 2,173 К и 49,80 10 Па плотность жидкого Не проходит через максимум, после чего функция р = /(Г) резко меняет свое направление, плотность быстро уменьшается. Теплоемкость тоже аномально зависит от температуры. Кривая теплоемкости похожа на греческую букву X. При 2,182 К теплоемкость является разрывной функцией. Здесь в жидком Не происходит фазовый переход второго рода. Температура этого фазового перехода ( Х-точки ) немного снижается при увеличении давления. Жидкую фазу при температурах, соответствующих Х-точкам и ниже, принято называть гелий II . Жидкая фаза при температурах, лежащих выше Х-точек, названа гелий 1 . [c.229]
Термодинамику в принципе нетрудно связать с квантовой химией. Вычисляемую квантовохимическим методом энергию атома или молекулы можно интерпретировать как абсолютную внутреннюю энергию и этого атома или молекулы (т. е. энергию при абсолютном нуле температуры). Вычисленные разности энергий (вращательной, колебательной и электронной) позволяют затем построить соответствующие статистические функции распределения. С помощью функций распределения может быть вычислена любая необходимая термодинамическая величина. (В некоторых случаях именно так и было сделано.) Если известны термодинамические свойства реагентов и продуктов, то можно определить положение химического равновесия. [c.380]
е. энергию при абсолютном нуле температуры). Вычисленные разности энергий (вращательной, колебательной и электронной) позволяют затем построить соответствующие статистические функции распределения. С помощью функций распределения может быть вычислена любая необходимая термодинамическая величина. (В некоторых случаях именно так и было сделано.) Если известны термодинамические свойства реагентов и продуктов, то можно определить положение химического равновесия. [c.380]
Тепловая теорема Нернста не является необходимой для решения задач о тепловых машинах и других чисто физических проблем, но составляет неотъемлемую часть химической термодинамики. Первая вполне удовлетворительная формулировка третьего закона была дана Льюисом и Рэндаллом [379, стр. 448] Если принять энтропию всякого элемента в некотором кристаллическом состоянии при абсолютном нуле температуры равной нулю, то каждое вещество имеет конечную положительную энтропию-, однако при абсолютном нуле температуры энтропия может обращаться-в нуль и действительно становится равной нулю в случае совершенных кристаллических веществ .
 В связи с определением совершенного кристаллического вещества третий закон является единственным постулатом термодинамики, который требует по крайней мере частичного рассмотрения микроскопической природы вещества. Таким образом, при помощи методов классической термодинамики нельзя достичь полного понимания третьего закона для этого требуется применение квантовой статистики, о чем пойдет речь в следующем разделе. Коротко говоря, методами статистической термодинамики было показано, что энтропия системы непосредственно связана с ее количественно выражаемой вероятностью. Неупорядоченность в природе более вероятна, чем упорядоченность, а, следовательно, состояние максимальной упорядоченности имеет минимальную вероятность и об-ладает соответственно минимальной энтропией. Поэтому состояние нулевой энтропии соответствует совершенному порядку, достигаемому только при 0° К, так что совершенное кристаллическое вещество — это такое вещество, в котором не наблюдается какой бы то ни было неупорядоченности.
В связи с определением совершенного кристаллического вещества третий закон является единственным постулатом термодинамики, который требует по крайней мере частичного рассмотрения микроскопической природы вещества. Таким образом, при помощи методов классической термодинамики нельзя достичь полного понимания третьего закона для этого требуется применение квантовой статистики, о чем пойдет речь в следующем разделе. Коротко говоря, методами статистической термодинамики было показано, что энтропия системы непосредственно связана с ее количественно выражаемой вероятностью. Неупорядоченность в природе более вероятна, чем упорядоченность, а, следовательно, состояние максимальной упорядоченности имеет минимальную вероятность и об-ладает соответственно минимальной энтропией. Поэтому состояние нулевой энтропии соответствует совершенному порядку, достигаемому только при 0° К, так что совершенное кристаллическое вещество — это такое вещество, в котором не наблюдается какой бы то ни было неупорядоченности. Такое вещество имеет следующие характерные особенности а) абсолютная-химическая чистота б) упорядоченное расположение ионов, атомов или молекул в регулярной решетке в) упорядоченная ориентация всех многоатомных групп по отношению к решетке и г) упорядоченное положение магнитных моментов атомов. Многие факторы могут вызывать несовершенства реального состояния вещества вблизи абсолютного нуля. Любая неупорядоченность расположения молекул в узлах решетки приводит [c.12]
Такое вещество имеет следующие характерные особенности а) абсолютная-химическая чистота б) упорядоченное расположение ионов, атомов или молекул в регулярной решетке в) упорядоченная ориентация всех многоатомных групп по отношению к решетке и г) упорядоченное положение магнитных моментов атомов. Многие факторы могут вызывать несовершенства реального состояния вещества вблизи абсолютного нуля. Любая неупорядоченность расположения молекул в узлах решетки приводит [c.12]Демон Лапласа, этот абсолютный ум, разрущается третьим законом термодинамики (невозможностью достижения абсолютного нуля температуры). Чтобы понять третий закон, обратимся к связи между энтропией и информацией. Такой экскурс поможет читателю во многих частях этой книги. [c.31]
В результате сохранения вращательных уровней обычного водорода в твердом состоянии при низких температурах его внутренняя энтропия будет равна 4,39 единиц, а не нулю, как следует теоретически, если бы все молекулы перешли в параформу согласно третьему закону термодинамики. Следовательно, для получения правильного значения абсолютной энтропии при 298,1° К к экспериментальному значению в 29,64 единиц надо прибавить разность 4,39 единиц, в результате получим 34,03 единиц. Это значение получалось бы, конечно, всегда, если равновесие орто-пара устанавливалось бы быстро при всех температурах, тогда все молекулы находились бы на нулевом вращательном уровне, и вращения в твердом состоянии не наблюдалось бы. Полученное значение энтропии (34,03 единицы) настолько хорошо совпадает с вычисленным (33,98 единиц), что последнее можно считать несомненно правильным. Если применять энтропию водорода в связи с калориметрическими величинами для других веществ, для которых вращения в твердом состоянии не наблюдается, то необходимо вычесть слагаемое, вызванное спином [c.95]
Следовательно, для получения правильного значения абсолютной энтропии при 298,1° К к экспериментальному значению в 29,64 единиц надо прибавить разность 4,39 единиц, в результате получим 34,03 единиц. Это значение получалось бы, конечно, всегда, если равновесие орто-пара устанавливалось бы быстро при всех температурах, тогда все молекулы находились бы на нулевом вращательном уровне, и вращения в твердом состоянии не наблюдалось бы. Полученное значение энтропии (34,03 единицы) настолько хорошо совпадает с вычисленным (33,98 единиц), что последнее можно считать несомненно правильным. Если применять энтропию водорода в связи с калориметрическими величинами для других веществ, для которых вращения в твердом состоянии не наблюдается, то необходимо вычесть слагаемое, вызванное спином [c.95]
В рамках термодинамики это выступает как новый постулат, с которым впоследствии были связаны вопросы о недостижимости температуры абсолютного нуля. [c.49]
Шкалы термометров с различными термометрическими телами различны и отражают физические особенности этих тел. В термодинамике температура является весьма важной физической величиной — термическим потенциалом — и поэтому, естественно, возникает вопрос о построении такой шкалы температур, которая не была бы связана со свойствами какого бы то ни было термометрического вещества. Такого рода шкалу можно считать абсолютной в смысле ее независимости от свойств вещества. [c.95]
В термодинамике температура является весьма важной физической величиной — термическим потенциалом — и поэтому, естественно, возникает вопрос о построении такой шкалы температур, которая не была бы связана со свойствами какого бы то ни было термометрического вещества. Такого рода шкалу можно считать абсолютной в смысле ее независимости от свойств вещества. [c.95]
Лишь после установления первого и второго начала термодинамики великому английскому физику прошлого веса Кельвину удалось доказать, что температура тел может быть определена рне зависимости от выбора термометрического вещества и свойства последнего, используемого на практике для измерения температуры, а также доказать существование абсолютного нуля температуры, т. е. доказать, что понятие температуры тел имеет объективный и абсолютный смысл. В связи с этим были предложены две абсолютные температурные шкалы — Кельвина и Ренкина, отличающиеся величиной принятой в них единицы измерения температуры. В шкале Кельвина был принят градус Цельсия, а в шкале Ренкина — градус Фаренгейта . [c.44]
[c.44]
Энтропия. Выше было показано, что система при своем превращении может совершать работу лишь в том случае, когда она переходит от более высокой температуры То к другой, более низкой температуре Т . Важным следствием второго закона термодинамики является то, что максимальная работа, которая может быть произведена в условиях обратимого процесса, зависит не только от разности температур Та — Т , но и от абсолютной величины температуры Т . Поэтому проводили исследования с целью установления связи между количеством тепла д, выделяемого или поглощаемого системой, и температурой Т, при которой происходит теплообмен. Это привело к введению новой термодинамической функции, называемой энтропией 8. [c.189]
Здесь существенно подчеркнуть, что вещество должно быть чистым, а кристалл лишенным дефектов. Наличие примесей и дефектов в кристаллической решетке увеличивают энтропию. Высказывая утверждение, Планк основывался на известных уже в то время свойствах веществ при температурах, близких к абсолютному нулю. Оьгласно более поздним экспериментальным данным и теории [функция Дебая (11.120)] теплоемкость не только стремится к нулю при Т О, но убывает значительно быстрее температуры, а именно пропорционально ее кубу, поэтому подынтегральная функция (111.22) или (111.23) с понижением температуры стремится к нулю. Известно, что тела в области низких температур как бы теряют связь с миром тепловых явлений — многие их свойства (в том числе теплоемкость, объем, энтропия перестают зависеть от температуры). В термодинамике химических реакций известно положение, называемое теоремой Нернста, согласно которому производная теплового эффекта потемпературе стремится к нулю с понижением температуры. Все это, конечно, не доказывает постулативное положение. Более убедительное объяснение постулата Планка доставляет статистическая термодинамика (см. гл. VI), согласно которой [c.83]
Оьгласно более поздним экспериментальным данным и теории [функция Дебая (11.120)] теплоемкость не только стремится к нулю при Т О, но убывает значительно быстрее температуры, а именно пропорционально ее кубу, поэтому подынтегральная функция (111.22) или (111.23) с понижением температуры стремится к нулю. Известно, что тела в области низких температур как бы теряют связь с миром тепловых явлений — многие их свойства (в том числе теплоемкость, объем, энтропия перестают зависеть от температуры). В термодинамике химических реакций известно положение, называемое теоремой Нернста, согласно которому производная теплового эффекта потемпературе стремится к нулю с понижением температуры. Все это, конечно, не доказывает постулативное положение. Более убедительное объяснение постулата Планка доставляет статистическая термодинамика (см. гл. VI), согласно которой [c.83]
До сих пор в наших рассуждениях одна из основных физических величии упоминалась лишь от случая к случаю, хотя в живой и неживой природе она играет первостепенную роль. Речь идет о термодинамической температуре Г. В С1и теме СИ она выражается в градусах Кельвина (К). Кельвин представляет собой одну 273,16-ую часть интервала между температурой абсолютной нулевой точки термодинамики и температурой тройной точки воды. При нуле К химические частицы остаются неподвижными, их кинетическая энергия равна нулю. Мольная внутренняя энергия i/o вендества в точке абсолютного нуля представляет собой исключительно потенциальную энергию. Она равна сумме потенциальных энергий химических связей, водородных связей, несвяз ных и межмолекулярных взаимодействий, а также колебательной энергии молекул в нулевой точке (см. раздел 1.4.6). [c.115]
Речь идет о термодинамической температуре Г. В С1и теме СИ она выражается в градусах Кельвина (К). Кельвин представляет собой одну 273,16-ую часть интервала между температурой абсолютной нулевой точки термодинамики и температурой тройной точки воды. При нуле К химические частицы остаются неподвижными, их кинетическая энергия равна нулю. Мольная внутренняя энергия i/o вендества в точке абсолютного нуля представляет собой исключительно потенциальную энергию. Она равна сумме потенциальных энергий химических связей, водородных связей, несвяз ных и межмолекулярных взаимодействий, а также колебательной энергии молекул в нулевой точке (см. раздел 1.4.6). [c.115]
Понятие о частичных количествах вещества, если не дает а применении к скрытому теплу испарения прямо строгого закона, то по крайней мере позволяет видеть некоторую равномерность в числах, иначе представляющих один простой вывод наблюдения. Частичные количества жидкостей оказываются расходующими на испарение почти одинаковые количества тепла. Более тесную связь между скрытым теплом испарения L и частичным весом М веществ показывают законы термодинамики, в зависимости от абсолютной температуры кипения Т = 273 t (Персон, Рамзай, Форкран, Ле Шателье, Коновалов и др.), что видно и в эмпирическо.м законе Траутона, а именно [c.536]
Более тесную связь между скрытым теплом испарения L и частичным весом М веществ показывают законы термодинамики, в зависимости от абсолютной температуры кипения Т = 273 t (Персон, Рамзай, Форкран, Ле Шателье, Коновалов и др.), что видно и в эмпирическо.м законе Траутона, а именно [c.536]
Связь абсолютной шкалы со шкалами, основанными на свойствах веществ. Относительная простота формы термодинамических уравнений происходит от способа, которым Кельвин определил абсолютную температуру. При использовании температурной шкалы, осйо-)ванной на свойствах каких-либо конкретных веществ, все эти уравнения были бы гораздо сложнее. Во всех обычных термодинамических формулах всегда применяется абсолютная (термодинамическая) температура н никакая иная. В этЬм смысле любая термодинамическая формула или уравнение могут считаться определением абсолютной температуры. Это, однако, не означает, что термодинамические формулы являются исключительно предмётом определения без реальной фактической основы, так как вполне достоверно, что абсолютную тевгаературу можно определить, а это и есть сущность второго закона термодинамики, из которого выведены многие точные соотношения и ни одно из них не оказалось противоречащим практике. [c.110]
[c.110]
Здесь существенно подчеркнуть, что вещество должно быть чистым, а кристалл лишенным дефектов. Наличие примесей и дефектов в кристаллической решетке увеличивает энтропию. Высказывая приведенное утверждение, Планк основывался на известных уже в то время свойствах веществ при температурах, близких к абсолютному нулю. Согласно более поздним экспериментальным данным и теории [функция Дебая (2.147)] теплоемкость не только стремится к нулю при Т О, но убывает значительно быстрее температуры, а именно пропорционально ее кубу, поэтому подынтегральная функция (3.43) или (3.44) с понижением температуры стремится к нулю. Известно, что тела в области низких температур как бы теряют связь с миром тепловых явлений — многие их свойства (в том числе теплоемкость, объем, энтропия перестают зависеть от температуры). В термодинамике химических реакций известно положение, называемое теоремой Нернста, согласно которому производная теплового эффекта по температуре стремится к нулю с понижением температуры. Все это, конечно, не доказывает постулатив-ное положение. Более убедительное объяснение постулата Планка доставляет статистическая термодинамика (см. гл. VI), согласно которой энтропия представляет меру беспорядочности молекулярного состояния системы. С этой точки зрения кристалл с идеальной кристаллической решеткой при абсолютном нуле является примером предельной упорядоченности и его энтропия равна нулю. Наиболее беспорядочному, хаотизированному газообразному состоянию свойственна наибольшая энтропия. [c.98]
Все это, конечно, не доказывает постулатив-ное положение. Более убедительное объяснение постулата Планка доставляет статистическая термодинамика (см. гл. VI), согласно которой энтропия представляет меру беспорядочности молекулярного состояния системы. С этой точки зрения кристалл с идеальной кристаллической решеткой при абсолютном нуле является примером предельной упорядоченности и его энтропия равна нулю. Наиболее беспорядочному, хаотизированному газообразному состоянию свойственна наибольшая энтропия. [c.98]
Больцман дал очень ясную интерпретацию понятия энтропии, связав ее с упорядоченностью и неупорядоченностью на молекулярном уровне. В приложении 3 наряду со стандартными теплотами образования веществ приводятся также их стандартные энтропии, 5298. Не следует думать, однако, что эти величины получены из больцмановского выражения 5 = /с 1п И . Они определяются в результате калориметрических измерений теплоемкостей твердых, жидких или газообразных веществ, а также теплот плавления и испарения при комнатной температуре и их экстраполяции к абсолютному нулю. (Способы вычисления значений 5 из таких чисто термохимических данных излагаются в более серьезных курсах химии.) Эти табулированные значения Хгдв называют абсолютными энтропиями, основанными на третьем законе термодинамики. Дело в том, что рассуждения, на которых основано их вычисление по данным тепловых измерений, были бы неполными без предположения, называемого третьим законом термодинамики и гласящего энтропия идеального крщ тйлла при абсолютном нуле температур равна нулю. Содержание третьего закона представляется очевидным, если исходить из больцмановской статистической интерпретации энтропии. [c.61]
Значение энтропии при температурах, близких к абсолютному нулю, необходимо для решения практических и теоретических термохимических задач, и это в значительной степени стимулировало появление третьего закона термодинамики. В 1906 г. Нернст пришел к выводу, что изменение энтропии химической реакции вблизи абсолютного нуля пренебрежимо мало. В 1912 г. Планк показал, что кристаллическая решетка индивидуального вешества при абсолютном нуле характеризуется максимальной степенью упорядоченности и в связи с этим должна обладать нулевой энтропией. Льюис и Ренделл указали на применимость закона к химическим системам. Если энтропию каждого элемента в некотором кристаллическом состоянии принять равной нулю при температуре О К, то каждое вещество при определенной температуре Т будет обладать некоторым конечным положительным значением энтропии однако при температуре абсолютного нуля энтропия может оказаться равной нулю. Такая ситуация имеет место в случае совершенных кристаллических веществ. [c.49]
Рассмотрение третьего закона термодинамики и его приложений выходит за рамки настоящей работы, в связи с чем абсолютные значения химического потенциала здесь не определяются. Зависимость химического потенциала от температуры при отсутствии абсолютных значений энтропи11 становится функцией стандартного состояния. [c.142]
Значения энтропии при температурах, близких к абсолютному нулю, необходимы для решения практических и теоретических термохимических задач, и это в значительной степени стимулировало появление дополнительного постулата, так называемого третьего закона термодинамики. В 1906 г. Нернст [1053] пришел к выводу, что изменение энтропии химической реакции вблизи абсолютного нуля пренебрежимо мало. В 1912 г. Планк [1168] показал, что кристаллическая решетка индивидуального вещества при абсолютном нуле характеризуется максимальной степенью упорядоченности и в связи с этим должна обладать нулевой энтропией. Симон [1350] и позднее Уилкс [1613] рассмотрели развитие этой концепции начиная с тепловой теоремы Нернста и до наших дней. Тепловая теорема Нернста и ее практическое использование были подробно обсуждены Астоном [30]. Льюис и Ренделл [860] раскрыли квантово-механическую природу этого постулата и указали па его применимость к химическим системам [c.109]
Итак, если только ограничиться рассмотрением обратимых процессов, то предположение об аналогичном характере тепловой энергии и других видов энергии в том отношении, что энергию любого вида можно представить как произведение потенциала на фактор емкости, приводит к уравнениям для вычисления коэффициентов полезного действия тепловых машин. Эти уравнения аналогичны уравнениям, применяющимся для расчета коэффициентов полезного действия других обрати-мьих машин и для установления абсолютной шкалы температур. Заметим попутно, что влияние необратимого течения процессов на коэффициент полезного действия будет рассмотрено в приложении С. Обычно вопросы, упомянутые выше, излагаются в учебниках после того, как сформулировано второе начало термодинамики. Но сейчас ясно, что они связаны с элементарным толкованием действия обратимых машин, основанным на приложении уравнений (11.1) — (11-4) к тепловой энергии. Если бы мы были готовы принять представление о тепловой энергии еще до подробного обсуждения первого начала термодинамики, то можно было бы 11.8 поместить после 11.4. И действительно, существует ряд данных, свидетельствующих, что этим ходом рассуждений пользовался Сади Карно, правда, возможно, в известной мере интуитивно и е отдавая себе полного отчета о вытекающих из него практических следствиях. Сади Карно еще в 1824 г. дал правильное уравнение для вычисления коэффициента полезного действия тепловой машины, задолго до того как были сформулированы [c.225]
С точки зрения молекулярно-кинетических представлений при абсолютном нуле температуры все тела имеют структуру вполне идеальных кристаллов без трещин и дислокаций. При Го = О К энтропия достигает своего минимума и становится величиной постоянной — константой для всех материальных систем . Абсолютную величину этой константы определить не удается. В связи с этим как основа для расчета количественного выражения энтропии систем принимается положение, внесенное в термодинамику В. Нернстом энтропия любой термодинамической системы при абсолютном нуле температуры принимается равной нулю, т. е. при Го = ОКи5о = 0. Этот постулат и лежит в основе третьего закона термодинамики, часто называемого также тепловой теоремой Периста. [c.171]
За истекшие годы то, что сделал Гиббс, дополнено было только в одном отношении, а именно были установлены способы теоретического и эмпирического вычисления потенциалов. Развитие статистики сделало возможным теоретическое вычисление потенциалов газов из оптических данных, а для твердых тел — из констант упругости. Эмпирическое определение потенциалов химически простых веществ тепловой закон Нернста позволил свести в основном к изучению зависимости теплоемкости от температуры. Для химических соединений нужно знать еще предел, к которому стремится теплота образования при понижении температуры до абсолютного нуля. Для растворов эмпирическое вычисление потенциалов как функций концентрации было сведено Льюисом к определению по экспериментальным данным активности, в связи с чем гальваническая цепь сделалась важнейшим измерительным прибором экспериментальной термодинамики. Метод Льюиса не внес в термодинамику ничего принципиально нового. Тем не менее он оказался плодотвбрным, так как привел эмпирику в области растворов к разумной стандартизации. Помимо того, метод Льюиса вызвал попытки молекулярно-теоретического расчета активности. [c.205]
ЭВОЛЮЦИИ. Они, в свою очередь, определяют все возможные эволюционные ряды на всех количественных уровнях мироздания. Преимущество уравнения (21) по сравнению с прежними уравнениями (14) и (15) заключается в том, что на практике обычно легче находится изменение некоторой величиньГ, чем ее абсолютное значение, ибо тогда данную величину можно отсчитывать уже от любого условного, а не абсолютного нуля отсчета. Например, в термодинамике изменения внутренней энергии, энтропии, температуры и других характеристик определяются значительно проще, чем абсолютные значения этих величин, причем существуют различные условные нули их отсчета. Тем не менее и в данном случае трудность проблемы заключается в том, что непосредственно извлечь законы эволюции из уравнения (21) практически невозможно вследствие предельной общности последнего. Кроме того, оно, как и уравнения (14) и (15), в известном смысле условно, ибо в обобщенной форме выражает лишь принципиальную сторону имеющихся связей (об этом уже говорилось в гл. И). [c.56]
Большая величина ЯактСАЯ ) в приведенном уравнении — это именно то, что отличает тепловую денатурацию белков от обычных химических процессов. Поэтому с изменением температуры скорость денатурации изменяется очень быстро. Величину АО можно рассчитать на основе теории абсолютных скоростей реакций. При скорости денатурации в пределах 10 —величина ДОФ составляет около 80 кДжХ Хмоль-. Так как ДЯ Ф АОФ+7 А5Ф, а величина ДЯФ обычно лежит в пределах 300—500 кДж мoль- из этого следует, что Д5Ф имеет необычно большую величину, лежащую между 200 и 1000 Дж-град- Х Хмоль- Этот факт имеет очень простое объяснение. В начале денатурации происходит разрыв множества связей, значительные конформационные перестройки белка и высвобождение ассоциированных молекул растворителя, что сопровождается увеличением энтропии, т. е. возрастанием степени неупорядоченности. Величина Д5 для процесса денатурации в целом, при полной неупорядоченности полипептидных цепей, может составлять несколько тысяч Дж-град- моль Процесс денатурации может включать несколько стадий, идущих по различным альтернативным путям, однако для описания всего процесса в целом с точки зрения термодинамики необходимо знать только величину энергии активации самой медленной стадии. Такой стадией обычно является первая стадия процесса. [c.84]
Основные единицы системы СИ — Тихоокеанский государственный университет
Метрическая система — это общее название международной десятичной системы единиц, основными единицами которой являются метр и килограмм. При некоторых различиях в деталях элементы системы одинаковы во всем мире.
Эталоны длины и массы, международные прототипы. Международные прототипы эталонов длины и массы — метра и килограмма — были переданы на хранение Международному бюро мер и весов, расположенному в Севре — пригороде Парижа. Эталон метра представлял собой линейку из сплава платины с 10% иридия, поперечному сечению которой для повышения изгибной жесткости при минимальном объеме металла была придана особая X-образная форма. В канавке такой линейки была продольная плоская поверхность, и метр определялся как расстояние между центрами двух штрихов, нанесенных поперек линейки на ее концах, при температуре эталона, равной 0° С. За международный прототип килограмма была принята масса цилиндра, сделанного из того же платино-иридиевого сплава, что и эталон метра, высотой и диаметром около 3,9 см. Вес этой эталонной массы, равной 1 кг на уровне моря на географической широте 45°, иногда называют килограмм-силой. Таким образом, ее можно использовать либо как эталон массы для абсолютной системы единиц, либо как эталон силы для технической системы единиц, в которой одной из основных единиц является единица силы.
Международная система СИ. Международная система единиц (СИ) представляет собой согласованную систему, в которой для любой физической величины, такой, как длина, время или сила, предусматривается одна и только одна единица измерения. Некоторым из единиц даны особые названия, примером может служить единица давления паскаль, тогда как названия других образуются из названий тех единиц, от которых они произведены, например единица скорости — метр в секунду. Основные единицы вместе с двумя дополнительными геометрического характера представлены в табл. 1. Производные единицы, для которых приняты особые названия, даны в табл. 2. Из всех производных механических единиц наиболее важное значение имеют единица силы ньютон, единица энергии джоуль и единица мощности ватт. Ньютон определяется как сила, которая придает массе в один килограмм ускорение, равное одному метру за секунду в квадрате. Джоуль равен работе, которая совершается, когда точка приложения силы, равной одному ньютону, перемещается на расстояние один метр в направлении действия силы. Ватт — это мощность, при которой работа в один джоуль совершается за одну секунду. Об электрических и других производных единицах будет сказано ниже. Официальные определения основных и дополнительных единиц таковы.
Метр — это длина пути, проходимого в вакууме светом за 1/299 792 458 долю секунды.
Килограмм равен массе международного прототипа килограмма.
Секунда — продолжительность 9 192 631 770 периодов колебаний излучения, соответствующего переходам между двумя уровнями сверхтонкой структуры основного состояния атома цезия-133.
Кельвин равен 1/273,16 части термодинамической температуры тройной точки воды.
Моль равен количеству вещества, в составе которого содержится столько же структурных элементов, сколько атомов в изотопе углерода-12 массой 0,012 кг.
Радиан — плоский угол между двумя радиусами окружности, длина дуги между которыми равна радиусу.
Стерадиан равен телесному углу с вершиной в центре сферы, вырезающему на ее поверхности площадь, равную площади квадрата со стороной, равной радиусу сферы.
| Таблица 1. Основные единицы СИ | |||
|---|---|---|---|
| Величина | Единица | Обозначение | |
| Наименование | русское | международное | |
| Длина | метр | м | m |
| Масса | килограмм | кг | kg |
| Время | секунда | с | s |
| Сила электрического тока | ампер | А | A |
| Термодинамическая температура | кельвин | К | K |
| Сила света | кандела | кд | cd |
| Количество вещества | моль | моль | mol |
| Дополнительные единицы СИ | |||
| Величина | Единица | Обозначение | |
| Наименование | русское | международное | |
| Плоский угол | радиан | рад | rad |
| Телесный угол | стерадиан | ср | sr |
| Таблица 2. Производные единицы СИ, имеющие собственные наименования | ||||
|---|---|---|---|---|
| Величина | Единица | Выражение производной единицы | ||
| Наименование | Обозначение | через другие единицы СИ | через основные и дополнительные единицы СИ | |
| Частота | герц | Гц | — | с-1 |
| Сила | ньютон | Н | — | м кг с-2 |
| Давление | паскаль | Па | Н/м2 | м-1 кг с-2 |
| Энергия, работа, количество теплоты | джоуль | Дж | Н м | м2 кг с-2 |
| Мощность, поток энергии | ватт | Вт | Дж/с | м2 кг с-3 |
| Количество электричества, электрический заряд | кулон | Кл | А с | с А |
| Электрическое напряжение, электрическийпотенциал | вольт | В | Вт/А | м2 кгс-3 А-1 |
| Электрическая емкость | фарада | Ф | Кл/В | м-2 кг-1 с4 А2 |
| Электрическое сопротивление | ом | Ом | В/А | м2 кг с-3 А-2 |
| Электрическая проводимость | сименс | См | А/В | м-2 кг-1 с3 А2 |
| Поток магнитной индукции | вебер | Вб | В с | м2 кг с-2 А-1 |
| Магнитная индукция | тесла | Т, Тл | Вб/м2 | кг с-2 А-1 |
| Индуктивность | генри | Г, Гн | Вб/А | м2 кг с-2 А-2 |
| Световой поток | люмен | лм | кд ср | |
| Освещенность | люкс | лк | м2 кд ср | |
| Активность радиоактивного источника | беккерель | Бк | с-1 | с-1 |
| Поглощенная доза излучения | грэй | Гр | Дж/кг | м2 с-2 |
Для образования десятичных кратных и дольных единиц предписывается ряд приставок и множителей, указываемых в табл. 3.
| Таблица 3. Приставки и множители десятичных кратных и дольных единиц международной системы СИ | |||||
|---|---|---|---|---|---|
| экса | Э | 1018 | деци | д | 10-1 |
| пета | П | 1015 | санти | с | 10-2 |
| тера | Т | 1012 | милли | м | 10-3 |
| гига | Г | 109 | микро | мк | 10-6 |
| мега | М | 106 | нано | н | 10-9 |
| кило | к | 103 | пико | п | 10-12 |
| гекто | г | 102 | фемто | ф | 10-15 |
| дека | да | 101 | атто | а | 10-18 |
Таким образом, километр (км) — это 1000 м, а миллиметр — 0,001 м. (Эти приставки применимы ко всем единицам, как, например, в киловаттах, миллиамперах и т.д.)
Масса, длина и время. Все основные единицы системы СИ, кроме килограмма, в настоящее время определяются через физические константы или явления, которые считаются неизменными и с высокой точностью воспроизводимыми. Что же касается килограмма, то еще не найден способ его реализации с той степенью воспроизводимости, которая достигается в процедурах сравнения различных эталонов массы с международным прототипом килограмма. Такое сравнение можно проводить путем взвешивания на пружинных весах, погрешность которых не превышает 1 10-8. Эталоны кратных и дольных единиц для килограмма устанавливаются комбинированным взвешиванием на весах.
Поскольку метр определяется через скорость света, его можно воспроизводить независимо в любой хорошо оборудованной лаборатории. Так, интерференционным методом штриховые и концевые меры длины, которыми пользуются в мастерских и лабораториях, можно проверять, проводя сравнение непосредственно с длиной волны света. Погрешность при таких методах в оптимальных условиях не превышает одной миллиардной (1 10-9). С развитием лазерной техники подобные измерения весьма упростились, и их диапазон существенно расширился.
Точно так же секунда в соответствии с ее современным определением может быть независимо реализована в компетентной лаборатории на установке с атомным пучком. Атомы пучка возбуждаются высокочастотным генератором, настроенным на атомную частоту, и электронная схема измеряет время, считая периоды колебаний в цепи генератора. Такие измерения можно проводить с точностью порядка 1 10-12 — гораздо более высокой, чем это было возможно при прежних определениях секунды, основанных на вращении Земли и ее обращении вокруг Солнца. Время и его обратная величина — частота — уникальны в том отношении, что их эталоны можно передавать по радио. Благодаря этому всякий, у кого имеется соответствующее радиоприемное оборудование, может принимать сигналы точного времени и эталонной частоты, почти не отличающиеся по точности от передаваемых в эфир.
Механика. Исходя из единиц длины, массы и времени, можно вывести все единицы, применяемые в механике, как было показано выше. Если основными единицами являются метр, килограмм и секунда, то система называется системой единиц МКС; если — сантиметр, грамм и секунда, то — системой единиц СГС. Единица силы в системе СГС называется диной, а единица работы — эргом. Некоторые единицы получают особые названия, когда они используются в особых разделах науки. Например, при измерении напряженности гравитационного поля единица ускорения в системе СГС называется галом. Имеется ряд единиц с особыми названиями, не входящих ни в одну из указанных систем единиц. Бар, единица давления, применявшаяся ранее в метеорологии, равен 1 000 000 дин/см2. Лошадиная сила, устаревшая единица мощности, все еще применяемая в британской технической системе единиц, а также в России, равна приблизительно 746 Вт.
Температура и теплота. Механические единицы не позволяют решать все научные и технические задачи без привлечения каких-либо других соотношений. Хотя работа, совершаемая при перемещении массы против действия силы, и кинетическая энергия некой массы по своему характеру эквивалентны тепловой энергии вещества, удобнее рассматривать температуру и теплоту как отдельные величины, не зависящие от механических.
Термодинамическая шкала температуры. Единица термодинамической температуры Кельвина (К), называемая кельвином, определяется тройной точкой воды, т.е. температурой, при которой вода находится в равновесии со льдом и паром. Эта температура принята равной 273,16 К, чем и определяется термодинамическая шкала температуры. Данная шкала, предложенная Кельвином, основана на втором начале термодинамики. Если имеются два тепловых резервуара с постоянной температурой и обратимая тепловая машина, передающая тепло от одного из них другому в соответствии с циклом Карно, то отношение термодинамических температур двух резервуаров дается равенством T2 /T1 = -Q2Q1, где Q2 и Q1 — количества теплоты, передаваемые каждому из резервуаров (знак <минус> говорит о том, что у одного из резервуаров теплота отбирается). Таким образом, если температура более теплого резервуара равна 273,16 К, а теплота, отбираемая у него, вдвое больше теплоты, передаваемой другому резервуару, то температура второго резервуара равна 136,58 К. Если же температура второго резервуара равна 0 К, то ему вообще не будет передана теплота, поскольку вся энергия газа была преобразована в механическую энергию на участке адиабатического расширения в цикле. Эта температура называется абсолютным нулем. Термодинамическая температура, используемая обычно в научных исследованиях, совпадает с температурой, входящей в уравнение состояния идеального газа PV = RT, где P — давление, V — объем и R — газовая постоянная. Уравнение показывает, что для идеального газа произведение объема на давление пропорционально температуре. Ни для одного из реальных газов этот закон точно не выполняется. Но если вносить поправки на вириальные силы, то расширение газов позволяет воспроизводить термодинамическую шкалу температуры.
Международная температурная шкала. В соответствии с изложенным выше определением температуру можно с весьма высокой точностью (примерно до 0,003 К вблизи тройной точки) измерять методом газовой термометрии. В теплоизолированную камеру помещают платиновый термометр сопротивления и резервуар с газом. При нагревании камеры увеличивается электросопротивление термометра и повышается давление газа в резервуаре (в соответствии с уравнением состояния), а при охлаждении наблюдается обратная картина. Измеряя одновременно сопротивление и давление, можно проградуировать термометр по давлению газа, которое пропорционально температуре. Затем термометр помещают в термостат, в котором жидкая вода может поддерживаться в равновесии со своими твердой и паровой фазами. Измерив его электросопротивление при этой температуре, получают термодинамическую шкалу, поскольку температуре тройной точки приписывается значение, равное 273,16 К.
Существуют две международные температурные шкалы — Кельвина (К) и Цельсия (С). Температура по шкале Цельсия получается из температуры по шкале Кельвина вычитанием из последней 273,15 К.
Точные измерения температуры методом газовой термометрии требуют много труда и времени. Поэтому в 1968 была введена Международная практическая температурная шкала (МПТШ). Пользуясь этой шкалой, термометры разных типов можно градуировать в лаборатории. Данная шкала была установлена при помощи платинового термометра сопротивления, термопары и радиационного пирометра, используемых в температурных интервалах между некоторыми парами постоянных опорных точек (температурных реперов). МПТШ должна была с наибольшей возможной точностью соответствовать термодинамической шкале, но, как выяснилось позднее, ее отклонения весьма существенны.
Температурная шкала Фаренгейта. Температурную шкалу Фаренгейта, которая широко применяется в сочетании с британской технической системой единиц, а также в измерениях ненаучного характера во многих странах, принято определять по двум постоянным опорным точкам — температуре таяния льда (32° F) и кипения воды (212° F) при нормальном (атмосферном) давлении. Поэтому, чтобы получить температуру по шкале Цельсия из температуры по шкале Фаренгейта, нужно вычесть из последней 32 и умножить результат на 5/9.
Единицы теплоты. Поскольку теплота есть одна из форм энергии, ее можно измерять в джоулях, и эта метрическая единица была принята международным соглашением. Но поскольку некогда количество теплоты определяли по изменению температуры некоторого количества воды, получила широкое распространение единица, называемая калорией и равная количеству теплоты, необходимому для того, чтобы повысить температуру одного грамма воды на 1° С. В связи с тем что теплоемкость воды зависит от температуры, пришлось уточнять величину калории. Появились по крайней мере две разные калории — <термохимическая> (4,1840 Дж) и <паровая> (4,1868 Дж). <Калория>, которой пользуются в диететике, на самом деле есть килокалория (1000 калорий). Калория не является единицей системы СИ, и в большинстве областей науки и техники она вышла из употребления.
Электричество и магнетизм. Все общепринятые электрические и магнитные единицы измерения основаны на метрической системе. В согласии с современными определениями электрических и магнитных единиц все они являются производными единицами, выводимыми по определенным физическим формулам из метрических единиц длины, массы и времени. Поскольку же большинство электрических и магнитных величин не так-то просто измерять, пользуясь упомянутыми эталонами, было сочтено, что удобнее установить путем соответствующих экспериментов производные эталоны для некоторых из указанных величин, а другие измерять, пользуясь такими эталонами.
Единицы системы СИ. Ниже дается перечень электрических и магнитных единиц системы СИ.
Ампер, единица силы электрического тока, — одна из шести основных единиц системы СИ. Ампер — сила неизменяющегося тока, который при прохождении по двум параллельным прямолинейным проводникам бесконечной длины с ничтожно малой площадью кругового поперечного сечения, расположенным в вакууме на расстоянии 1 м один от другого, вызывал бы на каждом участке проводника длиной 1 м силу взаимодействия, равную 2 10—7 Н.
Вольт, единица разности потенциалов и электродвижущей силы. Вольт — электрическое напряжение на участке электрической цепи с постоянным током силой 1 А при затрачиваемой мощности 1 Вт.
Кулон, единица количества электричества (электрического заряда). Кулон — количество электричества, проходящее через поперечное сечение проводника при постоянном токе силой 1 А за время 1 с.
Фарада, единица электрической емкости. Фарада — емкость конденсатора, на обкладках которого при заряде 1 Кл возникает электрическое напряжение 1 В.
Генри, единица индуктивности. Генри равен индуктивности контура, в котором возникает ЭДС самоиндукции в 1 В при равномерном изменении силы тока в этом контуре на 1 А за 1 с.
Вебер, единица магнитного потока. Вебер — магнитный поток, при убывании которого до нуля в сцепленном с ним контуре, имеющем сопротивление 1 Ом, протекает электрический заряд, равный 1 Кл.
Тесла, единица магнитной индукции. Тесла — магнитная индукция однородного магнитного поля, в котором магнитный поток через плоскую площадку площадью 1 м2, перпендикулярную линиям индукции, равен 1 Вб.
Практические эталоны. На практике величина ампера воспроизводится путем фактического измерения силы взаимодействия витков провода, несущих ток. Поскольку электрический ток есть процесс, протекающий во времени, эталон тока невозможно сохранять. Точно так же величину вольта невозможно фиксировать в прямом соответствии с его определением, так как трудно воспроизвести с необходимой точностью механическими средствами ватт (единицу мощности). Поэтому вольт на практике воспроизводится с помощью группы нормальных элементов. В США с 1 июля 1972 законодательством принято определение вольта, основанное на эффекте Джозефсона на переменном токе (частота переменного тока между двумя сверхпроводящими пластинами пропорциональна внешнему напряжению).
Свет и освещенность. Единицы силы света и освещенности нельзя определить на основе только механических единиц. Можно выразить поток энергии в световой волне в Вт/м2, а интенсивность световой волны — в В/м, как в случае радиоволн. Но восприятие освещенности есть психофизическое явление, в котором существенна не только интенсивность источника света, но и чувствительность человеческого глаза к спектральному распределению этой интенсивности.
Международным соглашением за единицу силы света принята кандела (ранее называвшаяся свечой), равная силе света в данном направлении источника, испускающего монохроматическое излучение частоты 540 1012 Гц (l = 555 нм), энергетическая сила светового излучения которого в этом направлении составляет 1/683 Вт/ср. Это примерно соответствует силе света спермацетовой свечи, которая когда-то служила эталоном.
Если сила света источника равна одной канделе во всех направлениях, то полный световой поток равен 4p люменов. Таким образом, если этот источник находится в центре сферы радиусом 1 м, то освещенность внутренней поверхности сферы равна одному люмену на квадратный метр, т.е. одному люксу.
Рентгеновское и гамма-излучение, радиоактивность. Рентген (Р) — это устаревшая единица экспозиционной дозы рентгеновского, гамма- и фотонного излучений, равная количеству излучения, которое с учетом вторичноэлектронного излучения образует в 0,001 293 г воздуха ионы, несущие заряд, равный одной единице заряда СГС каждого знака. В системе СИ единицей поглощенной дозы излучения является грэй, равный 1 Дж/кг. Эталоном поглощенной дозы излучения служит установка с ионизационными камерами, которые измеряют ионизацию, производимую излучением.
Кюри (Ки) — устаревшая единица активности нуклида в радиоактивном источнике. Кюри равен активности радиоактивного вещества (препарата), в котором за 1 с происходит 3,700 1010 актов распада. В системе СИ единицей активности изотопа является беккерель, равный активности нуклида в радиоактивном источнике, в котором за время 1 с происходит один акт распада. Эталоны радиоактивности получают, измеряя периоды полураспада малых количеств радиоактивных материалов. Затем по таким эталонам градуируют и поверяют ионизационные камеры, счетчики Гейгера, сцинтилляционные счетчики и другие приборы для регистрации проникающих излучений.
Факты об абсолютной температуре для детей
Абсолютная температура , также называемая термодинамической температурой , представляет собой температуру объекта по шкале, где 0 принимается за абсолютный ноль. Абсолютные температурные шкалы: Кельвин, (градусы Цельсия) и Ренкина, (градусы Фаренгейта).
Абсолютный ноль — это температура, при которой система находится в состоянии минимально возможной (минимальной) энергии. Когда молекулы приближаются к этой температуре, их движение падает до нуля.Это самая низкая температура, которую может измерить газовый термометр. Никакие электронные устройства не работают при такой температуре. Кинетическая энергия молекул становится незначительной или нулевой.
Примеры
Обычные температуры в абсолютной шкале:
- 0 ° C (точка замерзания воды) = 273,15 K
- 25 ° C (комнатная температура) = 298,15 K
- 100 ° C (температура кипения воды) = 373,15 K
- 0K (абсолютный ноль) = — 273,15 Цельсия
- 233,15 К (равные меры по Цельсию и Фаренгейту) = — 40 Цельсия
- Тройная точка воды = 273.16K (равная мера в градусах Цельсия) 0,01 ° c.
Преобразование
Чтобы преобразовать шкалу Цельсия в абсолютную температуру, вы прибавляете 273,15 и меняете ° C на K. Чтобы получить температуру по абсолютной шкале на шкале Цельсия, вычтите 273,15 и измените K на ° C. Обычно это используется в научном мире. Кельвин используется во всем мире как часть Международной системы единиц. Это одна из 7 базовых единиц системы. Значение абсолютной температуры 0К.
- Цельсия в Кельвина: K = C + 273.15
- Кельвина в Цельсия: C = K-273,15
- по Фаренгейту в Ренкин: R = F + 459.67
- по шкале Ренкина по Фаренгейту: F = R-459,67
Детские картинки
Рис. 1 Поступательное движение элементарных частиц природы, таких как атомы и молекулы, напрямую связано с температурой. Здесь размер атомов гелия относительно их расстояния показан в масштабе при давлении 1950 атмосфер. Эти атомы при комнатной температуре имеют определенную среднюю скорость (здесь они замедлены в два триллиона раз).Однако в любой данный момент конкретный атом гелия может двигаться намного быстрее, чем в среднем, в то время как другой может быть почти неподвижным. Пять атомов окрашены в красный цвет, чтобы облегчить отслеживание их движения.
Рис. 2 Поступательные движения атомов гелия происходят в широком диапазоне скоростей. Сравните форму этой кривой с кривой Планка на рис. 5 , приведенном ниже.
Рис. 4 Поступательное движение частиц в твердых телах, вызванное температурой, принимает форму фононов .Здесь показаны фононы с одинаковыми амплитудами, но с длинами волн от 2 до 12 средних межмолекулярных разделений ( a ).
Рис. 6 Лед и вода: две фазы одного и того же вещества
Рис. 8 Когда многие химические элементы, такие как благородные газы и металлы платиновой группы, замерзают до твердого состояния — наиболее упорядоченное состояние вещества — их кристаллические структуры имеют плотноупакованное расположение .Это дает максимально возможную плотность упаковки и самое низкое энергетическое состояние.
Температура
Температура это мера горячего или холодного объекта. Температура может быть измерена в метрических единицах или в единицах, принятых в США. Мы можем использовать термометр, у которого есть градусы Цельсия ( ° C ) и по Фаренгейту ( ° F ) шкала для измерения температуры.
В следующей таблице показаны различные температуры по Цельсию ( ° C ) и по Фаренгейту ( ° F ).
Температура | Фаренгейт ( ° F ) | Цельсия ( ° C ) |
| Нормальная температура человеческого тела | 98 ° F | 37 ° C |
| Комнатная температура | 68 ° F | 20 ° C |
| Вода кипит | 212 ° F | 100 ° C |
| Вода замерзает | 32 ° F | 0 ° C |
Метрические единицы
В метрических единицах температура измеряется в градусах Цельсия ( ° C ).Шкалу Цельсия также называют шкала Цельсия так как он разделен на 100 градусов. Шведский астроном Андерс Цельсий, разработавший температурную шкалу Цельсия.
Обычные единицы США
В обычных единицах измерения температура измеряется в градусах Фаренгейта ( ° F ). В физик Габриэль Даниэль Фаренгейт, который назвал Фаренгейта ( ° F ) в 1724 .
Термометры на рисунке выше показывают, что вода замерзает при 0 ° C или 32 ° F и кипит на 100 ° C или 212 ° F .
Для преобразования температура от Фаренгейта до Цельсия, используйте формулу C знак равно 5 9 ( F — 32 ) а для Цельсия по Фаренгейту F знак равно 9 5 C + 32 .
Например, самая низкая зарегистрированная температура в Оклахоме составляет — 31 год ° F на февраль 9 , 2011 г. . Найдите температуру в градусах Цельсия.
Выражение для преобразования температуры из Фаренгейта в градусы Цельсия: C знак равно 5 9 ( F — 32 ) .
Для преобразования — 31 год ° F на градус Цельсия, сначала замените F с участием — 31 год .
5 9 ( F — 32 ) знак равно 5 9 ( — 31 год — 32 ) знак равно 5 9 ( — 63 )
Далее умножаем.
5 ( — 63 ) 9 знак равно — 315 9
Теперь разделите.
знак равно — 35 год
Следовательно, температура в градусах Цельсия равна — 35 год ° C .
Примечание : Кельвин ( K ), единица термодинамической температуры, является 1 273,16 абсолютной температуры тройной точки воды.
Вода и шкала температуры
Как свойства воды связаны с температурной шкалой и к другим фундаментальным (СИ) единицам?
Поскольку вода обычно доступна в довольно чистой форме, исторически он использовался в качестве воспроизводимого стандарта для определение физических величин.Большинство тех старых стандарты, использующие воду, были заменены более точными стандарты. Однако все равно интересно и поучительно. проследить способы использования воды в качестве эталон.
Наверное, самое знакомое такое использование воды связан с температурной шкалой. Цельсия (иногда называемого Цельсием, хотя использование этого термин больше не считается правильным) шкала температуры была изначально определены таким образом, что точки замерзания и кипения чистой воды, оба при давлении в одну атмосферу, были 0 и 100 градусов соответственно.Это определение перестало действовать с принятие новой Международной температурной шкалы в 1990 году.
Термодинамическое определение температуры основано исключительно на о поведении идеального газа; также нужна одна фиксированная точка чтобы установить размер градуса. Используемая фиксированная точка — это «тройная точка» воды, то есть давление / температура состояние, при котором твердое тело, жидкость и пар сосуществуют. Этот используется потому, что тройная точка — это уникальное условие, при котором можно точно воспроизвести; тройная точка воды выбран потому, что его относительно удобно реализовать в лаборатории.Температура тройной точки воды равной 273,16 кельвина (где 0 K — абсолютная ноль температуры). Хотя это полностью определяет термодинамическая шкала температуры, требуется измерение температуры аппроксимация термодинамической температуры по «практической» шкале который содержит другие фиксированные точки, в которых можно калибровать инструменты. Температуры назначаются этим точкам на основе наилучшего научная оценка их истинных термодинамических температур, определены процедуры интерполяции между фиксированными точками.В то время как в предыдущих температурных шкалах использовалось атмосферное кипение. точка воды в качестве фиксированной точки (присвоив ей 373,15 K, что составляет 100 градусов Цельсия), воспроизводимость этой точки не такая хорош, как и другие варианты. Новая международная температурная шкала принятый в 1990 г. (известный как ITS-90) охватывает этот регион точки равновесия твердое / жидкое (плавление / замерзание) галлия (302,9146 К) и индия (429,7485 К). На ИТС-90, температура кипения воды при атмосферном давлении превращается около 373.124 К (99,974 градуса Цельсия).
Итак, изменились ли свойства воды? Конечно, нет. Что изменилось, так это наша способность точно определять температуру. в более близком приближении к истинной термодинамической температуре. Оказывается, истинная температура точки кипения воды не совсем то, что люди думали, когда шкала Цельсия была впервые определился давно.
Иногда спрашивают, почему нельзя переопределите шкалу температур так, чтобы знакомые 0 и 100 градусов Цельсия все еще держится для замораживания и кипения точки воды.Это можно сделать, но для этого потребуется изменить размер степень; это исказит другие знакомые отношения потому что разница между абсолютной температурой в кельвинах и шкала Цельсия должен был стать примерно 273,22, а не знакомый 273.15. Кроме того, такое определение потребует изменения всей шкалы, если когда-либо были сделаны более точные измерения для точка кипения воды. Лучше основывать температуру на фундаментальная физика (в данном случае законы термодинамики применяется к идеальному газу) и используйте одну точно воспроизводимую точку (например, тройная точка воды) для определения шкалы.В этом случае, вода по-прежнему является важной частью определения температуры шкала, но это тройная точка, а не замораживание и точки кипения, которые используются. Конечно, для большинства практических целей, это адекватное приближение думать о воде как о кипящей при 100 ° C. градусов Цельсия, а не 99,974.
Другое важное историческое использование воды в качестве меры стандарт был в определении массы. Грамм был первоначально определялась как масса одного кубического сантиметра воды в некоторых стандартных условиях.Однако сейчас масса относится к стандартному килограмму, который представляет собой платину / иридий цилиндр хранится в Париже. Это выгодно, потому что независимо от стандарта длины и потому, что твердое тело легче точно взвесить, чем жидкость. Тщательные измерения показали, что жидкая вода на ее максимальная плотность имеет плотность чуть менее 1 г / см3; в настоящее время принятое число 0,999975 г / см3.
Подробнее об основных определениях единиц СИ см. Ссылка NIST на Международную систему единиц (СИ).
Обновлено 15 июня 2000 г.
Шкала Ренкина — wikidoc
Шаблон: Температура Ренкин — термодинамическая (абсолютная) шкала температуры, названная в честь шотландского инженера и физика Уильяма Джона Маккорна Ренкина, который предложил ее в 1859 году.
Обозначение — R (или Ra , если необходимо отличить его от шкал Ремера и Реомюра). Как и в случае шкалы Кельвина (символ: K), ноль на шкале Ренкина является абсолютным нулем, но градус Ренкина определяется как равный одному градусу Фаренгейта, а не одному градусу Цельсия, используемому шкалой Кельвина.Температура -459,67 ° F в точности равна 0 Р.
Несколько инженерных специальностей в США измеряют термодинамическую температуру с использованием шкалы Ренкина. Однако во всем научном мире, где измерения производятся в единицах СИ, термодинамическая температура измеряется в кельвинах.
Некоторые ключевые температуры, связывающие шкалу Ренкина с другими шкалами температур, показаны в таблице ниже.
| Кельвин | по Цельсию | по Фаренгейту | Ранкина | |
|---|---|---|---|---|
| Абсолютный ноль (по определению) | 0 К | −273.15 ° С | −459,67 ° F | 0 р |
| Температура замерзания воды [1] | 273,15 К | 0 ° С | 32 ° F | 491,67 руб. |
| Тройная точка воды (по определению) | 273,16 К | 0,01 ° С | 32,018 ° F | 491,688 руб. |
| Температура кипения воды [2] | 373,1339 К | 99,9839 ° С | 211.9710 ° F | 671.641 руб. |
Шаблон: измерительная заглушка
Список литературы
- ↑ Температура замерзания очищенной воды составила 0,000089 (10) градуса Цельсия — см. Magnum, B.W. (1995). «Воспроизводимость температуры точки льда при текущих измерениях» (PDF). Техническая записка Nist . 1411 . Проверено 11 февраля 2007. Неизвестный параметр
| месяц = игнорируется (справка) - ↑ Для Венской стандартной средней океанской воды при одной стандартной атмосфере (101.325 кПа) при калибровке исключительно по двухточечному определению термодинамической температуры. Старые определения шкалы Цельсия когда-то определяли точку кипения воды при одной стандартной атмосфере как равную 100 ° C. Однако текущее определение приводит к температуре кипения, которая на самом деле на 16,1 мК меньше. Для получения дополнительной информации о фактической температуре кипения воды см. VSMOW при измерении температуры.
См. Также
Шаблон: Wiktionarypar
Шаблон: TemperatureScales
ca: Grau Rankine cs: Stupeň Rankina da: Рэнкин de: Ранкин-Скала et: Rankine’i skaala ЕС: Рэнкин fa: رانکین ко: 란 씨 он: מעלות רנקין id: Скала Рэнкин это: Рэнкин нл: Рэнкин нет: Рэнкин просто: шкала Ренкина sk: Stupeň Rankina sv: Рэнкин
Единицы преобразования температуры
Преобразование температуры
Температура — это мера средней кинетической энергии совокупности частиц или объектов.Молекулы газа, жидкости или твердого тела находятся в постоянном движении. Движение увеличивается с повышением температуры. При возможно самой низкой температуре (абсолютный ноль) это движение останавливается.
Температура измеряется в соответствии с Международной системой SI в градусах Цельсия (° C) или Кельвина (K).
Единица измерения температуры по Фаренгейту была определена в 1714 году ученым Габриэлем Даниэлем Фаренгейтом.
Он определил самую низкую температуру, которую он мог достичь для нулевой точки.С замораживающей смесью льда, воды и аммиака он достиг -17,78 ° C (= 0 ° по Фаренгейту).
Наконец, точка замерзания и точка кипения воды были определены как фиксированные точки и разделены на 180 делений шкалы.
Нормальная температура тела 37,7 ° Цельсия, таким образом, составляет прибл. 100 ° по Фаренгейту (99,86 ° F).
Чтобы преобразовать температуру TF (° F) в TC (° C):
TC = 5/9 (TF / ° F — 32) * ° C
Шведский ученый Андерс Цельсий определил в 1742 году точку замерзания температура воды равна 100 ° C, а точка пара — 0 ° C.Только позже оба значения были обменяны, что привело к появлению общепринятой шкалы температур в градусах Цельсия.
Шкала Кельвина восходит к английскому физику Уильяму Томсону, удостоенному титула лорда Кельвина. В отличие от шкалы Кельвина или Фаренгейта, нулевая точка определяется не характеристикой воды или солевой смесью, а выше абсолютной нулевой точки. Движение частиц там не происходит. Разница температур в 1K соответствует разнице температур в 1 ° C.
TC = (TK / K — 273,15) * ° C
Измерение температуры в градусах Фаренгейта (F) в основном распространено в США, но также и в Англии. Измерение температуры в Кельвинах используется в науке.
Шкала Ренкина имеет нулевую точку в точке абсолютного нуля и интервалы шкалы Фаренгейта. Абсолютная температура в основании Фаренгейта обозначается градусами Ренкина (° Rank).
Устаревшая шкала температур — шкала Реомюра (° R).
Соответствует следующим фиксированным точкам:
0 ° C <=> 0 ° R
100 ° C <=> 80 ° R
термометр | Национальное географическое общество
Шкала Цельсия является частью метрической системы.Метрическая система измерения также включает единицы массы, например килограммы, и единицы длины, например километры. Метрическая система, включая градусы Цельсия, является официальной системой измерения почти для всех стран мира. В большинстве научных областей температура измеряется по шкале Цельсия. Ноль градусов Цельсия — это точка замерзания воды, а 100 градусов Цельсия — это точка кипения воды. Три страны не используют шкалу Цельсия. В США, Бирме и Либерии для измерения температуры используется шкала Фаренгейта.Однако даже в этих странах ученые используют шкалу Цельсия или Кельвина для измерения температуры. Вода замерзает при 32 градусах по Фаренгейту и закипает при 212 градусах по Фаренгейту. Шкала Кельвина используется физиками и другими учеными, которым необходимо регистрировать очень точные температуры. Шкала Кельвина — единственная единица измерения, которая включает температуру «абсолютного нуля», полного отсутствия какой-либо тепловой энергии. Это делает шкалу Кельвина незаменимой для ученых, которые рассчитывают температуру объектов в холодных районах космического пространства.Вода замерзает при 273 кельвинах и закипает при 373 кельвинах. Мы не считываем температуру наружного воздуха по шкале Кельвина, потому что в ней используются такие большие числа — день с температурой 75 градусов по Фаренгейту будет читаться как 297 кельвинов!Типы термометров
Жидкостные термометры
Жидкость расширяется с регулярной измеримой скоростью при нагревании. По этой причине обычный термометр содержит жидкость в узкой стеклянной трубке.Ртуть — один из наиболее известных материалов, используемых в жидкостных термометрах. Другие жидкости, такие как керосин или этанол, также могут использоваться в термометрах этих типов. При повышении температуры жидкость расширяется из чаши или груши в пустое пространство, поднимаясь по трубке. Когда температура падает, жидкость сжимается и снова опускается. Жидкостные термометры часто включают температурные шкалы Цельсия и Фаренгейта, которые отображаются с обеих сторон трубки. Максимальный термометр — это знакомый тип жидкостного термометра.В максимальном термометре жидкость выталкивается вверх по стеклянной трубке, но не может легко упасть при понижении температуры. Максимальную температуру в течение установленного периода времени можно наблюдать после удаления термометра из окружающей среды. Максимальные термометры обычно используются для измерения температуры тела человека.Жидкостные термометры могут быть ограничены типом используемой жидкости. Например, Меркурий становится твердым при температуре -38,83 градуса по Цельсию (-37,89 градуса по Фаренгейту).Ртутные термометры не могут измерять температуру ниже этой точки. Спирты, такие как этанол, кипят при температуре около 78 градусов по Цельсию (172 градуса по Фаренгейту). Их нельзя использовать для измерения температуры выше этой точки.
Термометры электронные
Ртутные и другие жидкостные термометры нельзя использовать для измерения температуры в градусах Кельвина. Термометры Кельвина обычно представляют собой электрические устройства, которые могут регистрировать крошечные изменения излучения. Эти изменения не будут видны и могут не изменить давление воздуха настолько, чтобы повысить уровень ртути в жидкостном термометре.Термометры прочие
Сегодня специализированные термометры используются для самых разных целей. Например, криометр измеряет очень низкие температуры. Криометры используются для измерения температуры в космосе. Пирометры используются для измерения очень высоких температур. В сталелитейной промышленности пирометры используются для измерения температуры железа и других металлов. Например, астрономы используют инфракрасные термометры для измерения температуры в космосе.Инфракрасные термометры обнаруживают инфракрасное излучение на больших расстояниях и соотносят его с определенной температурой поверхности. В 1965 году инфракрасный термометр обнаружил излучение с температурой 3 кельвина (-270 градусов по Цельсию / -454 градусов по Фаренгейту) во всех направлениях в космосе. Астрономы пришли к выводу, что это очень холодное излучение, вероятно, было слабым остатком Большого взрыва — расширения Вселенной из одной точки, которое началось примерно 13,82 миллиарда лет назад. Спортивные тренеры используют термометры в виде таблеток для предотвращения и лечения тепловых заболеваний, таких как тепловой удар.После проглатывания таблеточный термометр передает информацию о внутренней температуре тела в течение 18–30 часов. В таблеточных термометрах используются жидкие кристаллы для отслеживания изменений температуры тела и передачи радиоволн к источнику за пределами тела, который записывает и отображает эти данные. Исследователи из Гарвардского университета разработали нанотермометр, который может измерять колебания температуры внутри одной живой клетки. Используя нанопроволочную «иглу», исследователи вводят углеродные нанокристаллы внутрь клетки.Эти кристаллы имеют длину менее 5 нанометров (лист бумаги имеет толщину 100 000 нанометров) и обнаруживают невероятно малые колебания температуры. Ученые сейчас разрабатывают нанокристаллические технологии, которые могут изменять температуру клеток. Эти технологии в конечном итоге могут быть использованы в лечебных целях, которые приводят к перегреву и уничтожению рака на клеточном уровне.1.2 Термометры и температурные весы — University Physics Volume 2
Учебные цели
К концу этого раздела вы сможете:
- Опишите несколько различных типов термометров
- Преобразование температур между шкалами Цельсия, Фаренгейта и Кельвина
Любое физическое свойство, которое постоянно и воспроизводимо зависит от температуры, может быть использовано в качестве основы для термометра.Например, для большинства веществ объем увеличивается с повышением температуры. Это свойство лежит в основе обычных спиртовых термометров и оригинальных ртутных термометров. Другие свойства, используемые для измерения температуры, включают электрическое сопротивление, цвет и излучение инфракрасного излучения (рис. 1.3).
Фигура 1.3 Поскольку многие физические свойства зависят от температуры, разнообразие термометров примечательно. (а) В термометрах этого распространенного типа спирт, содержащий красный краситель, расширяется быстрее, чем окружающее его стекло.Когда температура термометра увеличивается, жидкость из груши выталкивается в узкую трубку, вызывая большое изменение длины столбика при небольшом изменении температуры. (b) Каждый из шести квадратов на этом пластиковом (жидкокристаллическом) термометре содержит пленку из различного термочувствительного жидкокристаллического материала. Ниже 95 ° F95 ° F все шесть квадратов черные. Когда пластиковый термометр подвергается воздействию температуры 95 ° F95 ° F, первый квадрат жидкого кристалла меняет цвет. Когда температура поднимется выше 96.8 ° F, 96,8 ° F, второй жидкокристаллический квадрат также меняет цвет и так далее. (c) Пожарный использует пирометр для проверки температуры системы вентиляции авианосца. Пирометр измеряет инфракрасное излучение (излучение которого зависит от температуры) от вентиляционного отверстия и быстро считывает температуру. Инфракрасные термометры также часто используются для измерения температуры тела, осторожно помещая их в слуховой проход. Такие термометры более точны, чем спиртовые термометры, помещенные под язык или в подмышку.(Фото b: модификация работы Тесс Уотсон; кредит c: модификация работы Ламеля Дж. Хинтона, ВМС США)Термометры измеряют температуру в соответствии с четко определенными шкалами измерения. Три наиболее распространенных температурных шкалы — это шкала Фаренгейта, Цельсия и Кельвина. Температурные шкалы создаются путем определения двух воспроизводимых температур. Обычно используются температуры замерзания и кипения воды при стандартном атмосферном давлении.
По шкале Цельсия точка замерзания воды составляет 0 ° C0 ° C, а точка кипения составляет 100 ° C.100 ° С. Единицей измерения температуры на этой шкале является градус Цельсия (° C) (° C). Шкала Фаренгейта (по-прежнему наиболее часто используемая для обычных целей в Соединенных Штатах) имеет точку замерзания воды 32 ° F32 ° F и точку кипения 212 ° F, 212 ° F. Единица измерения — градус Фаренгейта (° F ° F). Вы можете видеть, что 100 градусов по Цельсию охватывают тот же диапазон, что и 180 градусов по Фаренгейту. Таким образом, разница температур в один градус по шкале Цельсия в 1,8 раза больше разницы в один градус по шкале Фаренгейта, или ΔTF = 95ΔTC.ΔTF = 95ΔTC.
Определение температуры в терминах движения молекул предполагает, что должна быть минимально возможная температура, при которой средняя кинетическая энергия молекул равна нулю (или минимуму, разрешенному квантовой механикой). Эксперименты подтверждают существование такой температуры, называемой абсолютным нулем. Абсолютная шкала температуры — это шкала, нулевая точка которой равна абсолютному нулю. Такие шкалы удобны в науке, потому что несколько физических величин, например объем идеального газа, напрямую связаны с абсолютной температурой.
Шкала Кельвина — это шкала абсолютных температур, обычно используемая в науке. Единица измерения температуры в системе СИ — кельвин , которая обозначается аббревиатурой K (без знака градуса). Таким образом, 0 K является абсолютным нулем. Температура замерзания и кипения воды составляет 273,15 К и 373,15 К соответственно. Следовательно, разница температур одинакова в кельвинах и градусах Цельсия, или ΔTC = ΔTK.ΔTC = ΔTK.
Отношения между тремя общими температурными шкалами показаны на рисунке 1.4. Температуры на этих шкалах можно преобразовать с помощью уравнений в таблице 1.1.
Фигура 1.4 Показаны взаимосвязи между температурными шкалами Фаренгейта, Цельсия и Кельвина. Также показаны относительные размеры чешуек.
| Преобразовать из… | Используйте это уравнение… |
|---|---|
| Цельсия к Фаренгейту | TF = 95TC + 32TF = 95TC + 32 |
| Фаренгейта к Цельсию | TC = 59 (TF − 32) TC = 59 (TF − 32) |
| Цельсия к Кельвину | ТК = ТК + 273.15ТК = ТК + 273,15 |
| От Кельвина до Цельсия | TC = TK − 273.15TC = TK − 273.15 |
| Фаренгейта до Кельвина | TK = 59 (TF − 32) + 273,15TK = 59 (TF − 32) +273,15 |
| Кельвин в градусах Фаренгейта | TF = 95 (TK − 273,15) + 32TF = 95 (TK − 273,15) +32 |
Стол 1.1 Преобразования температуры
Чтобы преобразовать градусы Фаренгейта в градусы Кельвина, на промежуточном этапе преобразуйте в градусы Цельсия.
Пример 1.1
Преобразование шкалы температур: комнатная температура
«Комнатная температура» обычно определяется в физике как 25 ° C25 ° C. (а) Что такое комнатная температура в ° F ° F? (б) Что это в К?Стратегия
Чтобы ответить на эти вопросы, все, что нам нужно сделать, это выбрать правильные уравнения преобразования и подставить известные значения.Решение
Чтобы преобразовать из ° C ° C в ° F ° F, используйте уравнениеПодставьте известное значение в уравнение и решите:
TF = 95 (25 ° C) + 32 = 77 ° F.TF = 95 (25 ° C) + 32 = 77 ° F.Аналогичным образом находим, что TK = TC + 273,15 = 298KTK = TC + 273,15 = 298K.
Шкала Кельвина является частью системы единиц СИ, поэтому ее фактическое определение более сложное, чем приведенное выше. Во-первых, он определяется не в терминах точек замерзания и кипения воды, а в терминах тройной точки. Тройная точка — это уникальное сочетание температуры и давления, при котором лед, жидкая вода и водяной пар могут стабильно сосуществовать. Как будет обсуждаться в разделе о фазовых превращениях, сосуществование достигается за счет снижения давления и, следовательно, точки кипения для достижения точки замерзания.Температура тройной точки определяется как 273,16 К. Это определение имеет то преимущество, что, хотя температура замерзания и температура кипения воды зависят от давления, существует только одна температура тройной точки.
Во-вторых, даже при наличии двух точек на шкале разные термометры дают несколько разные результаты для других температур. Поэтому требуется стандартный градусник. Метрологи (специалисты в области измерений) выбрали для этой цели газовый термометр постоянного объема .Сосуд постоянного объема, заполненный газом, подвергается изменениям температуры, и измеренная температура пропорциональна изменению давления. Использование «TP» для представления тройной точки,
Результаты в некоторой степени зависят от выбора газа, но чем менее плотен газ в баллоне, тем лучше совпадают результаты для разных газов. Если результаты экстраполировать на нулевую плотность, результаты будут достаточно хорошо согласуются с нулевым давлением, соответствующим температуре абсолютного нуля.
Газовые термометры постоянного объема большие и медленно приходят в состояние равновесия, поэтому их в основном используют в качестве эталонов для калибровки других термометров.

