Бензол, C6H6, химические свойства, производство, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Бензол и его гомологи, подготовка к ЕГЭ по химии
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям
двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2 гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Бензол | Определение, открытие, структура, свойства и использование
химическая связь в бензоле
Посмотреть все СМИ
- Ключевые люди:
- Майкл Фарадей Август Вильгельм фон Хофманн
- Похожие темы:
- углеводород бензоидное ароматическое соединение Структура Кекуле бензольное кольцо Бензол Дьюара
Просмотреть весь связанный контент →
Последние новости
6 февраля 2023 г. , 20:50 по восточноевропейскому времени (AP)
, 20:50 по восточноевропейскому времени (AP)
Бригады выпускают токсичные химические вещества из сошедших с рельсов танкеров в Огайо
Бригады в Огайо выпустили токсичные химические вещества из пяти автомобилей поезд сошел с рельсов возле границы штата Пенсильвания, чтобы уменьшить угрозу взрыва
5 февраля 2023 г., 22:19 по восточноевропейскому времени (AP)
Должностные лица призывают к эвакуации в случае схода с рельсов, опасаясь взрыва Крушение поезда в Огайо предупредило сотни близлежащих жителей, которые отказались эвакуироваться, сделать это немедленно, сославшись на опасения по поводу возможного взрыва
бензол (C 6 H 6 ) , простейший органический ароматический углеводород и исходное соединение многочисленных важных ароматических соединений. Бензол представляет собой бесцветную жидкость с характерным запахом и в основном используется в производстве полистирола. Он очень токсичен и является известным канцерогеном; воздействие его может вызвать лейкемию. В результате существует строгий контроль за выбросами бензола.
Он очень токсичен и является известным канцерогеном; воздействие его может вызвать лейкемию. В результате существует строгий контроль за выбросами бензола.
Открытие бензола
Бензол был впервые обнаружен английским ученым Майклом Фарадеем в 1825 году в составе светящегося газа. В 1834 году немецкий химик Эйльхардт Мичерлих нагрел бензойную кислоту с известью и получил бензол. В 1845 году немецкий химик А.В. фон Хофманн выделил бензол из каменноугольной смолы.
Викторина «Британника»
Так много химии, так мало времени Викторина
Структура бензола вызывает интерес с момента его открытия. Немецкие химики Йозеф Лошмидт (в 1861 г.) и Август Кекуле фон Страдониц (в 1866 г.) независимо друг от друга предложили циклическое расположение шести атомов углерода с чередующимися одинарными и двойными связями. Кекуле впоследствии изменил свою структурную формулу на формулу, в которой колебание двойных связей дает две эквивалентные структуры в быстром равновесии. В 1931 Американский химик Лайнус Полинг предположил, что бензол имеет единую структуру, которая представляет собой резонансный гибрид двух структур Кекуле.
В 1931 Американский химик Лайнус Полинг предположил, что бензол имеет единую структуру, которая представляет собой резонансный гибрид двух структур Кекуле.
Характеристики бензола
Современные модели связи (теории валентных связей и молекулярных орбиталей) объясняют структуру и стабильность бензола с точки зрения делокализации шести его электронов, где делокализация в данном случае относится к притяжению электрона всеми шестью атомами углерода кольца. только одного или двух из них. Эта делокализация заставляет электроны удерживаться сильнее, что делает бензол более стабильным и менее реакционноспособным, чем ожидалось для ненасыщенного углеводорода. В результате гидрирование бензола происходит несколько медленнее, чем гидрирование алкенов (других органических соединений, содержащих углерод-углеродные двойные связи), и бензол окисляется гораздо труднее, чем алкены. Большинство реакций бензола относятся к классу, называемому электрофильным ароматическим замещением, при котором само кольцо остается нетронутым, но заменяется один из присоединенных атомов водорода. Эти реакции универсальны и широко используются для получения производных бензола.
Эти реакции универсальны и широко используются для получения производных бензола.
Экспериментальные исследования, особенно те, которые используют дифракцию рентгеновских лучей, показывают, что бензол имеет плоскую структуру с расстоянием каждой связи углерод-углерод, равным 1,40 ангстрема (Å). Это значение находится ровно посередине между расстоянием C=C (1,34 Å) и расстоянием C—C (1,46 Å) звена C=C—C=C, что предполагает тип связи посередине между двойной связью и одинарной связью (все валентный угол равен 120°). Бензол имеет температуру кипения 80,1 ° C (176,2 ° F) и точку плавления 5,5 ° C (41,9 ° F), и он легко растворим в органических растворителях, но лишь немного растворим в воде.
Использование бензола
В свое время бензол почти полностью получали из каменноугольной смолы; однако примерно с 1950 года эти методы были заменены процессами на основе нефти. Ежегодно более половины производимого бензола перерабатывается в этилбензол, затем в стирол, а затем в полистирол. Следующее по величине применение бензола — получение фенола. Другие области применения включают получение анилина (для красителей) и додецилбензола (для моющих средств).
Следующее по величине применение бензола — получение фенола. Другие области применения включают получение анилина (для красителей) и додецилбензола (для моющих средств).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Фрэнсис А. КэриБензол Структура: Объяснение, Реакционная способность, Кекуле, Формула
Бензол представляет собой углеводород необычного вида. С точки зрения его структуры, он имеет шесть атомов углерода, но только шесть атомов водорода. Тем не менее, это чрезвычайно распространено и чрезвычайно важно в нашей повседневной жизни. F
Вы найдете бензольные кольца во многих соединениях, которые придают еде такой приятный вкус, например, в ванилин, молекуле, ответственной за сладкий вкус ванили. Ибупрофен также является производным бензола. И если вы когда-нибудь красили стену, то знаете этот характерный запах мокрой краски. Это вызвано толуолом — другой молекулой с бензольным кольцом, \(C_6H_6\).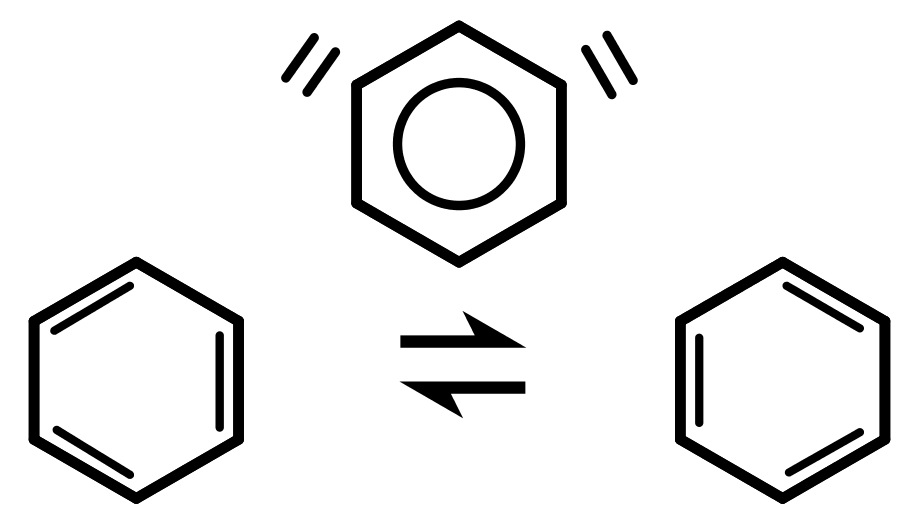
Бензол представляет собой ароматическое соединение с молекулярной формулой \(C_6H_6\) .
Как вы узнали из курса Химия ароматов , ароматических соединений содержат кольцо делокализованных пи-электронов . Не волнуйтесь — мы еще раз вернемся к этому, когда будем изучать структуру бензола.
Рис. 1 – Бензол
Как устроен бензол?
Бензол имеет уникальную структуру. Есть некоторые важные структурные аспекты, о которых вам нужно знать, такие как его формула, длина связи и расположение электронов.
Структурная и отображаемая формулы
Как мы упоминали выше, бензол имеет молекулярную формулу \(C_6H_6\) . Он образует шестиугольную молекулу, которую мы часто представляем в виде шестиугольника с кругом внутри.
Рис. 2 – Обычное представление молекулы бензола
Длина связи
Мы исследовали некоторые потенциальные структуры бензола в Химия ароматических соединений , каждая из которых содержит три двойные связи C=C. Но на самом деле мы знаем, что бензол вообще не содержит двойных связей. Вместо этого все его углерод-углеродные связи идентичны промежуточные соединения — промежуточные по длине между одинарной и двойной связью. Мы узнаем почему через секунду.
Но на самом деле мы знаем, что бензол вообще не содержит двойных связей. Вместо этого все его углерод-углеродные связи идентичны промежуточные соединения — промежуточные по длине между одинарной и двойной связью. Мы узнаем почему через секунду.
Валентный угол
Каждый атом углерода в бензоле связан с двумя другими атомами углерода и только с одним атомом водорода, а валентный угол между каждой связью составляет 120° . Это делает бензол тригональной плоской молекулой .
Рис. 3. Бензол имеет валентный угол 120°
Однако мы знаем, что углерод имеет четыре валентных электрона. Только три электрона образовали связи — что случилось с последним? Чтобы ответить на этот вопрос, давайте посмотрим на электронные орбитали и что-то под названием 9.0035 Делокализованная система Пи.
Делокализованная пи-система
Четвертый электрон внешней оболочки углерода находится на пи-орбитали , тогда как три связанных электрона находятся на сигма-орбиталях . Сигма-орбитали простираются между атомами, а пи-орбитали простираются выше и ниже атома. В бензоле все пи-орбитали атомов углерода перекрываются, образуя связанную область, которая простирается выше и ниже молекулы.
Сигма-орбитали простираются между атомами, а пи-орбитали простираются выше и ниже атома. В бензоле все пи-орбитали атомов углерода перекрываются, образуя связанную область, которая простирается выше и ниже молекулы.
Рис. 4. Шесть пи-орбиталей бензола перекрываются и делокализуются
Электроны могут двигаться куда угодно в пределах этой перекрывающейся области. Мы говорим, что они делокализованы . Общая структура называется делокализованной системой пи.
Из-за этих делокализованных электронов бензолу не нужно образовывать двойные связи. Как мы упоминали выше, все его связи С-С представляют собой идентичных промежуточных соединений.
Подводя итог, бензол имеет следующую структуру:
- Он имеет плоскую шестиугольную форму.
- Каждый атом углерода связан с двумя другими атомами углерода и одним атомом водорода с помощью трех своих валентных электронов.
- Каждая из его связей С-С представляет собой промежуточное звено , занимающее промежуточное положение между одинарной и двойной связью по длине.

- Угол между связями 120° .
- Четвертый валентный электрон каждого атома углерода делокализован в области выше и ниже молекулы.
Структура бензола Кекуле и другие теории
В 1865 году немецкий химик-органик Фридрих Август Кекуле опубликовал статью о структуре бензола. Это была загадка, которая долгие годы озадачивала ученых. Он утверждал, что ему приснилась змея, кусающая себя за хвост, что привело его к выводу о циклической природе бензола. Кекуле предположил, что бензол содержит чередующиеся одинарные связи C-C и двойные связи C=C, как показано ниже. Эта молекула систематически известна как циклогекса-1,3,5-триен.
Рис. 5 – Структура, предложенная Кекуле для бензола: циклогекса-1,3,5-триен
Однако было несколько доказательств, которые не совсем подтверждали эту структуру.
Реакции электрофильного присоединения
Обычный тест на алкены заключается в смешивании их с бромной водой. Если присутствует двойная связь C=C, вода обесцвечивается, поскольку атомы брома присоединяются к углеводороду в реакции электрофильного присоединения . Структура Кекуле для бензола содержит три двойные связи C=C, поэтому мы ожидаем, что он будет реагировать таким образом. Однако это не так — при смешивании с бромной водой раствор остается красно-коричневым. Это говорит о том, что бензол не имеет двойных связей.
Если присутствует двойная связь C=C, вода обесцвечивается, поскольку атомы брома присоединяются к углеводороду в реакции электрофильного присоединения . Структура Кекуле для бензола содержит три двойные связи C=C, поэтому мы ожидаем, что он будет реагировать таким образом. Однако это не так — при смешивании с бромной водой раствор остается красно-коричневым. Это говорит о том, что бензол не имеет двойных связей.
Энтальпия гидрирования
Реакции, в которых водород добавляется к молекуле, известны как реакции гидрирования . Давайте посмотрим на циклогексен, показанный ниже. Он имеет энтальпию гидрирования -120 кДжмоль-1, что означает, что 120 кДж энергии высвобождается, когда два атома водорода присоединяются к его одинарной двойной связи. Получается циклогексан.
Рис. 6 – Энтальпия гидрирования циклогексена
Если мы теперь посмотрим на структуру Кекуле, мы увидим, что она имеет три двойные связи C=C. Поэтому мы ожидаем, что энтальпия гидрирования у него в три раза больше, чем у циклогексена, имеющего только одну двойную связь:
3x-120=-360кДжмоль-1
Однако эксперименты показывают, что энтальпия гидрирования бензола составляет всего -208кДжмоль-1. Он на 152 кДжмоль-1 более стабилен, чем ожидалось. Это известно как резонансная энергия бензола . Теперь мы знаем, что эта стабильность обусловлена бензольным кольцом делокализованных электронов, которое стабилизирует молекулу, распределяя отрицательные заряды электронов по большей площади.
Он на 152 кДжмоль-1 более стабилен, чем ожидалось. Это известно как резонансная энергия бензола . Теперь мы знаем, что эта стабильность обусловлена бензольным кольцом делокализованных электронов, которое стабилизирует молекулу, распределяя отрицательные заряды электронов по большей площади.
Длины связей
Рентгеновская дифракция — метод, использующий рентгеновские лучи для исследования структуры молекул. Ученые использовали его в 1981, чтобы получить изображение бензола. В Ароматическая химия мы узнали, что одинарные связи С-С длиннее, чем двойные связи С=С. Это придало бы циклогекса-1,3,5-ену Кекуле искаженную форму.
Рис. 7. Искаженная форма циклогекса-1,3,5-триена
Однако изображение показало, что бензол на самом деле представляет собой правильный шестиугольник. Это означало, что все его связи были одинаковой длины. Кроме того, ученые измерили длину этих связей и обнаружили, что они находятся на полпути между одинарной и двойной связью по длине, что позволяет предположить, что они не были ни тем, ни другим, а чем-то другим.
Рис. 8. Таблица, показывающая длины различных углерод-углеродных связей
Изомерные продукты
Давайте рассмотрим еще одно доказательство против предсказанной Кекуле структуры бензола. Возьмите два соседних атома углерода бензола. Представьте себе, например, замену присоединенных атомов водорода на бром. Если бы бензол действительно был циклогекса-1,3,5-триеном, можно было бы ожидать, что он образует два разных изомера: один с двойной связью между двумя затронутыми атомами углерода, а другой с одинарной связью между ними. Мы можем видеть это ниже.
Рис. 9 – Два изомерных продукта бензола
Однако ученые наблюдали только один изомер. Это означало, что бензол не мог иметь структуру, предсказанную Кекуле. Он должен был иметь идентичные облигации.
Бедный Кекуле — он действительно думал, что разгадал тайну бензола, но все улики были против него! Он предложил одну окончательную идею — бензол состоит из двух структур, находящихся в равновесии, быстро переключающихся между ними. Это привело бы к гибридной молекуле, которая не была бы ни тем, ни другим. Он назвал это резонансная модель . Однако не было никаких доказательств, подтверждающих это. Вместо этого мы теперь верим в делокализованную модель , описанную ранее. Делокализация объясняет резонансную энергию бензола, а идентичные промежуточные связи С-С объясняют, почему бензол имеет правильную форму.
Это привело бы к гибридной молекуле, которая не была бы ни тем, ни другим. Он назвал это резонансная модель . Однако не было никаких доказательств, подтверждающих это. Вместо этого мы теперь верим в делокализованную модель , описанную ранее. Делокализация объясняет резонансную энергию бензола, а идентичные промежуточные связи С-С объясняют, почему бензол имеет правильную форму.
Рис. 10 – Резонансная модель. Кекуле считал, что бензол на самом деле представляет собой две структуры, которые быстро чередуются друг с другом. Обратите внимание, как различаются положения двойных связей между двумя молекулами
Свойства бензола
Из-за своей уникальной структуры и кольца делокализации бензол обладает некоторыми уникальными свойствами. Давайте рассмотрим их ниже.
Горение
Вы должны знать, что циклические алканы имеют общую формулу Cnh3n. Таким образом, циклический углеводород с шестью атомами углерода будет иметь двенадцать атомов водорода.
Точка плавления и кипения
Поскольку бензол неполярен , единственные силы , которые он испытывает между молекулами , — это слабые силы Ван — дер — Ваальса , также известные как лондонские силы . Однако бензол представляет собой плоскую молекулу . Это означает, что в твердом состоянии он может плотно упаковываться в аккуратные слои. Напротив, циклогексан основан на тетраэдрических расположениях атомов, что означает, что он имеет разные атомы водорода, торчащие во всех направлениях! Это означает, что молекулы не могут соединяться друг с другом так аккуратно, как твердое тело.
Плотно упакованные молекулы испытывают более сильные межмолекулярные силы, чем удаленные молекулы, поэтому бензол имеет более высокую температуру плавления, чем циклогексан. Однако в жидком виде эта аккуратная композиция разрушается. Таким образом, обе молекулы имеют одинаковые температуры кипения.
Однако в жидком виде эта аккуратная композиция разрушается. Таким образом, обе молекулы имеют одинаковые температуры кипения.
Рис. 11 – Строение, температуры плавления и кипения бензола и циклогексана
Растворимость
Как и другие неполярные углеводороды, бензол нерастворим в воде, но растворим в других органических растворителях.
Реакционная способность бензола
Как мы выяснили ранее, бензол не любит участвовать в реакциях присоединения . Для этого потребуется разрушить сильное кольцо делокализации, которое очень стабильно, потому что распределяет отрицательные заряды электронов по большей площади.
Однако бензол участвует в реакциях замещения . Они включают замену одного атома или группы на другой. В этом случае мы можем заменить атомы водорода на другие виды, такие как галогены или гидроксильные группы.
Бензольное кольцо делокализации представляет собой область электронной плотности. Это делает его очень привлекательным для электрофилов .
Что такое электрофилы?
Электрофилы являются акцепторами электронных пар. Поскольку термин -phile происходит от латинского philos , означающего любовь, мы можем сказать, что они просто любят электроны! Электрофилы имеют положительных или частичных положительных зарядов и вакантных орбиталей . Некоторыми распространенными примерами являются H+ и NO2.
Реакции электрофильного замещения
Теперь мы знаем, что бензол подвержен атаке электрофилов и что он обычно реагирует в реакциях замещения . Таким образом, мы можем заключить, что большинство реакций с участием бензола являются реакциями электрофильного замещения . Мы рассмотрим их в разделе Реакции бензола . К ним относятся:
- Реакции нитрования , замена атома водорода на группу -NO2. Это производит нитробензол, который используется в красках и фармацевтических препаратах.

- Реакции ацилирования Фриделя-Крафтса , где бензол реагирует с производным кислоты в присутствии катализатора хлорида алюминия. Продукт используется для пластмасс и моющих средств.
Структура бензола – Основные выводы
Молекулярная формула бензола C6H6. Это плоская шестиугольная молекула. Каждый атом углерода связан с двумя другими атомами углерода и одним атомом водорода. Остальные электроны образуют область делокализации выше и ниже его углеродного кольца.
Химик-органик Кекуле предложил структуру бензола, состоящую из чередующихся одинарных С-С и двойных С=С связей. Однако такие данные, как энтальпия гидрирования, длины связей, изомерные продукты и поведение в реакциях присоединения, опровергли его теорию.
Бензол горит сажистым пламенем из-за высокого отношения водорода к атомам углерода. Он относительно стабилен и нерастворим в воде.
Бензол имеет более высокую температуру плавления, чем аналогичные циклоалканы, поскольку он представляет собой плоскую молекулу и может быть плотно упакован.

