Что внутри аккумулятора телефона (литий-ионной батареи
При недавнем добавлении новых разделов сайта нашего интернет-магазина Neovolt.ru, посвящённых замене элементов питания на нашем производственном предприятии, появилась идея сделать простые схемы устройства аккумуляторов для иллюстрирования материалов.
Несложная с виду идея вылилась в многочасовую проверку возможных изобретений новых вариантов конструкций, в перелопачивание тонны публикаций на BatteryUniversity, в общение с экспертами и инженерами на Quora и в Reddit по материалам в сепараторах и проводниках, чтобы ничего не упустить из внимания.
Получился огромный материал, который в дальнейшем пришлось сократить, иначе можно книгу написать. Результатом делимся с вами.
Что внутри аккумулятора смартфона
Батареи литий-ионного или литий-полимерного типа работают с помощью химических реакций, которые «отправляют» электроны и ионы с одного электрода на другой. Вот, как всё выглядит, когда наш инженер разбирает внешнюю часть корпуса аккумулятора, например, Samsung Galaxy S9 или любого другого смартфона после извлечения из устройства.
Вот, как всё выглядит, когда наш инженер разбирает внешнюю часть корпуса аккумулятора, например, Samsung Galaxy S9 или любого другого смартфона после извлечения из устройства.
Устройство аккумулятора телефона/смартфона:
(1) Соединительный элемент подключает аккумулятор к системной плате смартфона (в несъёмной конструкции) или к контактам на внешнем корпусе батареи (в съёмной конструкции).
- • Он может быть в виде многожильного провода (как на схеме) или в виде шлейфа.
- • Шлейф имеет гибкую (как у iPhone 6) или формованную (как у Galaxy S8 Plus) основу.
- • У соединительного кабеля чаще всего есть коннектор с несколькими контактами (от двух до пяти).
- • В редких старых или бюджетных смартфонах соединение с системной платой выполняется не через разъём, а методом пайки (у нас есть пример такого соединения в инструкции разборки iPod Touch 6).
(2) — Плата системы управления аккумулятором (Battery Management System, BMS). На неё устанавливается логика работы батареи и предохранитель.
На неё устанавливается логика работы батареи и предохранитель.
(3) и (4) — Положительный и отрицательные выводы питания для работы в электрической цепи.
(5) и (7) — Электродные материалы размещаются на тонкой металлической основе, напоминающей фольгу. Она собирает электроны и передаёт их из батареи к устройству.
Электроды не способны хранить много энергии в ограниченной зоне.
Поэтому нужны длинные скрутки таких полос, чтобы аккумулятор смог обеспечить смартфон необходимой энергией. Их количество и размеры влияют на конечную ёмкость и габариты батареи. Кстати, мы уже рассказывали, по какому принципу производители выбирают и проектируют аккумулятор в процессе разработки очередного смартфона.
(6) и (8) — Сепаратор препятствует электрической проводимости между электродными материалами (катодом и анодом) в пределах тока, который должен проходить через сепаратор в процессе движения ионов от катода к аноду (во время заряда) и обратно (во время разряда).
С превышением температуры (выше 130°C) материал плавится и закрывает поры во избежания дальнейшей катализации химической реакции и взрыва аккумулятора.
В большинстве смартфонов сепаратор однослойный из полиэтиленового материала, пропитанного электролитом.
Хотя последнее время в применение вошли сепараторы трёхслойной «гамбургерной» конструкции для более надёжной работы аккумулятора в условиях повышенной нагрузки:
- • Полипропилен (стойкость +155°C)
- • Полиэтилен (стойкость +130°C)
- • Полипропилен (стойкость +155°C)
(9) — Корпус аккумулятора представляет собой термостойкий материал с достаточной прочностью, чтобы выдерживать небольшие физические воздействия (например, от стягивания внутренних комплектующих смартфона).
В съёмной конструкции размещается в ударостойкую оболочку с контактной площадкой.
Это нужно для удобного и, главное, безопасного хранения вне мобильного устройства (из-за чего превышает габариты несъёмного аккумулятора аналогичных технических характеристик). Может иметь разные виды материалов, выбор которых зависит от производителя.
Может иметь разные виды материалов, выбор которых зависит от производителя.
Научно-популярные статьи
Вы помогаете наполнять базу знаний Neovolt без ошибок и упущений. Пишите в комментарии предложения, свои взгляды и замечания — мы их читаем все без исключения. Или отправьте сообщение нам ВКонтакте @NeovoltRu.
Подпишитесь в группе на новости из мира гаджетов, узнайте об улучшении их автономности и прогрессе в научных исследованиях аккумуляторов. Подключайтесь к нам в Facebook и Twitter. Мы также ведём насыщенный блог в «Дзене» и на Medium — заходите посмотреть.
Как соединены пластины в аккумуляторе. Из чего состоит аккумулятор. Что же под верхней крышкой
Аккумулятор — это важнейшая деталь машины, поэтому поддержание батареи в исправном состоянии будет являться залогом эффективного запуска двигателя, а также бесперебойной работы бортовых потребителей электричества. Чтобы правильно эксплуатировать АКБ необходимо ознакомиться с основными принципами работы этого устройства. В этой статье будут подробно рассказано, как устроен автомобильный аккумулятор.
Содрежание
Из чего состоит аккумулятор
Автомобильный элемент питания собирается на заводе из многих элементов, поэтому для понимания принципа работы источника электрического тока необходимо знать назначение каждого компонента. Аккумуляторная батарея состоит из следующих частей.
Корпус. Современная АКБ изготавливается из ударопрочного полипропилена. Этот материал хорошо переносит не только повышенные механические нагрузки и вибрации, но и устойчив к воздействую кислоты, которая в виде раствора заполняет внутренние полости батареи. Кроме этого полипропилен устойчив к большим перепадам температуры. Корпус АКБ разделён на 6 герметически отделённых между собой секций, в которые, в процессе изготовления батареи, устанавливаются свинцовые электроды и сепараторы.
Сепараторы. Сепараторы устанавливаются между электродами и служат диэлектриками, которые надёжно предохраняет элементы батареи от короткого замыкания. Эти элементы также изготавливаются из кислотоустойчивого полимера, который не разрушается при воздействии агрессивной среды в течение всего времени эксплуатации АКБ.
Эти элементы также изготавливаются из кислотоустойчивого полимера, который не разрушается при воздействии агрессивной среды в течение всего времени эксплуатации АКБ.
Электроды. В большинстве выпускаемых аккумуляторных батарей используются свинцовые пластины с различными примесями, в ячейках которых находится масса, состоящая из свинцового порошка и серной кислоты. Пластины современных аккумуляторов могут быть изготовлены из свинца легированного кальцием, что позволяет значительно увеличить ресурс батареи.
Электролит. Электролит представляет собой раствор серной кислоты и дистиллированной воды. Эта жидкость необходима для того, чтобы электрический ток свободно протекал от отрицательных электродов к положительным. В дорогих батареях вместо жидкого электролита он может быть запечатанным использован гель. Благодаря этим качествам гелевые аккумуляторы выпускаются в виде полностью необслуживаемых изделий.
Клеммы. У всех батарей имеются клеммы, они могут быть разных типов стандартные (европейские), ASIA (тонкие конусы для азиатских автомобилей) и винтовые (для американских автомобилей).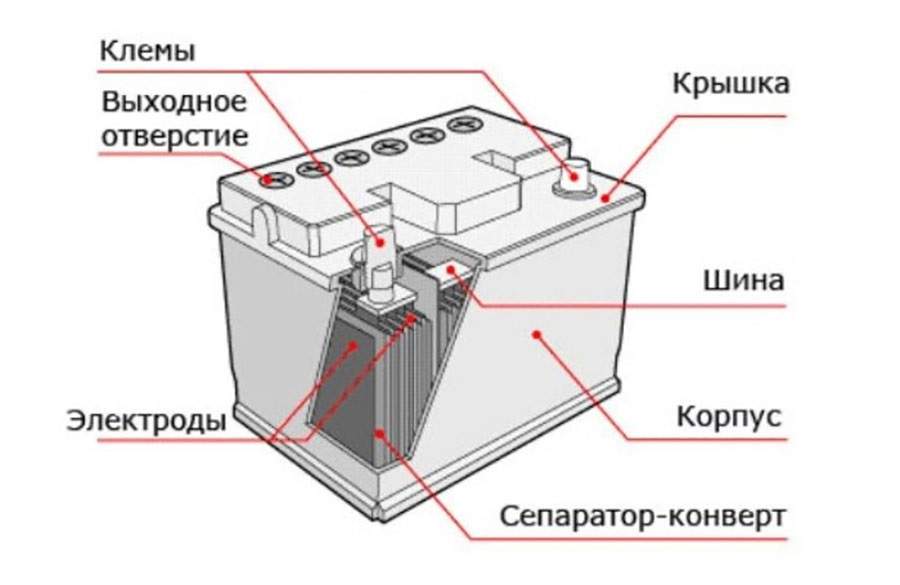 Изредка можно встреть батареи с четырьмя клеммами на корпусе.
Изредка можно встреть батареи с четырьмя клеммами на корпусе.
Дополнительный функционал:
- У необслуживаемых батарей вместо стандартных шести пробок по бокам имеются 2 клапана сброса давления (в случае закипания электролита через них будет сбрасываться газ).
- Некоторые аккумуляторы оснащены «глазком», с помощью которого можно легко определить степень заряженности и уровень электролита.
Как устроен аккумулятор
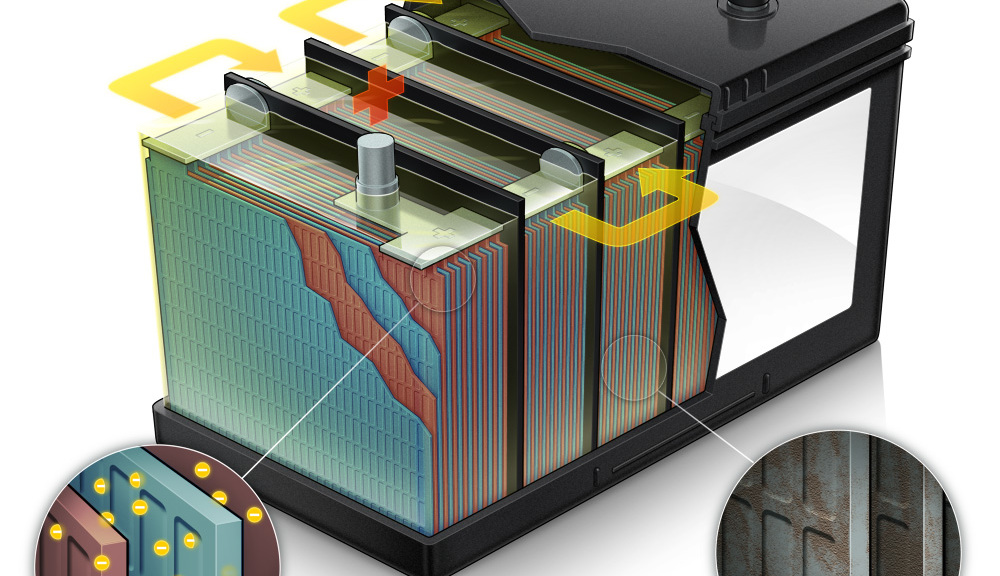
Аккумуляторная батарея устроена таким образом, чтобы в результате подачи на её клеммы постоянного тока происходило эффективное накапливание электрической энергии. Автомобильная АКБ состоит из 6 изолированных друг от друга ёмкостей, в которых находятся отрицательные и положительные пластины, отделённые между собой сепараторами.
Каждая такая банка позволяет аккумулировать электрический ток напряжением до 2,1 В. Для получения стандартного напряжения бортовой сети автомобиля, применяется схема последовательного подключения таких электрических элементов.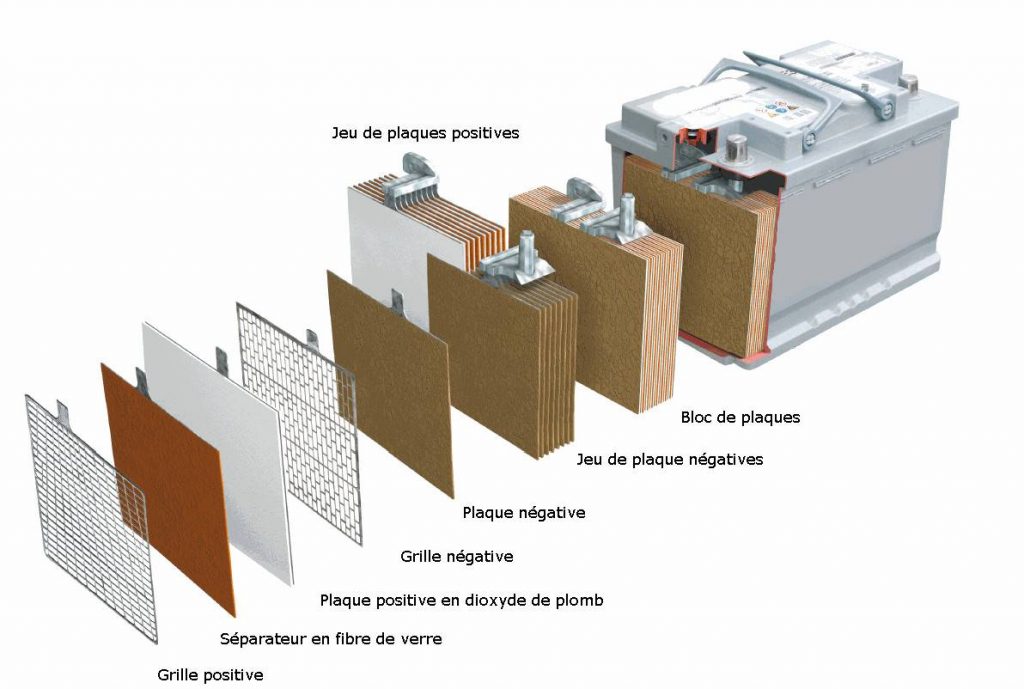
Принцип работы аккумулятора
Автомобильный свинцовый аккумулятор представляет собой восстанавливаемый химический элемент питания, в котором образование электричества происходит в результате реакции между двуокисью свинца, губчатым свинцом и раствором серной кислоты.
При подаче постоянного тока на клеммы аккумулятора на отрицательных пластинах образуется чистый свинец, а на положительных – диоксид свинца. При подключении батареи к различным устройствам и агрегатам, потребляющим электроэнергию, происходит обратный процесс, при котором на отрицательных электродах образуется сульфат свинца, а из электролита высвобождается чистая вода.
В зависимости от типа аккумуляторной батареи такая последовательность может повторяться тысячи раз, прежде чем произойдёт сульфатация или разрушение пластин.
Особенности конструкций
Аккумуляторные батареи могут существенно отличаться друг от друга. К особенностям конструкции АКБ можно отнести:
- Размер аккумулятора.
- Состав металлического сплава пластин.
- Вид электролита.
- Расположение электрических выводов на корпусе.
От размера пластин и количества электролита в каждой банке будет зависеть ёмкость АКБ, поэтому изделия, устанавливаемые для запуска дизельных установок грузовых автомобилей, могут в несколько раз превышать по массе и объёму батареи для легковых авто.
От вида свинцового сплава будет зависеть внутреннее электрическое сопротивление батареи и устойчивость элемента к воздействию агрессивной среды. Также состав металла будет влиять на интенсивность испарения влаги, поэтому для необслуживаемых моделей пластины изготавливаются из легированного кальцием свинца.
От вида электролита, применяемого в банках аккумулятора, также зависит большое количество параметров батареи. Жидкий раствор замерзает при низких температурах воздуха, а при кипении приводит к испарению воды, поэтому замена его на гель позволяет существенно увеличить ресурс изделий. Гелевые аккумуляторы значительно лучше переносят глубокий разряд, что позволяет использовать их не только в качестве пусковых устройств, но и для питания силовых электрических установок.
Жидкий раствор замерзает при низких температурах воздуха, а при кипении приводит к испарению воды, поэтому замена его на гель позволяет существенно увеличить ресурс изделий. Гелевые аккумуляторы значительно лучше переносят глубокий разряд, что позволяет использовать их не только в качестве пусковых устройств, но и для питания силовых электрических установок.
Аккумуляторы могут отличаться и по расположению клемм на корпусе. Этот параметр следует обязательно учитывать при подборе новой АКБ, иначе потребуется удлинять плюсовой провод автомобиля, подключаемый к источнику питания.
Знание — сила, особенно, когда дело доходит до аккумулятора Вашего автомобиля и его (автомобиля) электрической системы. На самом деле, если двигатель — сердце нашего автомобиля, то — это его центральная нервная система (а, может быть, даже и душа) — он хранит и производит электроэнергию, а также контролирует силу тока электросети. Последнее, что Вы хотели бы — это остаться на пустынной трассе с умершим аккумулятором.
Как работает автомобильный аккумулятор?
Автомобильный аккумулятор обеспечивает всю электросистему машины необходимым количеством электроэнергии для питания всех электрических компонентов в Вашем автомобиле. И речь здесь идёт о довольно огромной ответственности. Без аккумулятора автомобиль, как Вы, наверное, уже поняли, никуда не поедет. Давайте взглянем на то, как работает этот мощный маленький ящик!
Химическая реакция — это главный принцип работы аккумулятора: он попросту преобразует химическую энергию в электрическую, необходимую для питания Вашего автомобиля, обеспечения напряжением стартера и множества других электрических узлов машины, а также электрическую — обратно в химическую. Ещё одна важная функция аккумулятора — он обеспечивает постоянство силы тока — он также стабилизирует напряжение для того, чтобы двигатель работал.
По-простому принцип работы аккумулятора можно охарактеризовать так: химические процессы в нём приводят в появлению электрического тока, которым питается автомобиль — особенно полезен такой ток, и больше всего его потребляется, когда Вы стартером раскручиваете двигатель, заводя его; когда же автомобиль заведён, то двигатель крутит генератор — и здесь мы видим процесс превращения механической энергии (кручение генератора) в электрическую — в свою очередь генератор передаёт произведённый им ток аккумулятору, и тот превращает уже электроэнергию в химическую — аккумулирует её, сохраняет, чтобы затем опять «накормить» ей тот стартер или любые иные электрические системы автомобиля, когда генератор не работает или же когда электроэнергии, производимой генератором недостаточно для обеспечения всех систем автомобиля.
Автомобильный аккумулятор имеет два полюса: один положительный и второй — отрицательный, и Вы, наверное, уже знаете это, если хотя бы раз видели или отсоединяли/крепили клеммы аккумулятора. Эти полюсы подключаются к машине и отвечают за питание ряда очень важных механизмов автомобиля, в том числе:
- Запуск двигателя
- Воспроизведение аудиосистемы
- Все световые механизмы (фары, задние фонари, разного рода подсветки и т.п.)
- Стеклоочистители
- Многое-многое другое.
В подавляющем большинстве случаев аккумулятор состоит из шести ячеек. В каждую ячейку помещаются два электрода, представляющих собой и изготовленных из восьми перекрывающихся металлических пластин. Эти восемь перекрывающихся металлических пластин образуют то, что известно как «гальванический элемент». Таким образом, в общей сложности каждая ячейка включает 2 электрода и 16 пластин. Именно через эти пластина производится питание электричеством автомобиля. Но как это работает?
На самом деле, всё достаточно просто — давайте резюмируем вышеописанное:
- Батарея состоит из шести ячеек
- Каждая ячейка состоит из двух наборов пластин
- Каждый набор пластин включает в себя восемь перекрывающихся металлических пластин
А теперь немного химии. ..
..
Первый набор пластин в ячейке является положительным, а второй — отрицательным. Положительное сетка покрыта оксидом свинца и приносит электроны в ячейку. Отрицательный набор покрыт непосредственно свинцом, и он, наоборот, освобождает электроны. Металлические пластины — помните, восемь из них в каждой сетке, 16 в каждой ячейке — находятся в смеси воды и серной кислоты (на самом деле в этой концентрации только около 35 процентов серной кислоты, но этого более чем достаточно, чтобы, например, прожечь одежду и сильно обжечь кожу. Эта смесь действует как электролит — вещество, которое хорошо проводит электричество.
Когда аккумулятор заряжается (от генератора или другими способами), то происходит химическая реакция окисления свинца на положительном заряде, в результате чего электролит насыщается серной кислотой и удельный вес электролита повышается. Когда же аккумулятор, наоборот, разряжается, питая какие-либо электросистемы автомобиля (мы помним, что основной потребитель — это стартер), то за счёт восстановления свинца на другом — отрицательном наборе пластин, в результате которого образуется больше воды, и, следовательно, удельный вес электролита уменьшается. При этом, химический процесс в каждой из пластин настолько ничтожен, что выделяется очень мало энергии, но на выходе из аккумулятора легкового автомобиля, когда все эти реакции проходят по всем 6 ячейкам, мы и получаем уже сокровенные 12 Вольт.
При этом, химический процесс в каждой из пластин настолько ничтожен, что выделяется очень мало энергии, но на выходе из аккумулятора легкового автомобиля, когда все эти реакции проходят по всем 6 ячейкам, мы и получаем уже сокровенные 12 Вольт.
Возможные неполадки аккумулятора
Аккумулятор со временем приходит в негодность — это естественный его износ и, кроме того, разного рода вредные процессы в нём и воздействия на него могут значительно укоротить срок его жизни. И первыми симптомами того, что в аккумуляторе есть неполадки, являются неспособность завести автомобиль (особенно, в морозную погоду).
Итак, какие же могут быть проблемы с аккумулятором?
- Низкий уровень жидкости в аккумуляторе: автомобильные аккумуляторы обычно имеют небольшую часть корпуса в виде полупрозрачной полосы — чтобы Вы всегда могли следить за уровнем жидкости Вашего аккумулятора. Если уровень жидкости ниже свинцовых пластин (проводник электричества) внутри аккумулятора, то это самое время, чтобы либо долить её, либо заменить аккумулятор .

- «Отёк» аккумулятора — это когда корпус Вашего аккумулятора выглядит так, как-будто он съел очень много и вздулся. Это может указывать на срочную замену аккумулятора. Можно обвинить избыточное количества тепла в качестве причины вздутия аккумулятор и, как следствие, уменьшения срока службы аккумулятора.
- Запах тухлых яиц от аккумулятора: Вы можете заметить острый запах тухлого яйца (на самом деле, это запах серы) вокруг своей батареи. Причина: протечка аккумулятора. Протечка эта, кроме запаха, также вызывает коррозию вокруг клемм.
В широком смысле слова в технике под термином «Аккумулятор» понимается устройство, которое позволяет при одних условиях эксплуатации накапливать определенный вид энергии, а при других — расходовать ее для нужд человека.
Их применяют там, где необходимо собрать энергию за определенное время, а затем использовать ее для совершения больших трудоемких процессов. Например, гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.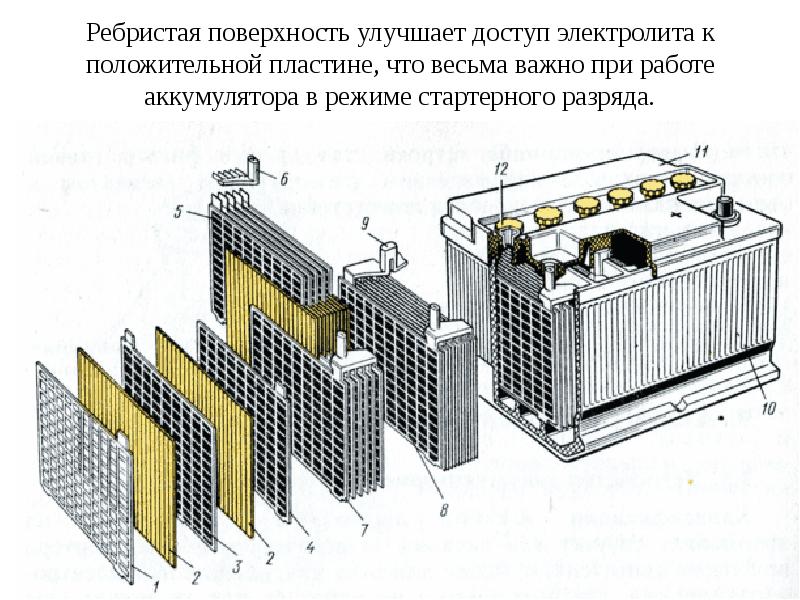
Электрические аккумуляторы работают с электроэнергией по этому же принципу: вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а затем отдают его подключенным потребителям для совершения работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
Во время работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
Принципиальную схему устройства аккумулятора можно представить рисунком упрощенного вида, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
Работа аккумулятора при разряде
Когда к электродам подключена нагрузка, например, лампочка, то создается замкнутая электрическая цепь, через которую протекает ток разряда. Он формируется движением электронов в металлических частях и анионов с катионами в электролите.
Этот процесс условно показан на схеме с никель-кадмиевой конструкцией электродов.
Здесь в качестве материала положительного электрода используют окислы никеля с добавками графита, которые повышают электрическую проводимость. Металлом отрицательного электрода работает губчатый кадмий.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.
Работа аккумулятора при заряде
При отключенной нагрузке на клеммы пластин подается постоянное (в определенных ситуациях пульсирующее) напряжение большей величины, чем у заряжаемого аккумулятора с той же полярностью, когда плюсовые и минусовые клеммы источника и потребителя совпадают.
Зарядное устройство всегда обладает большей мощностью, которая «подавляет» оставшуюся в аккумуляторе энергию и создает электрический ток с направлением, противоположным разряду. В результате внутренние химические процессы между электродами и электролитом изменяются.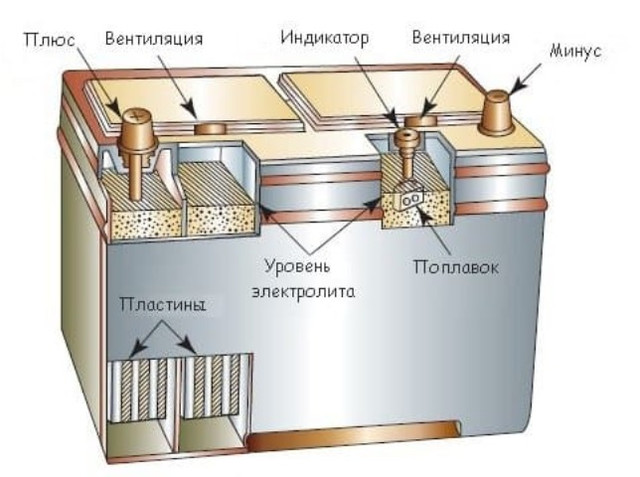 Например, на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
Например, на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
При разряде и заряде аккумулятора происходит изменение химического состава материала пластин (электродов), а электролита не меняется.
Способы соединения аккумуляторов
Параллельное соединение
Величина тока разряда, которую может выдержать одна банка, зависит от многих факторов, но в первую очередь от конструкции, примененных материалов и их габаритов. Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Этот принцип используется для параллельного подключения однотипных банок у аккумуляторов при необходимости увеличения тока на нагрузку. Но для заряда такой конструкции потребуется поднимать мощность источника. Этот способ используется редко для готовых конструкций, ведь сейчас намного проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
Последовательное соединение
В зависимости от применяемых материалов, между двумя электродными пластинами распространенных в быту аккумуляторов может быть выработано напряжение 1,2/1,5 или 2,0 вольта. (На самом деле этот диапазон значительно шире.) Для многих электрических приборов его явно недостаточно. Поэтому однотипные аккумуляторы подключают последовательно, причем это часто делают в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов.
Обычно в народе, особенно среди водителей транспорта, принято называть аккумулятором любое устройство, независимо от количества его составных элементов — банок. Однако, это не совсем правильно. Собранная из нескольких последовательно подключенных банок конструкция является уже батареей, за которой закрепилось сокращенное название «АКБ»
. Ее внутреннее устройство показано на рисунке.
Любая из банок состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Соединение пластин в блоки увеличивает их рабочую площадь, снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
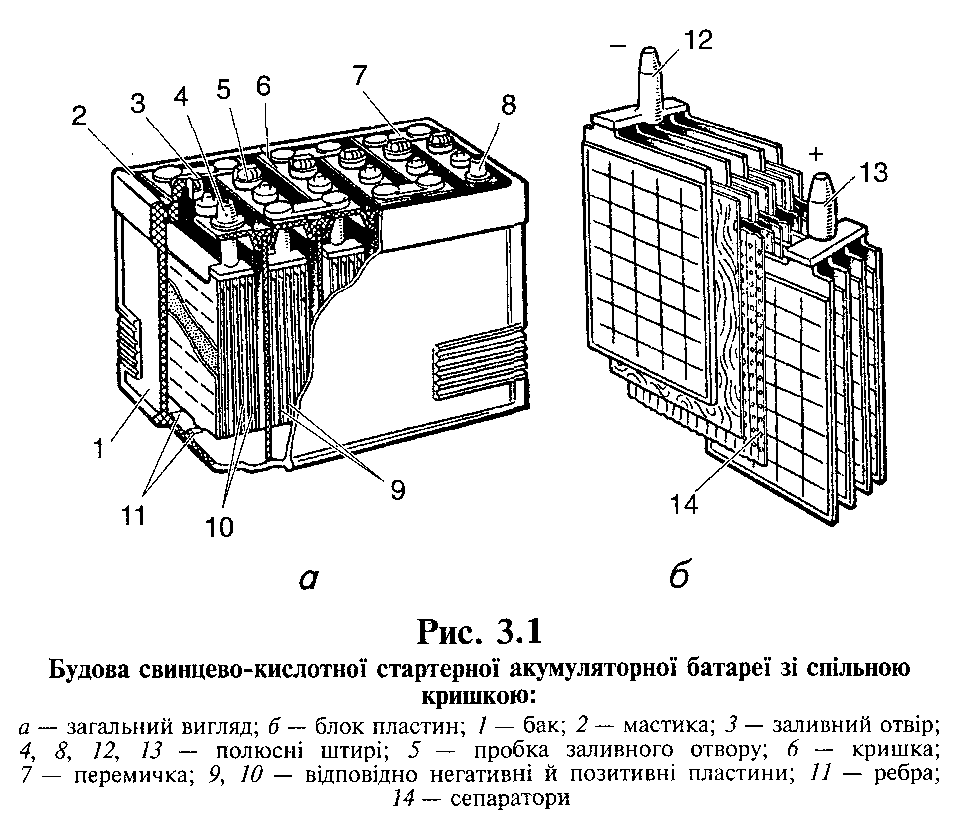
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами (обычно конусной формы) для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». Как правило, для блокировки ошибок при подключении диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки размещена заливная горловина для контроля уровня электролита или доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, которая предохраняет внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
В нее вворачиваются пробка, которая предохраняет внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Поскольку при мощном заряде возможно бурное выделение газов из электролита (а этот процесс возможен при интенсивной езде), то в пробках делаются отверстия для предотвращения повышения давления внутри банки. Через них выходят кислород и водород, а также пары электролита. Подобные ситуации, связанные с чрезмерными токами заряда, желательно избегать.
На этом же рисунке показано соединение элементов между банками и расположение пластин-электродов.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс, сопровождающийся изменением химического состава активной массы электродов с выделением/поглощением в электролит (серную кислоту) воды.
Этим объясняется повышение удельной плотности электролита при заряде и снижение при разряде батареи. Другими словами, величина плотности позволяет оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
Другими словами, величина плотности позволяет оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
Входящая в состав электролита кислотных батарей дистиллированная вода при отрицательной температуре переходит в твердое состояние — лед. Поэтому, чтобы автомобильные аккумуляторы не замерзали в холодное время, необходимо применять специальные меры, предусмотренные правилами эксплуатации.
Какие существуют типы аккумуляторов
Современное производство для различных целей выпускает более трех десятков разнообразных по составу электродов и электролиту изделий. Только на основе лития работает 12 известных моделей.
В качестве металла электродов могут встретиться:
Они влияют на электрические выходные характеристики, а, следовательно, на область применения.
Способность выдерживать кратковременно большие нагрузки, возникающие при раскрутке коленчатых валов двигателей внутреннего сгорания электродвигателями-стартерами, характерна для свинцово-кислотных АКБ. Они широко используются в транспорте, источниках бесперебойного питания и системах аварийного электроснабжения.
Они широко используются в транспорте, источниках бесперебойного питания и системах аварийного электроснабжения.
Стандартные (простые батарейки) обычно заменяют никель кадмиевыми, никель-цинковыми и никель-металлгидридными аккумуляторами.
А вот литий-ионные или литий-полимерные конструкции надежно работают в мобильных и компьютерных устройствах, строительном инструменте и даже электромобилях.
По виду применяемого электролита аккумуляторы бывают:
кислотными;
щелочными.
Существует классификация аккумуляторов по назначению. Например, в современных условиях появились устройства, используемые для передачи энергии — подзаряда других источников. Так называемый внешний аккумулятор выручает владельцев многих мобильных устройств в условиях отсутствия переменной электрической сети. Он способен многократно заряжать планшет, смартфон, мобильник.
Все эти аккумуляторы имеют однотипный принцип работы и подобное устройство. Например, пальчиковая литий-ионная модель, представленная на рисунке ниже, повторяет во многом конструкцию рассмотренных ранее кислотных АКБ.
Здесь мы видим те же электроды-контакты, пластины, сепаратор и корпус. Только выполнены они с учетом других условий работы.
Основные электрические характеристики аккумулятора
На эксплуатацию устройства влияют параметры:
емкость;
плотность энергии;
саморазряд;
температурный режим.
Емкостью называют максимальный заряд у аккумулятора, который он способен отдать во время разряда до наименьшего напряжения. Ее выражают в кулонах (система СИ) и ампер часах (внесистемная единица).
Как разновидность емкости существует «энергетическая емкость», определяющая энергию, отдаваемую при разряде до минимально допустимого напряжения. Она измеряется джоулями (система СИ) и ватт-часами (внесистемная единица).
Плотность энергии выражается соотношением количества энергии к весу или объему аккумулятора.
Саморазрядом
считают потери емкости после заряда при отсутствии нагрузки на клеммах. Он зависит от конструкции и усиливается при нарушениях изоляции между электродами по многочисленным причинам.
Температурный режим эксплуатации влияет на электрические свойства и при серьезных отклонениях от указанной производителем нормы может вывести аккумулятор из строя. Жара и холод недопустимы, они влияют на протекание химических реакций и давление среды внутри банки.
АКБ окружают людей в их повседневной жизни буквально повсюду – в мелкой и крупной домашней технике, средствах связи, любимом автомобиле. Несмотря на это, многие не знают, каков принцип работы аккумулятора, и посему не умеют с ним обращаться. На самом деле есть один генеральный принцип, которому подчинена работа батарей всех видов. Это обратимые химические реакции, происходящие циклично. Во время разряда аккумуляторной батареи происходит превращение энергии химической в электрическую, что обеспечивает работу технического устройства, к которому подключен АКБ. Когда запас этой энергии будет исчерпан на определенный процент, производят зарядку аккумулятора. Во время нее также идут химические превращения, но уже с обратным эффектом. То есть поступление электрического тока вызывает накопление запасов химической энергии.
То есть поступление электрического тока вызывает накопление запасов химической энергии.
Отличают разные аккумуляторы между собой два аспекта – тип электролита и материал, из которого выполнены электроды. Основой для электролита выступают кислоты или щелочи, которые после разбавления водой или другими добавками приобретают вид готовой гомогенной смеси различной консистенции (жидкой либо гелевой). Вещество, выступающее электродом, способно изменять свойства готового изделия. Самыми распространенными являются литиевые, свинцовые и никель-кадмиевые батареи.
Об автомобильных аккумуляторах
Принцип работы стандартного автомобильного аккумулятора опирается на его конструкцию и не зависит от того, залит в него кислотный или щелочной электролит.
Внутри диэлектрического и нерастворимого серной корпуса из специального пластика помещаются шесть банок-батареек, последовательно прикрепленных друг к другу. В каждой из этих банок есть по несколько электродов с зарядами «плюс» и «минус», которые выглядят как отводящая ток решетка, смазанная специальной химически активной массой.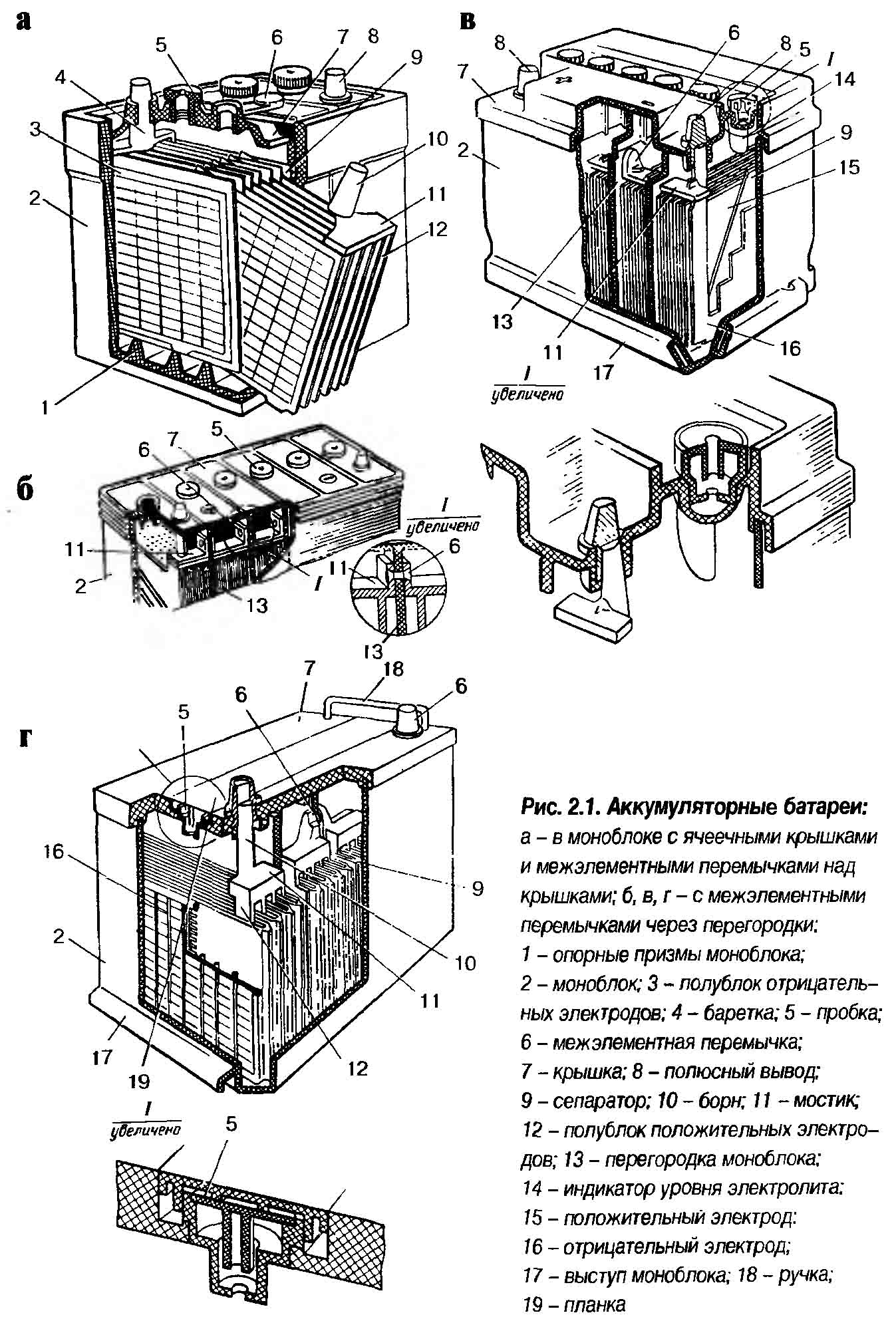
Чтобы решетки с разными знаками случайно не соприкоснулись и не закоротили, каждая из них погружена в разделитель из полиэтилена. Сами электроды сделаны обычно из свинца с разнообразными примесями.
Если быть точным, то таких свинцовых решеток бывает три вида:
- Малосурьмянистые . И аноды, и катоды сделаны из сплава свинец+сурьма и требуют мало обслуживающих процедур.
- Кальциевые . Здесь примесь, соответственно, кальций. Такие электроды вообще не нужно обслуживать.
- Гибридные . Один электрод, с минусом, делается из кальциевого сплава, а положительный содержит сурьму.
Можно с уверенностью утверждать, что свинцово-кислотный — самый востребованный и распространенный для авто. Принцип работы свинцового аккумулятора основывается на активном взаимодействии серной кислоты с диоксидом свинца.
Когда батарея эксплуатируется, то есть нужна электрическая энергия, на катоде свинец окисляется, а его диоксид на аноде, напротив, участвует в восстановительной реакции.
Это все происходит за счет кислоты в электролите, часть ее распадается, соответственно, концентрация падает. Именно этим обусловлена необходимость периодически обновлять жидкость в батарее.
С гелевыми аккумуляторами такого не случается. Состояние электролита в них не позволяет ему испаряться, если, конечно, не перегреть АКБ во время подзарядки.
Именно благодаря отсутствию необходимости периодически восполнять запасы активного вещества батареи с желеобразным электролитом относят к категории . Еще одно их преимущество в том, что гель не отсоединяется от электрических контактов, а значит, невозможны внезапные сбои и замыкания.
Как устроен литий-ионный аккумулятор?
Его конструкция не отличается сложностью: анод из пористого углерода, литиевый катод, пластина-сепаратор между ними и проводник тока – вещество-электролит. Во время разрядки ионы отделяются от анода и движутся на литий по электролиту, минуя сепаратор. Во время питания батареи все происходит с точностью до наоборот – литий отдает ионы, углерод принимает. Так и происходит процесс ионного круговорота между разнозарядными электродами литий-ионной батареи.
Во время питания батареи все происходит с точностью до наоборот – литий отдает ионы, углерод принимает. Так и происходит процесс ионного круговорота между разнозарядными электродами литий-ионной батареи.
Точный состав катода может отличаться в конкретной модели или у определенного производителя АКБ. Дело в том, что многие фирмы тестируют разнообразные типы литиевых соединений для того чтобы изменять показатели устройств по своему усмотрению.
Впрочем, очевидно – улучшая одни характеристики, неизбежно приходится жертвовать другими. Чаще всего с повышенной емкостью, заботой об эксплуатирующих его людях и природной среде оказываются чрезмерно дорогостоящими или требуют слишком много внимания.
Но чего не отнять у батарей с литием, что составляет их принципиальную разницу с другими типами аккумуляторов, так это низкий уровень саморазряда.
Li-Pol аккумуляторные батареи
Литий-полимерные — это следующий этап развития литий-ионных АКБ. Принципиальная разница понятна из названия — в качестве электролита начинает использоваться полимерное соединение. Из-за прочности существующих в нем химических связей такой аккумулятор становится максимально безопасным, неправильная эксплуатация может сломать его самого, но не нанести вред владельцу, как это бывало с литиевыми АКБ с жидким наполнителем. Полимерный неопасно перегревать или протыкать острым предметом, в то время как жидкостной элемент уже давно бы взорвался.
Из-за прочности существующих в нем химических связей такой аккумулятор становится максимально безопасным, неправильная эксплуатация может сломать его самого, но не нанести вред владельцу, как это бывало с литиевыми АКБ с жидким наполнителем. Полимерный неопасно перегревать или протыкать острым предметом, в то время как жидкостной элемент уже давно бы взорвался.
Еще один огромный плюс Li-Pol батарей — их огромная проводимость. Из-за того, что в процессе реакций на анодах и катодах батарея приобретает свойства хорошего полупроводника, она способна передавать ток, в разы превышающий ее собственную электроемкость.
Щелочные батареи
Методика функционирования щелочного аккумулятора основывается на химических превращениях в щелочной среде. Именно поэтому для электродов таких АКБ применяют соединения металлов, которые активно взаимодействуют именно со щелочами.
Гидроокись никеля на электроде с положительным зарядом превращается в гидрат его закиси из-за череды реакций со свободными ионами в электролите.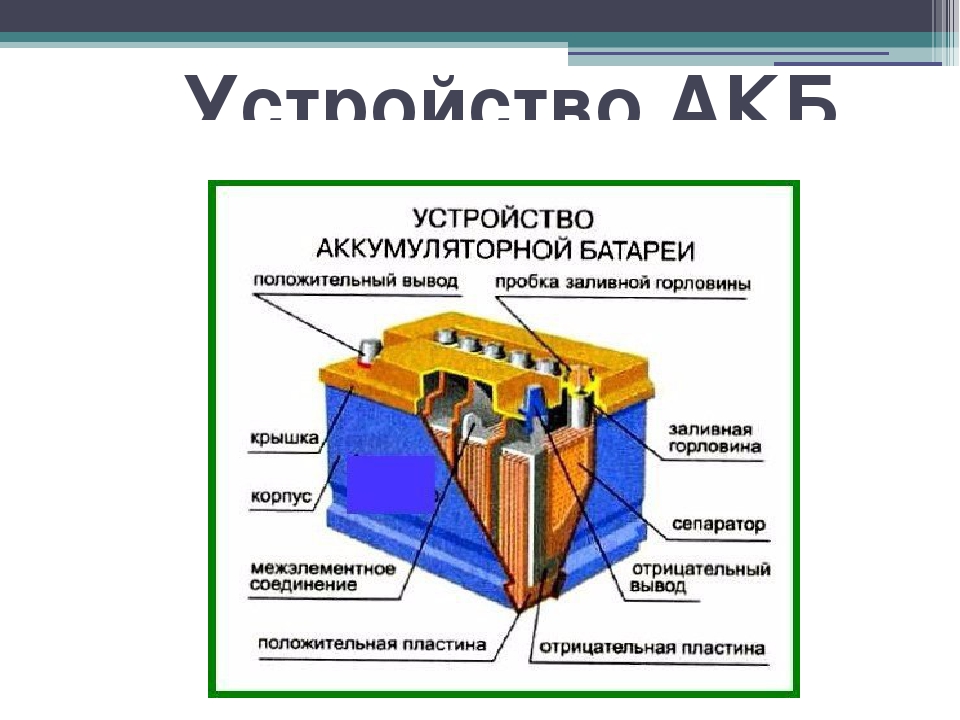 На катоде в это же время идут похожие взаимодействия, но только с образованием гидрата окиси железа. Между только что создавшимися веществами образуется разница в потенциалах, за счет которой и выделяется электроэнергия. В процессе подзарядки реакции те же самые, только в обратном порядке, вещества восстанавливаются до исходных.
На катоде в это же время идут похожие взаимодействия, но только с образованием гидрата окиси железа. Между только что создавшимися веществами образуется разница в потенциалах, за счет которой и выделяется электроэнергия. В процессе подзарядки реакции те же самые, только в обратном порядке, вещества восстанавливаются до исходных.
Ni-Cd аккумулятор
Обычно применяют для некрупной техники, например, для шуруповерта. Принцип их устройства и работы схож с автомобильным АКБ, только в гораздо меньших масштабах – те же последовательно соединенные несколько маленьких батареек, совместно вырабатывающих нужные электрические показатели, а внутри них – уже знакомые аноды, катоды, пластины сепараторов и жидкий электролит.
Специфические характеристики, присущие только этому типу аккумуляторов, обеспечивают именно химические свойства никеля и кадмия. Они же накладывают и обязательство быть осторожным, особенно при . Это вызвано тем, что кадмий – довольно токсичный элемент.
При аккуратной же эксплуатации шуруповертов с такими АКБ приборы гарантированно будут работать долгое время на высокой мощности, в любых погодных и температурных условиях.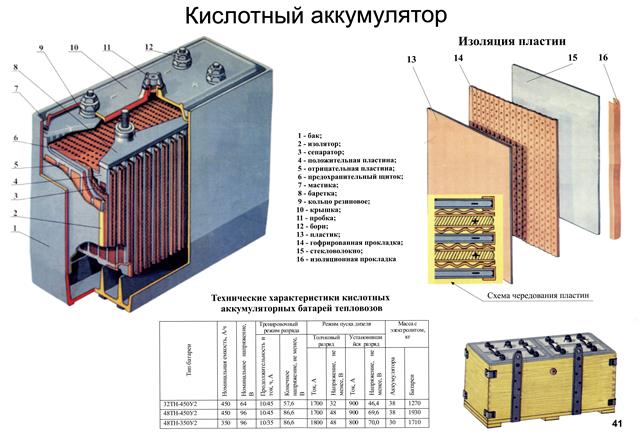 К тому же их можно очень быстро заряжать.
К тому же их можно очень быстро заряжать.
Ni-MH аккумулятор
По своему устройству и механизму работы никель-металл-гидридные батареи очень похожи на кадмиевые и были изобретены практически сразу после них. Основное отличие состоит в материале, из которого изготовлен отрицательный электрод.
В аккумуляторах типа он состоит из особого справа металлов, которые абсорбируют водород. Часть из них реагируют с ионами электролита с выделением тепловой энергии, другая часть – с ее поглощением, в результате чего возможно безопасное и экологически безвредное использование такого устройства.
Как работает зарядное устройство для АКБ?
ЗУ для аккумулятора обычно состоит из выпрямителя и трансформатора и создает ток с постоянным напряжением около 14 вольт. Также хорошие приборы содержат элементы, которые следят за напряжением на питаемом аккумуляторе и в нужный момент выключают зарядку.
По ходу процесса работы зарядного устройства для автомобильного аккумулятора или для любого другого подаваемый им ток сам собой падает. Вызвано это тем, что в заряжающемся АКБ увеличивается сопротивление, и он больше не пропускает ток с большим напряжением. Если в зарядке есть измеритель, то он фиксирует тот момент, когда в батарее достигнуто напряжение в 12В, после чего ее можно отключать от сети.
Вызвано это тем, что в заряжающемся АКБ увеличивается сопротивление, и он больше не пропускает ток с большим напряжением. Если в зарядке есть измеритель, то он фиксирует тот момент, когда в батарее достигнуто напряжение в 12В, после чего ее можно отключать от сети.
АКБ – вещь не такая сложная, как может показаться. Ее устройство легко понять, к тому же, принцип работы одинаков для разных видов. Знать его владельцу аккумулятора хоть в машине, хоть в настенных часах, очень полезно – это поможет поступать правильно на всех этапах – выбора, обслуживания и утилизации батарейки.
Автономные источники электроэнергии являются одними из самых полезных изобретений человечества. Что такое телефон или радио, в которых не установлены Устройство многих приспособлений, а также условия их использования не всегда предусматривают наличие постоянного сетевого электропитания, поэтому такие источники электроэнергии позволяют с комфортом осуществлять свою деятельность практически в любой точке мира.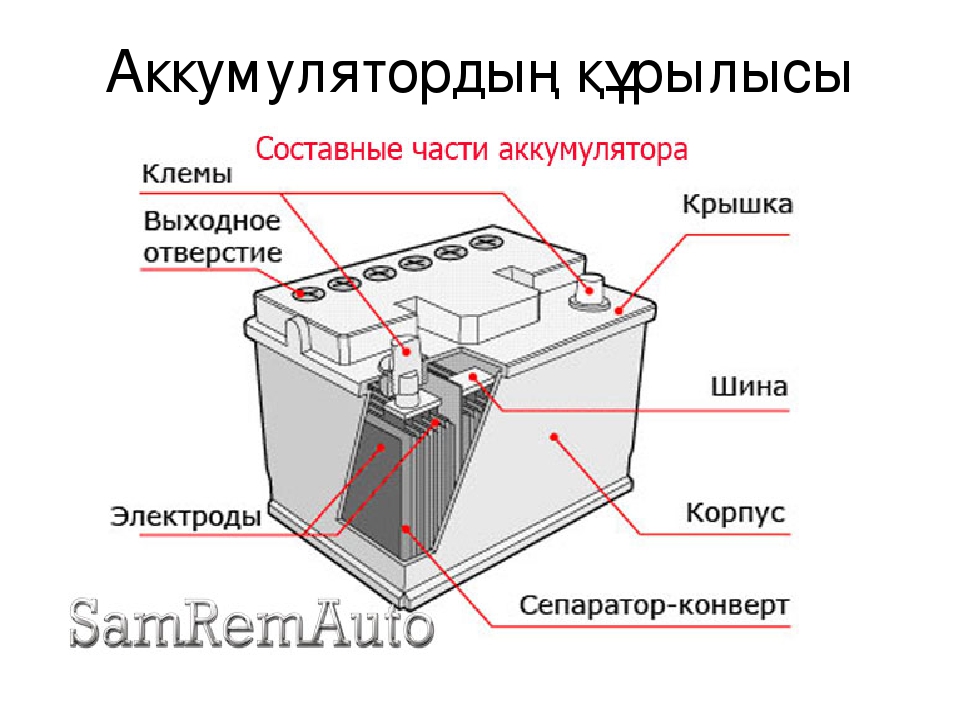 После небольшого предисловия давайте приступим к статье.
После небольшого предисловия давайте приступим к статье.
Что такое аккумуляторная батарея?
В широком смысле под этим понятием подразумевают устройство, что при одних условиях использования может накапливать какой-либо вид энергии, а при других — расходовать, чтобы удовлетворить нужды человека.
Аккумуляторы аккумулируют электричество от внешнего источника питания, а потом отдают её подключенным потребителям, чтобы они смогли делать свою работу. Так, когда устройства работают, постоянно протекают химические реакции между электролитом и электродными пластинами. Кстати, подобная конструкция размещена в банках, из которых и формируются аккумуляторные батареи. Устройство данных конструкций предусматривает создание напряжения, как правило, 1,2-2 В, что весьма мало. Поэтому для увеличения показателей источников питания и применяются разные типы соединения.
Как работают при
Устройство данных источников питания предусматривает подключение к плюсу и минусу. Функционируют они следующим образом: когда к электродам подключается нагрузка (в качестве примера можно рассмотреть лампочку), то возникает замкнутая электрическая цепь. По ней начинает протекать ток разряда. Формируется он благодаря движению электронов, анионов и катионов. Более детальную информацию о том, что и как протекает, можно рассказать только на конкретном примере.
По ней начинает протекать ток разряда. Формируется он благодаря движению электронов, анионов и катионов. Более детальную информацию о том, что и как протекает, можно рассказать только на конкретном примере.
Допустим, что у нас есть аккумулятор, где положительный электрод — это окись никеля, в который был добавлен графит для повышения проводимости. Для отрицательной пластины применяли губчатый кадмий. Так вот, когда идёт разряд, то частицы активного кислорода выделяются и попадают в электролит. При этом от них отделяются части, которые идут как электричество (те же электроны). Затем частицы активного кислорода направляются в сторону отрицательных пластин, где они окисляют кадмий.
Функционирование аккумулятора при заряде
Необходимо отключить нагрузку на клеммах пластин. На них же подаётся, как правило, постоянное напряжение (но может быть и пульсирующее, зависит от случая), которое больше, чем величина батареи, что заряжается. Причем полярность должна быть одинаковой.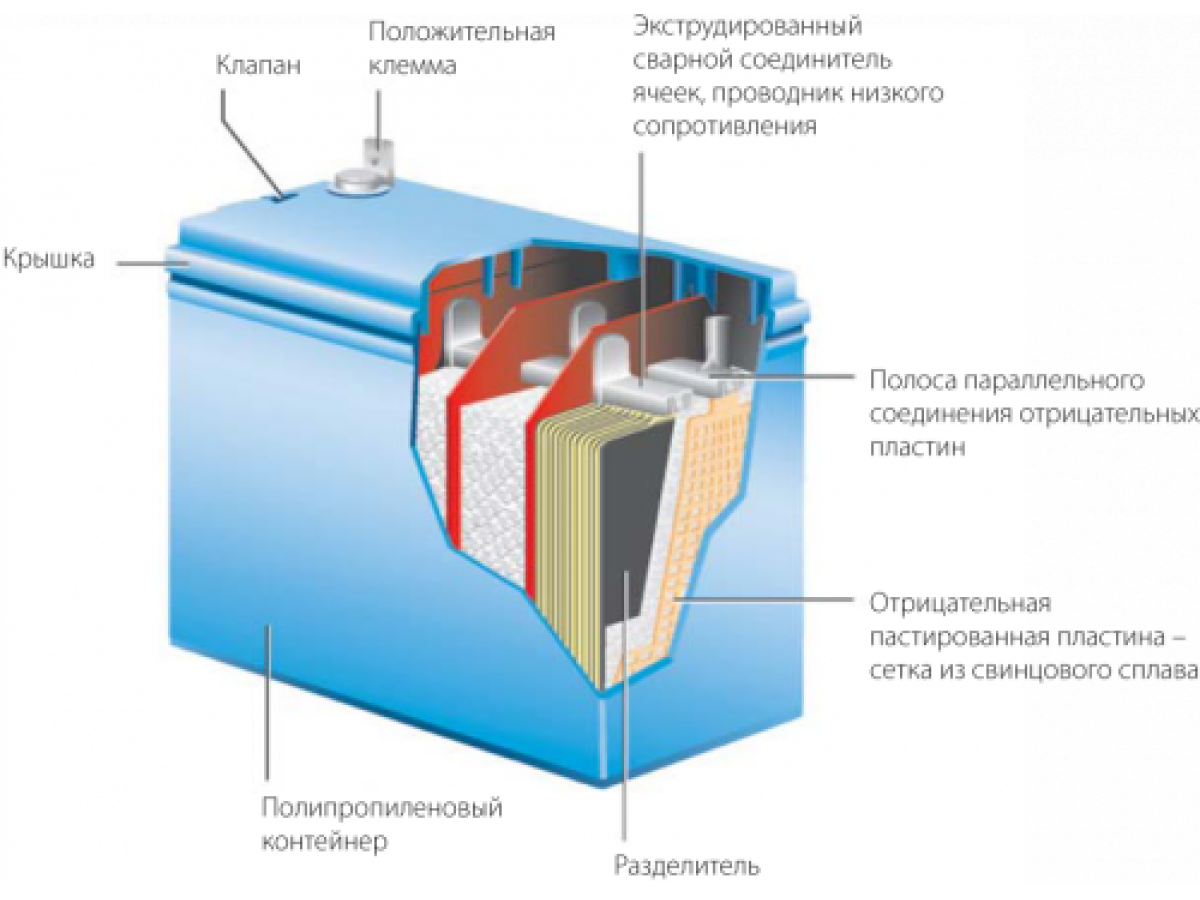 То есть минусовые и плюсовые клеммы потребителя и источника обязаны совпадать. Учтите, что обязательно должно обладать большей мощностью, чем есть в аккумуляторе, чтобы подавлять остатки энергии в нем и создавать электрический ток, направление которого будет противоположным разряду. В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.
То есть минусовые и плюсовые клеммы потребителя и источника обязаны совпадать. Учтите, что обязательно должно обладать большей мощностью, чем есть в аккумуляторе, чтобы подавлять остатки энергии в нем и создавать электрический ток, направление которого будет противоположным разряду. В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.
Давайте рассмотрим пример из предыдущего подпункта статьи. Здесь уже положительный электрод будет обогащаться кислородом, а на отрицательном восстановится чистый кадмий. Подводя итог, можно сказать, что во время заряда и разряда меняется только химический состав электродов. Это не относится к электролиту. Но он может испаряться, что негативно будет сказываться на времени работы батареи.
Итак, мы рассмотрели принцип работы любого аккумулятора. Теперь давайте узнаем, как во время эксплуатации можно улучшить их характеристики.
Параллельное соединение
Величина тока зависит от значительного количества факторов. В первую очередь под этим понимают конструкцию, применяемые материалы и их габариты. Чем большую площадь имеют электроды, тем большие показатели тока они смогут выдержать. Этот принцип используется для параллельного соединения однотипных банок в аккумуляторах. Такое делается, если необходимо увеличить значение тока, что идёт на нагрузку. Но вместе с этим приходится и поднимать мощность источника энергии.
В первую очередь под этим понимают конструкцию, применяемые материалы и их габариты. Чем большую площадь имеют электроды, тем большие показатели тока они смогут выдержать. Этот принцип используется для параллельного соединения однотипных банок в аккумуляторах. Такое делается, если необходимо увеличить значение тока, что идёт на нагрузку. Но вместе с этим приходится и поднимать мощность источника энергии.
Последовательное соединение
Если рассматривать банки, из которых состоят аккумуляторные батареи, то необходимо сказать, что они находятся, как правило, в одном корпусе. Подобный тип соединения используется, чтобы получить большие показатели напряжения с меньшими потерями.
Увидеть применение этой конструкции можно, разобрав автомобильные батареи, которые являются свинцово-кислотными. Стоит сказать, что этот тип применяется не только в устройстве автомобильного аккумулятора, это просто самый вероятный способ разобрать, как же работает подобный тип соединения. В таком случае необходимо позаботится о том, чтобы не было металлического контакта, а существовала надежная гальваническая связь через электролит. Но это только нужно понимать в отношении данного типа. В других случаях по-другому будет реализовываться поставленная задача соединения.
Но это только нужно понимать в отношении данного типа. В других случаях по-другому будет реализовываться поставленная задача соединения.
Типы аккумуляторных батарей
Они разнятся из-за своего предназначения, возможностей, реализации и материала. На данный момент современным производством освоен выпуск больше трех десятков типов, которые отличаются своим составом электродов, а также применяемым электролитом. Так, например, li-ion аккумуляторы могут похвастаться семейством из 12 известных моделей. Условно можно выделить следующие типы:
- Свинцово-кислотные.
- Литиевые.
- Никель-кадмиевые.
Это самые популярные представители. Но для понимания возможностей предлагаем ознакомиться со списком материалов, которые могут выступать в качестве электродов:
- железо;
- свинец;
- титан;
- литий;
- кадмий;
- кобальт;
- никель;
- цинк;
- ванадий;
- серебро;
- алюминий;
- ряд других элементов, которые, впрочем, встречаются очень редко.
Использование разных материалов влияет на получаемые выходные характеристики и, следовательно, на сферу применения. Так, к примеру, li-ion аккумуляторы применяются в компьютерных и мобильных устройствах. Тогда как никель-кадмиевые используются в качестве замены стандартных гальванических элементов. Теоретически все типы аккумуляторных батарей могут работать с любой нагрузкой. Вопрос только в том, насколько оправданным является такое применение.
Основные характеристики
Мы уже рассмотрели, что такое аккумуляторные батареи, устройство этих конструкций, из чего их делают. Теперь давайте сосредоточимся на том, что влияет на их эксплуатацию. Важными для нас характеристиками являются:
- Плотностью называют характеристику соотношения количества энергии к объему или весу аккумулятора.
- Емкостью именуют значение максимального заряда аккумулятора, которое он может отдать во время процесса разряда, пока не будет достигнуто наименьшее напряжение. Данный показатель выражается в ампер-часах или кулонах.
 Также может указываться энергетическая емкость. Она измеряется в ватт-часах или джоулях. Задача такой емкости — сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения.
Также может указываться энергетическая емкость. Она измеряется в ватт-часах или джоулях. Задача такой емкости — сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения. - Температурный режим оказывает влияние на электрические свойства аккумуляторной батареи. Когда есть серьезные отклонения от рекомендованного производителем диапазона эксплуатации, то существует высокая вероятность выхода источника питания из строя. Это объясняется тем, что холод и жара влияют на интенсивность протекания химических реакций, а также на внутреннее давление.
- Саморазрядом именуют потери емкости, которые происходят после заряда батареи, когда отсутствует нагрузка на клеммах. Во многом этот показатель зависит от конструктивного исполнения и может увеличиваться, если нарушилась изоляция.
Вот такие характеристики аккумуляторных батарей и предоставляют для нас наибольший интерес. Конечно, если придётся делать что-то новое и эксклюзивное, ранее невиданное, то может понадобиться и что-то ещё. Но это весьма маловероятно.
Устройство электродов
В качестве примера мы возьмём свинцовые пластины. Хотя таковыми они были раньше. Современные пластины изготавливаются из свинцово-кальциевого сплава. Благодаря этому достигается низкий уровень саморазряда батареи (50% емкости теряется за 18 месяцев). Также это позволяет экономно расходовать воду (всего 1 грамм на ампер-час).
Можно встретить и гибридную конструкцию, где, кроме свинца, в положительный электрод добавляется сурьма, а в отрицательный — кальций. Правда, в таких случаях имеется повышенный расход воды. Чтобы повысить стойкость к коррозийным процессам, добавляют олово или серебро.
Электроды изготавливаются с решетчатой структурой, их покрывают слоем активной массы. Принцип работы аккумуляторной батареи в немалой степени зависит от того, какой материал используется для пластин. Мы рассматриваем свинцовые, которые просты для изучения, но ориентироваться на них всегда не рекомендуем.
Электролит
Рассматриваем все те же свинцово-кислотные батареи. В качестве электролита, в который они помещаются, чаще всего выступает серная кислота. Она обладает определённой плотностью, которая может меняться в зависимости от В данном случае действует принцип: чем больше, тем выше. Со временем электролит улетучивается, и емкость аккумуляторной батареи падает. На сроке службы сказываются особенности эксплуатации (соблюдение техники безопасности). В батареях электролит может быть двух типов:
В качестве электролита, в который они помещаются, чаще всего выступает серная кислота. Она обладает определённой плотностью, которая может меняться в зависимости от В данном случае действует принцип: чем больше, тем выше. Со временем электролит улетучивается, и емкость аккумуляторной батареи падает. На сроке службы сказываются особенности эксплуатации (соблюдение техники безопасности). В батареях электролит может быть двух типов:
- жидким;
- в виде пропитанного специального материала.
На данный момент наиболее распространён первый тип.
Эксплуатация аккумуляторных батарей
Использование аккумуляторов можно наблюдать практически везде. Вспомните свои мобильные телефоны или источники для компьютеров. В качестве примера можно привести и обычный фонарик (современные образцы всё чаще изготавливаются со встроенным аккумулятором и не рассчитаны на гальванические элементы). А автомобили? Системы «стоп-старт» и рекуперативного торможения работают от аккумуляторов, причем они выдвигают высокие требования к пусковому току, глубокому разряду и долговечности. Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.
Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.
Схема построения аккумуляторной батареи
Мы рассмотрели основную информацию о данных устройствах. Давайте ещё уделим внимание такому понятию, как схема аккумуляторной батареи. Ведь в рамках статьи по нему прошлись только вскользь. Аккумулятор современной схемы, согласно истории, был впервые создан французским физиком Гастоном Плантом. Площадь его творения превышала 10 квадратных метров! Современные батареи, по сути, являются просто значительно уменьшенными и немного доработанными копиями его аккумулятора. Видимым для человека элементом является только корпус. Он обеспечивает общность и целостность конструкции.
Будущее: Наука и техника: Lenta.ru
1
1
Международный коллектив ученых объявил о создании первого в мире комбинированного аккумулятора
В конце сентября международный коллектив ученых под руководством ученого Даррена Хана и с участием инженеров LG рассказал о создании первого комбинированного аккумулятора для автомобилей на электрической тяге.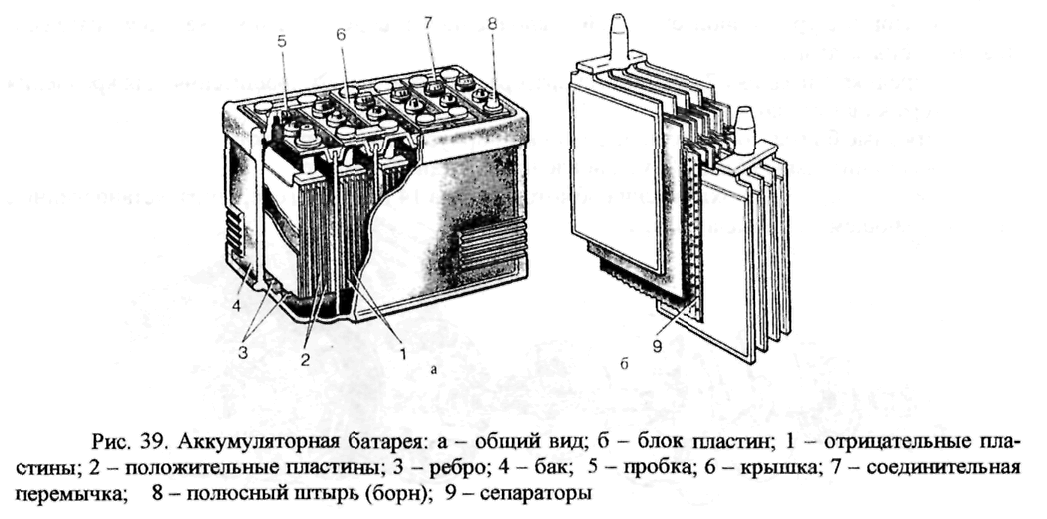 Подобная батарея является твердотельной и построена на базе анода из чистого кремния. По сравнению с аналогами новый аккумулятор является более энергоемким и безопасным и, кажется, превосходит все конкурентные образцы. «Лента.ру» объясняет, почему все автопроизводители не могут перейти на твердотельные батареи и какие перспективы есть у нового комбинированного аккумулятора.
Подобная батарея является твердотельной и построена на базе анода из чистого кремния. По сравнению с аналогами новый аккумулятор является более энергоемким и безопасным и, кажется, превосходит все конкурентные образцы. «Лента.ру» объясняет, почему все автопроизводители не могут перейти на твердотельные батареи и какие перспективы есть у нового комбинированного аккумулятора.
2
2
Несовершенство литий-ионных батарей давно волновало инженеров
Используемые в современных электрокарах батареи неидеальны. Как правило, автопроизводители используют литий-ионные зарядные элементы. Несмотря на то что аккумуляторы позволяют хранить энергию длительное время и обеспечивать машины запасом хода на полтысячи миль, проблем с ними слишком много. Во-первых, батареи быстро изнашиваются. Во-вторых, они очень капризны: требовательны к температуре эксплуатации и не переносят постоянных или сильных вибраций. Именно поэтому при ДТП электрокар может загореться, а на тушение и локализацию возгорания может уйти несколько часов.
Также почти все батареи — начиная от элементов в пультах к телевизорам и заканчивая фабричными аккумуляторами — состоят из кобальта. Зависимость индустрии от этого материала крайне высока, так как 60 процентов всего кобальта добывают в Демократической Республике Конго.
В теории твердотельные батареи как минимум практичнее и безопаснее. Их конструкция предполагает использование минимума материалов. По словам ученых, чем меньше в аккумуляторе деталей, тем реже он будет ломаться и выходить из строя.
3
3
Батареи с кремниевыми анодами тоже неидеальны
Использование кремниевого анода в батареях позитивно описывается Дарреном Ханом и его коллегами. Впервые данную наработку описали в 2002 году. Спустя почти 13 лет основатель Tesla Илон Маск заявил, что применение кремния в аккумуляторах его электрокаров увеличивает запас хода примерно на шесть процентов. Батареи на основе кремния обычно имеют гораздо большую удельную емкость, чем другие, — примерно 3600 миллиампер-часов на грамм материала.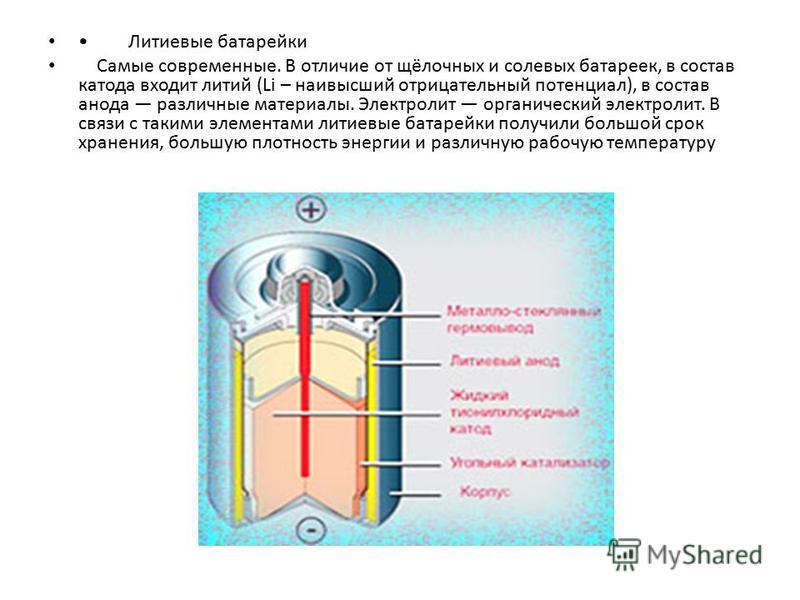
Однако в заряженном состоянии данный тип анода в больших долях является крайне неустойчивым, а следовательно, опасным для применения. При длительном контакте с жидким электролитом кремний плохо держит энергию, что оборачивается значительной потерей мощности электрического двигателя. Поэтому современные аккумуляторы состоят из кремния лишь частично. В этой связи аноды коммерческих батарей могут содержать небольшое количество кремния, что весьма незначительно влияет на производительность. Например, на рынке существуют аккумуляторы, созданные на базе композитного электрода с кремниевой нанопроволокой. Информация о содержании этого материала в батареях производителей обычно не раскрывается, но можно считать, что доля кремния в них не превышает десяти процентов.
4
4
Преимущество кремния
Учитывая все недостатки батарей на базе классического электролита и кремния, ученые решили синтезировать материал с твердым электролитом на основе сульфида. Использование твердой структуры решило проблему насыщения анодов жидким электролитом во время работы. По словам Хана, отсутствие углерода в аноде значительно снижает межфазный контакт, что приводит к нежелательным побочным реакциям с твердым электролитом.
По словам Хана, отсутствие углерода в аноде значительно снижает межфазный контакт, что приводит к нежелательным побочным реакциям с твердым электролитом.
Сравнительные тесты показали, что кремниевые аноды имеют в десять раз большую плотность энергии, чем графитовые. Пока что новое изобретение удалось воссоздать лишь в лабораторных условиях, но характеристики новой батареи удовлетворяют специалистов. Аккумулятор-прототип сохранил 80 процентов емкости после 500 циклов зарядки, удельная емкость энергии на грамм кремния составила около 2890 миллиампер-часов. Батарея оказалась стабильна и безопасна, что в будущем наверняка позволит использовать ее несколько десятков лет. По словам ученых, аккумуляторы нового типа смогут пережить сам автомобиль.
5
5
Чего ждать в будущем?
«Принцип твердотельного кремния преодолевает многие ограничения обычных батарей», — говорится в отчете изобретателей. Ученые считают, что созданные по комбинированному принципу аккумуляторы удовлетворят рыночный спрос на безопасные батареи с более высокой емкостью при более низких затратах. Ноу-хау можно использовать при создании как электрокаров, так и стационарных энергохранилищ.
Ноу-хау можно использовать при создании как электрокаров, так и стационарных энергохранилищ.
Как было замечено, удачный прототип батареи пока был создан в лабораторных условиях и тестировался при комнатной температуре. Комфортная для аккумулятора работа происходит при температуре около 140 градусов по Фаренгейту (порядка 60 градусов по Цельсию). Даррен Хан признает, что от прототипа до первого коммерческого образца могут пройти годы, и соглашается со скептиками, что его коллегам предстоит много работы. Однако ученый уже зарегистрировал бренд Unigrid battery, под которым надеется выйти на рынок твердотельных аккумуляторов нового поколения.
О «кремниевой революции» все чаще говорят и крупные игроки на рынке электромобилей. Например, в 2020 году представители Tesla обнадежили потребителей и рынок, что планируют удвоить содержание кремния в батареях своих автомобилей.
Андрей Ставицкий
Виды и типы аккумуляторных батарей — подробно!
- Категория: Поддержка по аккумуляторным батареям
- Опубликовано 25.
 06.2015 19:00
06.2015 19:00 - Автор: Abramova Olesya
Аккумуляторная батарея – это источник постоянного тока, который предназначен для накопления и хранения энергии. Подавляющее число типов аккумуляторных батарей основано на циклическом преобразовании химической энергии в электрическую, это позволяет многократно заряжать и разряжать батарею.
Еще в 1800 году Алессандро Вольта произвел поразительное открытие, когда опустил в банку, наполненную кислотой, две металлические пластины – медную и цинковую, после чего доказал, что по соединяющей их проволоке протекает электрический ток. Спустя более чем 200 лет, современные аккумуляторные батареи продолжают производить на основе открытия Вольта.
|
Рисунок 1. Вольтов столб из шести элементов. |
Рисунок 2. Алессандро Джузеппе Антонио Анастасио Вольта |
Со времени изобретения первого аккумулятора прошло не больше 140 лет и сейчас сложно представить современный мир без резервных источников питания на основе батарей.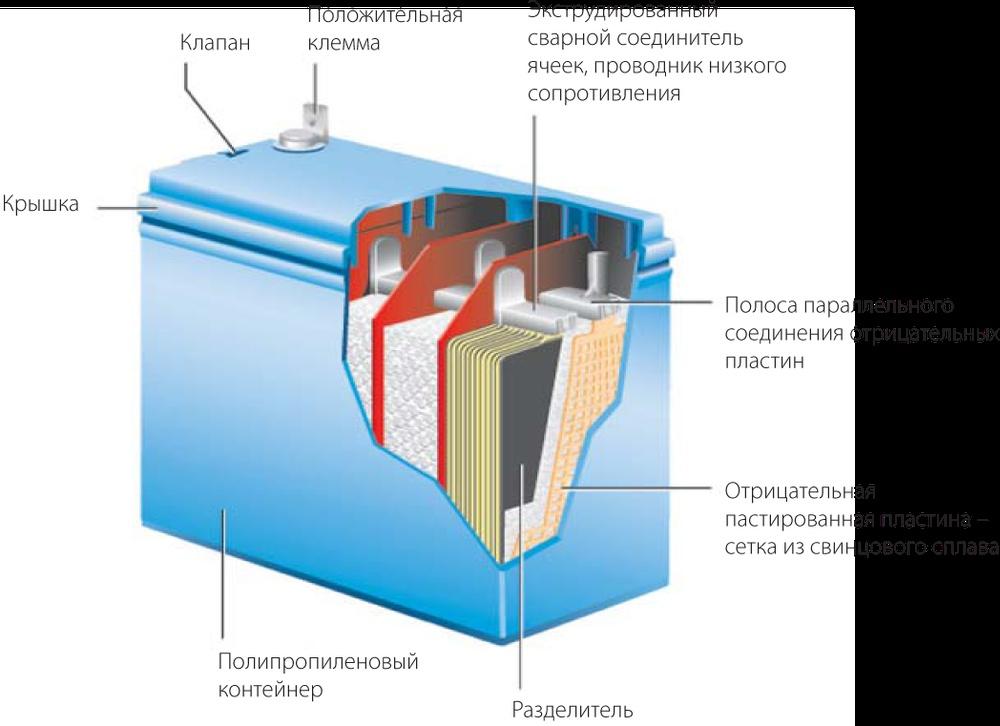 Аккумуляторы применяются всюду, начиная с самых безобидных бытовых устройств: пульты управления, переносные радиоприемники, фонари, ноутбуки, телефоны, и заканчивая системами безопасности финансовых учреждений, резервными источниками питания для центров хранения и передачи данных, космической отраслью, атомной энергетикой, связью и т. д.
Аккумуляторы применяются всюду, начиная с самых безобидных бытовых устройств: пульты управления, переносные радиоприемники, фонари, ноутбуки, телефоны, и заканчивая системами безопасности финансовых учреждений, резервными источниками питания для центров хранения и передачи данных, космической отраслью, атомной энергетикой, связью и т. д.
Развивающийся мир нуждается в электрической энергии столь сильно, сколько человеку нужен кислород для жизни. Поэтому конструкторы и инженеры ежедневно ведут работу по оптимизации имеющихся типов аккумуляторов и периодически разрабатывают новые виды и подвиды.
Основные виды аккумуляторов приведены в таблице №1.
|
Тип |
Применение |
Обозначение |
Рабочая температура, ºC |
Напряжение элемента, В |
Удельная энергия, Вт∙ч/кг |
|
Литий-ионный (Литий-полимерный, литий-марганцевый, литий-железно-сульфидный, литий-железно-фосфатный, литий-железо-иттрий-фосфатный, литий-титанатный, литий-хлорный, литий-серный) |
Транспорт, телекоммуникации, системы солнечной энергии, автономное и резервное электроснабжение, Hi-Tech, мобильные источники питания, электроинструмент, электромобили и т. |
Li-Ion (Li-Co, Li-pol, Li-Mn, LiFeP, LFP, Li-Ti, Li-Cl, Li-S) |
-20 … +40 |
3,2-4,2 |
280 |
|
никель-солевой |
Автомобильный транспорт, Ж\Д транспорт, Телекоммуникации, Энергетика, в том числе альтернативная, Системы накопления энергии |
Na/NiCl |
-50 … +70 |
2,58 |
140 |
|
никель-кадмиевый |
Электрокары, речные и морские суда, авиация |
Ni-Cd |
–50 … +40 |
1,2-1,35 |
40 – 80 |
|
железо-никелевый |
Резервное электропитание, тяговые для электротранспорта, цепи управления |
Ni-Fe |
–40 … +46 |
1,2 |
100 |
|
никель-водородный |
Космос |
Ni-h3 |
|
1,5 |
75 |
|
никель-металл-гидридный |
электромобили, дефибрилляторы, ракетно-космическая техника, системы автономного энергоснабжения, радиоаппаратура, осветительная техника. |
Ni-MH |
–60 … +55 |
1,2-1,25 |
60 – 72 |
|
никель-цинковый |
Фотоаппараты |
Ni-Zn |
–30 … +40 |
1,65 |
60 |
|
свинцово-кислотный |
Системы резервного питания, бытовая техника, ИБП, альтернативные источники питания, транспорт, промышленность и т.д. |
Pb |
–40 … +40 |
2, 11-2,17 |
30 – 60 |
|
серебряно-цинковый |
Военная сфера |
Ag-Zn |
–40 … +50 |
1,85 |
<150 |
|
серебряно-кадмиевый |
Космос, связь, военные технологии |
Ag-Cd |
–30 … +50 |
1,6 |
45 – 90 |
|
цинк-бромный |
|
Zn-Br |
|
1,82 |
70 – 145 |
|
цинк-хлорный |
|
Zn-Cl |
–20 … +30 |
1,98-2,2 |
160 – 250 |
Таблица №1. Классификация аккумуляторных батарей.
Классификация аккумуляторных батарей.
Исходя из приведенных данных в таблице №1, можно прийти к выводу, что существует достаточно много видов аккумуляторов, отличных по своим характеристикам, которые оптимизированы для применения в разнообразных условиях и с различной интенсивностью. Применяя для производства новые технологии и компоненты, ученым удается достигать нужных характеристик для конкретной области применения, к примеру, для космических спутников, космических станций и другого космического оборудования были разработаны никель-водородные аккумуляторы. Конечно, в таблице приведены далеко не все типы, а лишь основные, которые получили распространение.
Современные системы резервного и автономного электропитания для промышленного и бытового сегмента основаны на разновидностях свинцово-кислотных, никель-кадмиевых (реже применяются железо-никелевый тип) и литий-ионных аккумуляторах, поскольку эти химические источники питания безопасны и имеют приемлемые технические характеристики и стоимость.
Свинцово-кислотные аккумуляторные батареи
Этот тип является самым востребованным в современном мире по причине универсальных особенностей и невысокой стоимости. Благодаря наличию большого количества разновидностей, свинцово-кислотные аккумуляторы применяется в областях систем резервного питания, системах автономного электроснабжения, солнечных электростанций, ИБП, различных видах транспорта, связи, системах безопасности, различных видах портативных устройств, игрушках и т. д.
Принцип действия свинцово-кислотных батарей
Основа работы химических источников питания основана на взаимодействии металлов и жидкости – обратимой реакции, которая возникает при замыкании контактов положительных и отрицательных пластин. Свинцово-кислотные аккумуляторы, как понятно из названия, состоят из свинца и кислоты, где положительно заряженными пластинами является свинец, а отрицательно заряженными – оксид свинца. Если подключить к двум пластинам лампочку, цепь замкнется и возникнет электрический ток (движение электронов), а внутри элемента возникнет химическая реакция. В частности, происходит коррозия пластин батареи, свинец покрывается сульфатом свинца. Таким образом, в процессе разряда аккумулятора на всех пластинах будет образовываться налет из сульфата свинца. Когда аккумулятор полностью разряжен, его пластины покрыты одинаковым металлом – сульфатом свинца и имеют практически одинаковый заряд относительно жидкости, соответственно, напряжение батареи будет очень низким.
Если к батарее подключить зарядное устройство к соответствующим клеммам и включить его, ток будет протекать в кислоте в обратном направлении. Ток будет вызывать химическую реакцию, молекулы кислоты – расщепляться и за счет этой реакции будет происходить удаление сульфата свинца с положительных и отрицательных пластилин батареи. В финальной стадии зарядного процесса пластины будут иметь первозданный вид: свинец и оксид свинца, что позволит им снова получить разный заряд, т. е. батарея будет полностью заряжена.
Однако на практике все выглядит немного иначе и пластины электродов очищаются не полностью, поэтому аккумуляторы имеют определенный ресурс, по достижении которого емкость снижается до 80-70% от изначальной.
Рисунок №3. Электрохимическая схема свинцово-кислотного аккумулятора (VRLA).
Типы свинцово-кислотных батарей
-
Lead–Acid, обслуживаемые – 6, 12В батареи. Классические стартерные аккумуляторы для двигателей внутреннего сгорания и не только. Нуждаются в регулярном обслуживании и вентиляции. Подвержены высокому саморазряду.
-
Valve Regulated Lead–Acid (VRLA), необслуживаемые – 2, 4, 6 и 12В батареи. Недорогие аккумуляторы в герметизированном корпусе, которые можно использовать в жилых помещениях, не требуют дополнительной вентиляции и обслуживания. Рекомендованы для использования в буферном режиме.
-
Absorbent Glass Mat Valve Regulated Lead–Acid (AGM VRLA), необслуживаемые – 4, 6 и 12В батареи. Современные аккумуляторы свинцово-кислотного типа с абсорбированным электролитом (не жидкий) и стекловолоконными разделительными сепараторами, которые значительно лучше сохраняют свинцовые пластины, не давая им разрушаться. Такое решение позволило значительно снизить время заряда AGM батарей, поскольку зарядный ток может достигать 20-25, реже 30% от номинальной емкости.
Аккумуляторы AGM VRLA имеют множество модификаций с оптимизированными характеристиками для циклического и буферного режимов работы: Deep – для частых глубоких разрядов, фронт-терминальные – для удобного расположения в телекоммуникационных стойках, Standard – общего назначения, High Rate – обеспечивают лучшую разрядную характеристику до 30% и подходят для мощных источников бесперебойного питания, Modular – позволяют создавать мощные батарейные кабинеты и т. д.
Рисунок №4. AGM VRLA аккумуляторы EverExceed.
-
GEL Valve Regulated Lead–Acid (GEL VRLA), необслуживаниемые – 2, 4, 6 и 12В батареи. Одна из последних модификаций свинцово-кислотного типа аккумуляторов. Технология основана на применение гелеобразного электролита, который обеспечивает максимальный контакт с отрицательными и положительными пластинами элементов и сохраняет однообразную консистенцию по всему объему. Данный тип аккумуляторов требует «правильного» зарядного устройства, которое обеспечит требуемый уровень тока и напряжения, лишь в этом случае можно получить все преимущества по сравнению с AGM VRLA типом.
Химические источники питания GEL VRLA, как и AGM, имеют множество подвидов, которые наилучшим образом подходят для определенных режимов работы. Самыми распространенными являются серии Solar – используются для систем солнечной энергии, Marine – для морского и речного транспорта, Deep Cycle – для частых глубоких разрядов, фронт-терминальные – собраны в специальных корпусах для телекоммуникационных систем, GOLF – для гольф-каров, а также для поломоечных машин, Micro – небольшие аккумуляторы для частого использования в мобильных приложениях, Modular – специальное решение по созданию мощных аккумуляторных банков для накопления энергии и т. д.
Рисунок №5. GEL VRLA аккумулятор EverExceed.
-
OPzV, необслуживаемые – 2В батареи. Специальные свинцово-кислотные элементы типа OPZV произведены с применением трубчатых пластин анода и сернокислотным гелеобразным электролитом. Анод и катод элементов содержат дополнительный металл – кальций, благодаря которому повышается стойкость электродов к коррозии и увеличивается срок службы. Отрицательные пластины – намазные, эта технология обеспечивает лучший контакт с электролитом.
Аккумуляторы OPzV устойчивы к глубоким разрядам и обладают длительным сроком службы до 22 лет. Как правило, для изготовления подобных элементов питания применяются только лучшие материалы, чтобы обеспечить высокую эффективность работы в циклическом режиме.
Применение OPzV аккумуляторов востребовано в телекоммуникационных установках, системах аварийного освещения, источниках бесперебойного питания, системах навигации, бытовых и промышленных системах накопления энергии и солнечной электрогенерации.
Рисунок №6. Строение OPzV аккумулятора EverExceed. -
OPzS, малообслуживаемые – 2, 6, 12В батареи. Стационарные заливные свинцово-кислотные аккумуляторы OPzS производятся с трубчатыми пластинами анода с добавлением сурьмы. Катод также содержит небольшое количество сурьмы и представляет собой намазной решетчатый тип. Анод и катод разделены микропористыми сепараторами, которые предотвращают короткое замыкание. Корпус аккумуляторов выполнен из специального ударопрочного, устойчивого к химическому воздействию и огню прозрачного пластика, а вентилируемые клапаны относятся к пожаробезопасному типу и обеспечивают защиту от возможного попадания пламени и искр.
Прозрачные стенки позволяют удобно контролировать уровень электролита при помощи отметок минимального и максимального значения. Специальная структура клапанов дает возможность без их снятия доливать дистиллированную воду и промерять плотность электролита. В зависимости от нагрузки, долив воды осуществляется раз в один – два года.
Аккумуляторные батареи типа OPzS обладают самыми высокими характеристиками среди всех других видов свинцово-кислотных батарей. Срок службы может достигать 20 – 25 лет и обеспечивать ресурс до 1800 циклов глубокого 80% разряда.
Применение подобных батарей необходимо в системах с требованиями среднего и глубокого разряда, в т.ч. где наблюдаются пусковые токи средней величины.
Рисунок №7. OPzS аккумулятор Victron Energy.
Характеристики свинцово-кислотных аккумуляторов
Анализируя приведенные в таблице №2 данные, можно прийти к выводу, что свинцово-кислотные аккумуляторы обладают широким выбором моделей, которые подходят для различных режимов работы и условий эксплуатации.
|
Тип |
LA |
VRLA |
AGM VRLA |
GEL VRLA |
OPzV |
OPzS |
|
Емкость, Ампер/час |
10 – 300 |
1 – 300 |
1 – 3000 |
1 – 3000 |
50 – 3500 |
50 – 3500 |
|
Напряжение, Вольт |
6, 12 |
4, 6, 12 |
2, 4, 6, 12 |
2, 6, 12 |
2 |
2 |
|
Оптимальная глубина разряда, % |
|
30 |
<40 |
<50 |
<60 |
<60 |
|
Допустимая глубина разряда, % |
|
<75 |
<80 |
<90 |
<90 |
<100 |
|
Циклический ресурс, D.O.D.=50% |
|
<250-300 |
<1000 |
<1400 |
<3200 |
<3300 |
|
Оптимальная температура, °С |
0 … +45 |
+15 … +25 |
+10 … +25 |
+10 … +25 |
0 … +30 |
0 … +30 |
|
Диапазон рабочих температур, °С |
–50 … +70 |
–35 … +60 |
–40 … +70 |
–40 … +70 |
–40 … +70 |
–40 … +70 |
|
Срок службы, лет при +20°С |
<7 |
<7 |
5 – 15 |
8 – 15 |
15 – 20 |
17 – 25 |
|
Саморазряд, % |
3 – 5 |
2 – 3 |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
|
Макс. ток заряда, % от емкости |
10 – 20 |
20 – 25 |
20 – 30 |
15 – 20 |
15 – 20 |
10 – 15 |
|
Минимальное время заряда, ч |
8 – 12 |
6 – 10 |
6 – 10 |
8 – 12 |
10 – 14 |
10 – 15 |
|
Требования к обслуживанию |
3 – 6 мес. |
нет |
нет |
нет |
нет |
1 – 2 года |
|
Средняя стоимость, $, 12В/100Ач. |
70 – 150 |
200 – 250 |
250 – 380 |
350 – 500 |
1000 – 1400 |
1500 – 3500 |
Таблица №2. Сравнительные характеристики по видам свинцово-кислотных батарей.
Для анализа использовались усредненные данные более чем 10-ти производителей батарей, продукция которых представлена на рынке Украины в течение длительного времени и успешно применяется во многих областях (EverExceed, B.B. Battery, CSB, Leoch, Ventura, Challenger, C&D Techologies, Victron Energy, SunLight, Troian и другие).
Литий-ионные (литиевые) аккумуляторные батареи
История прохождения происхождения уходит в 1912 год, когда Гилберт Ньютон Льюис работал над вычислением активностей ионов сильных электролитов и проводил исследования электродных потенциалов целого ряда элементов, включая литий. С 1973 года работы были возобновлены и в результате появились первые элементы питания на основе лития, которые обеспечивали только один цикл разряда. Попытки создать литиевый аккумулятор затруднялись активностью свойств лития, которые при неправильных режимах разряда или заряда вызывали бурную реакцию с выделением высокой температуры и даже пламени. Компания Sony выпустила первые мобильные телефоны с подобными аккумуляторами, но была вынуждена отозвать продукцию обратно после нескольких неприятных инцидентов. Разработки не прекращались и в 1992 году появились первые «безопасные» аккумуляторы на основе ионов лития.
Аккумуляторы литий-ионного типа обладают высокой плотностью энергии и благодаря этому при компактном размере и легком весе обеспечивают в 2-4 раза большую емкость по сравнению со свинцово-кислотными аккумуляторами. Несомненно, большим достоинством литий-ионных батарей является высокая скорость полной 100% перезарядки в течение 1-2 часов.
Li-ion батареи получили широкое применение в современной электронной технике, автомобилестроении, системах накопления энергии, солнечной генерации электроэнергии. Крайне востребованы в высокотехнологичных устройствах мультимедиа и связи: телефонах, планшетных компьютерах, ноутбуках, радиостанциях и т. д. Современный мир сложно представить без источников питания литий-ионного типа.
Принцип действия литиевых (литий-ионных) батарей
Принцип работы заключается в использовании ионов лития, которые связаны молекулами дополнительных металлов. Обычно, в дополнение к литию применяются литийкобальтоксид и графит. При разряде литий-ионного аккумулятора происходит переход ионов от отрицательного электрода (катода) к положительному (аноду) и наоборот при заряде. Схема аккумулятора предполагает наличие разделительного сепаратора между двумя частями элемента, это необходимо для предотвращения самопроизвольного перемещения ионов лития. Когда цепь аккумулятора замкнута и происходит процесс заряда или разряда, ионы преодолевают разделительный сепаратор стремясь к противоположно заряженному электроду.
Рисунок №8. Электрохимическая схема литий-ионного аккумулятора.
Благодаря своей высокой эффективности, литий-ионные аккумуляторы получили бурное развитие и множество подвидов, например, литий-железо-фосфатные аккумуляторы (LiFePO4). Ниже приведена графическая схема работы этого подтипа.
Рисунок №9. Электрохимическая схема процесса разряда и разряда LiFePO4 батареи.
Типы литий-ионных аккумуляторов
Современные литий-ионные аккумуляторы имеют множество подтипов, основная разница которых заключается в составе катода (отрицательно заряженного электрода). Также может изменяться состав анода для полной замены графита или использования графита с добавлением других материалов.
Различные виды литий-ионных аккумуляторов обозначаются по их химическому разложению. Для рядового пользователя это может быть несколько сложно, поэтому каждый тип будет описан максимально подробно, включая его полное название, химическое определение, аббревиатуру и краткое обозначение. Для удобства описания будет использоваться сокращенное название.
-
Литий кобальт оксид (LiCoO2) – Обладает высокой удельной энергией, что делает литий-кобальтовый аккумулятор востребованным в компактных высокотехнологичных устройствах. Катод батареи состоит из оксида кобальта, тогда как анод – из графита. Катод имеет слоистую структуру и во время разряда ионы лития перемещаются от анода к катоду. Недостатком этого типа является относительно короткий срок службы, невысокая термическая стабильность и лимитированная мощность элемента.
Литий-кобальтовые батареи не могут разряжаться и заряжаться током, превосходящим номинальную емкость, поэтому аккумулятор с емкостью 2,4Ач может работать с током 2,4А. Если для заряда будет применяться большая сила тока, то это вызовет перегрев. Оптимальный зарядный ток составляет 0,8C, в данном случае 1,92А. Каждый литий-кобальтовый аккумулятор комплектуется схемой защиты, которая ограничивает заряд и скорость разряда и лимитирует ток на уровне 1C.
На графике (Рис. 10) отражены основные свойства литий-кобальтовых аккумуляторов с точки зрения удельной энергии или мощности, удельная мощность или способность обеспечивать высокий ток, безопасности или шансы воспламенения при высокой нагрузке, рабочая температура окружающей среды, срок службы и циклический ресурс, стоимость.
Рисунок №10. Диаграмма основных свойств LiCoO2 аккумуляторов.
-
Литий Оксид Марганца (LiMn2O4, LMO) – первая информация об использовании лития с марганцевыми шпинелями была опубликована в научных докладах 1983 года. Компания Moli Energy в 1996 году выпустила первые партии аккумуляторов на основе литий-оксид-марганца в качестве материала катода. Такая архитектура формирует трехмерные структуры шпинели, что улучшает поток ионов к электроду, тем самым снижая внутреннее сопротивление и повышая возможные токи заряда. Также преимущество шпинели в термической стабильности и повышенной безопасности, однако циклический ресурс и срок службы ограничен.
Низкое сопротивление обеспечивает возможность быстрого заряда и разряда литий-марганцевого аккумулятора с высоким током до 30А и кратковременно до 50А. Применяется для мощных электроинструментов, медицинского оборудования, а также гибридных и электрических транспортных средств.
Потенциал литий-марганцевых аккумуляторов примерно на 30% ниже по сравнению с литий-кобальтовыми батареями, однако эта технология обладает примерно на 50% лучшими свойствами, чем аккумуляторы на основе никелевых химических компонентов.
-
Литий Оксид Марганца (LiMn2O4, LMO) – первая информация об использовании лития с марганцевыми шпинелями была опубликована в научных докладах 1983 года. Компания Moli Energy в 1996 году выпустила первые партии аккумуляторов на основе литий-оксид-марганца в качестве материала катода. Такая архитектура формирует трехмерные структуры шпинели, что улучшает поток ионов к электроду, тем самым снижая внутреннее сопротивление и повышая возможные токи заряда. Также преимущество шпинели в термической стабильности и повышенной безопасности, однако циклический ресурс и срок службы ограничен.
Низкое сопротивление обеспечивает возможность быстрого заряда и разряда литий-марганцевого аккумулятора с высоким током до 30А и кратковременно до 50А. Применяется для мощных электроинструментов, медицинского оборудования, а также гибридных и электрических транспортных средств.
Потенциал литий-марганцевых аккумуляторов примерно на 30% ниже по сравнению с литий-кобальтовыми батареями, однако эта технология обладает примерно на 50% лучшими свойствами, чем аккумуляторы на основе никелевых химических компонентов.
Гибкость конструкции позволяет инженерам оптимизировать свойства батареи и достичь длительного срока службы, высокой емкости (удельная энергия), возможности обеспечивать максимальный ток (удельная мощность). Например, с длительным сроком эксплуатации типоразмер элемента 18650 имеет емкость 1,1Ач, тогда как элементы, оптимизированные на повышенную емкость, – 1,5Ач, но при этом они имеют меньший срок службы.
На графике (Рис. 12) отраженны не самые впечатляющие характеристики литий-марганцевых аккумуляторов, однако современные разработки позволили существенно повысить эксплуатационных характеристики и сделать этот тип конкурентным и широко применяемым.
Рисунок №11. Диаграмма основных свойств LiMn2O4 аккумуляторов.
Современные аккумуляторы литий-марганцевого типа могут производиться с добавлениями других элементов – литий-никель-марганец-кобальт оксид (NMC), подобная технология существенно продлевает срок службы и повышает показатели удельной энергии. Этот состав привносит лучшие свойства из каждой системы, так называемые LMO (NMC) применяются для большинства электромобилей, таких как Nissan, Chevrolet, BMW и т. д.
-
Литий-Никель-Марганец-Кобальт оксид (LiNiMnCoO2 или NMC) – ведущие производители литий-ионных батарей сосредоточились на сочетании никеля-марганца-кобальта в качестве материалов катода (NMC). Похожий на литий-марганцевый тип, эти аккумуляторы могут быть адаптированы для достижения показателей высокой удельной энергии или высокой удельной мощности, однако, не одновременно. К примеру, элемент NMC типа 18650 в состоянии умеренной нагрузки имеет емкость 2,8Ач и может обеспечить максимальный ток 4-5А; NMC элемент, оптимизированный к параметрам повышенной мощности, имеет всего 2Втч, но может обеспечить непрерывный ток разряда до 20А. Особенность NMC заключается в сочетании никеля и марганца, в качестве примера можно привести поваренную соль, в которой основные ингредиенты натрий и хлорид, которые в отдельности являются токсичными веществами.
Никель известен своей высокой удельной энергией, но низкой стабильностью. Марганец имеет преимущество формирования структуры шпинели и обеспечивает низкое внутреннее сопротивление, но при этом обладает низкой удельной энергией. Комбинируя эти два металла, можно получать оптимальные характеристика NMC аккумулятора для разных режимов эксплуатации.
NMC аккумуляторы прекрасно подходят для электроинструмента, электровелосипедов и других силовых агрегатов. Сочетание материалов катода: треть никеля, марганца и кобальта обеспечивают уникальные свойства, а также снижают стоимость продукта в связи с уменьшением содержания кобальта. Другие подтипы, как NCM, CMN, CNM, MNC и MCN имеют отличное соотношение тройки металлов от 1/3-1/3-1/3. Обычно, точное соотношение держится производителем в секрете.
Рисунок №12. Диаграмма основных свойств LiNiMnCoO2 аккумуляторов.
-
Литий-Железо-Фосфатные (LiFePO4) – в 1996 в университете штата Техас (и другими участниками) был применен фосфат в качестве катодного материала для литиевых аккумуляторов. Литий-фосфат предлагает хорошие электрохимические характеристики с низким сопротивлением. Это стало возможным с нано-фосфатом материала катода. Основными преимуществами являются высокий протекающий ток и длительный срок службы к тому же, хорошая термическая стабильность и повышенная безопасность.
Литий-железо-фосфатные аккумуляторы терпимее к полному разряду и менее подвержены «старению», чем другие литий-ионные системы. Также LFP более устойчивы к перезаряду, но как и в других аккумуляторах литий-ионного типа, перезаряд может вызвать повреждение. LiFePO4 обеспечивает очень стабильное напряжение разряда – 3,2В, это же позволяет использовать всего 4 элемента для создания батареи стандарта 12В, что в свою очередь позволяет эффективно заменять свинцово-кислотные батареи. Литий-железо-фосфатные аккумуляторы не содержат кобальт, это существенно снижает стоимость продукта и делает его более экологически чистым. В процессе разряда обеспечивает высокий ток, а также может быть заряжен номинальным током всего за один час до полной емкости. Эксплуатация при низких температурах окружающей среды снижает производительность, а температура свыше 35ºС – несколько сокращается срок службы, но показатели намного лучше, чем у свинцово-кислотных, никель-кадмиевых или никель-металлогидридных аккумуляторов. Литий-фосфат имеет больший саморазряд, чем другие литий-ионные аккумуляторы, которые могут вызвать потребность балансировки батарейных кабинетов.
Рисунок №13. Диаграмма основных свойств LiFePO4 аккумуляторов.
-
Литий-Никель-Кобальт-Оксид Алюминия (LiNiCoAlO2) – литий-никель-кобальто-оксид алюминиевые батареи (NCA) появились в 1999 году. Этот тип обеспечивает высокую удельную энергию и достаточную удельную мощность, а также длительный срок службы. Однако существуют риски воспламенения, в следствие чего был добавлен алюминий, который обеспечивает более высокую стабильность электрохимических процессов, протекающих в аккумуляторе при высоких токах разряда и заряда.
Рисунок №14. Диаграмма основных свойств LiNiCoAlO2 аккумуляторов.
-
Литий-титанат (Li4Ti5O12) – аккумуляторы с анодами из литий-титаната были известны с 1980-х годов. Катод состоит из графита и имеет сходство с архитектурой типичной литий-металлической батареи. Литий-титанат имеет напряжение элемента 2,4В, может быть быстро заряжен и обеспечивает высокий разрядный ток 10C, который в 10 раз превышает номинальную емкость батареи.
Литий-титанатные аккумуляторы отличаются повышенным циклическим ресурсом по сравнению с другими Li-ion видами батарей. Обладают высокой безопасностью, а также способны работать при низких температурах (до –30ºC) без ощутимого снижения рабочих характеристик.
Недостаток заключается в достаточно высокой стоимости, а также в небольшом показателе удельной энергии, порядка 60-80Втч/кг, что вполне сопоставимо с никель-кадмиевыми аккумуляторами. Области применения: электрические силовые агрегаты и источники бесперебойного питания.
Рисунок №15. Диаграмма основных свойств Li4Ti5O12 аккумуляторов.
-
Литий-полимерные аккумуляторы (Li-pol, Li-polymer, LiPo, LIP, Li-poly) – литий полимерные аккумуляторы отличаются от литий-ионных тем, что в них используется специальный полимерный электролит. Возникший ажиотаж к этому виду батарей с 2000-х годов длится до сегодняшнего времени. Основан он не безосновательно, т. к. при помощи специальных полимеров удалось создать батарею без жидкого или гелеобразного электролита, это дает возможность создавать батареи практически любой формы. Но основная проблема заключается в том, что твердый полимерный электролит обеспечивает плохую проводимость при комнатной температуре, а лучшие свойства демонтирует в разогретом состоянии до 60°С. Все попытки ученых обнаружить решение этой задачи оказали тщетны.
В современных литий-полимерных батареях применяется небольшое количество гелевого электролита для лучшей проводимости при нормальной температуре. А принцип работы построен на одном из описанных выше типов. Самым распространенным является литий-кобальтовый тип с полимерным гелеобразным электролитом, который применяется в большинстве случаев.
Основная разница между литий-ионными аккумуляторами и литий-полимерными заключается в том, что микропористый полимерный электролит заменяется традиционным разделительным сепаратором. Литий-полимер имеет немного больший показатель удельной энергии и дает возможность создавать тонкие элементы, но стоимость на 10-30% выше, чем литий-ионных. Существенная разница есть и в структуре корпуса. Если для литий-полимерных применяется тонкая фольга, которая дается возможность создавать настолько тонкие элементы питания, что они похожи на кредитные карты, то литий-ионные собираются в жестком металлическом корпусе для плотной фиксации электродов.
Рисунок №17. Внешний вид Li-polymer аккумулятора для мобильного телефона.
Характеристики литий-ионных аккумуляторов
В таблице отсутствует максимальная емкость элементов, т. к. технология литий-ионных аккумуляторов не позволяет производить мощные отдельные элементы. Когда необходима высокая емкость или постоянный ток, батареи соединятся параллельно и последовательно при помощи перемычек. Состояние обязательно должна контролировать система батарейного мониторинга. Современные батарейные кабинеты для ИБП и солнечных электростанций на основе литиевых элементов могут достигать напряжения 500-700В постоянного тока с емкостью около 400А/ч, а также емкости 2000 – 3000Ач с напряжением 48 или 96В.
|
Параметр \ Тип |
LiCoO2 |
LiMn2O4 |
LiNiMnCoO2 |
LiFePO4 |
LiNiCoAlO2 |
Li4Ti5O12 |
|
Напряжение элемента, Вольт; |
3.6 |
3.7 |
3.6-3.7 |
3.2 |
3.6 |
2.4 |
|
Оптимальная глубина разряда, %; |
85-90 |
85-90 |
85-90 |
85-90 |
85-90 |
85-90 |
|
Допустимая глубина разряда, %; |
100 |
100 |
100 |
100 |
100 |
100 |
|
Циклический ресурс, D.O.D.=80%; |
700 — 1000 |
1000 — 2000 |
1000 — 2000 |
1000 — 2000 |
1000 — 2000 |
5000 — 8000 |
|
Оптимальная температура, °С; |
+20…+30 |
+20…+30 |
+20…+30 |
+20…+30 |
+20…+30 |
+20…+30 |
|
Диапазон рабочих температур, °С; |
–10 …+60 |
–10 …+45 |
–10 …+55 |
–10 …+60 |
–10 …+55 |
–10 …+45 |
|
Срок службы, лет при +20°С; |
5 – 7 |
10 |
10 |
20 — 25 |
20 — 25 |
18 — 25 |
|
Саморазряд в мес., % |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
|
Макс. ток разряда |
1C |
10C/30C 5с |
2C |
25 — 30C |
1C |
10C/30С 5с |
|
Макс. ток заряда |
0,7-1C |
0,7-1C |
0,7-1C |
1C |
0,7C |
1C |
|
Минимальное время заряда, ч |
2 — 3 |
2 — 2.5 |
2 — 3 |
2 — 3 |
2 — 3 |
2 — 3 |
|
Требования к обслуживанию |
нет |
нет |
нет |
нет |
нет |
нет |
|
Уровень стоимости |
высокий |
средний |
средний |
низкий |
средний |
высокий |
Никель-кадмиевые аккумуляторные батареи
Изобретателем является шведский ученый Вальдемар Юнгнер, который запатентовал технологию производства никель кадмиевого типа в 1899 году. D 1990 году возник патентный спор с Эдисоном, который Юнгнер проиграл в силу того, что не владел таким средствами, как его оппонент. Компания «Ackumulator Aktiebolaget Jungner», основанная Вальдемаром, оказалась на грани банкротства, однако, сменив название на «Svenska Ackumulator Aktiebolaget Jungner», предприятие все же продолжило свое развитие. В настоящее время предприятие, основанное разработчиком, носит название «SAFT AB» и производит одни из самых надежных никель-кадмиевых аккумуляторов в мире.
Никель-кадмиевые аккумуляторы относятся к очень долговечному и надежному типу. Существуют обслуживаемые и необслуживаемые модели с емкостью от 5 до 1500Ач. Обычно поставляются в виде сухо-заряженных банок без электролита с номинальным напряжением 1,2В. Несмотря на схожесть конструкции со свинцово-кислотными, никель- кадмиевые батареи имеют ряд существенных преимуществ в виде стабильной работы при температуре от –40°С, возможности выдерживать высокие пусковые токи, а также оптимизированы моделями для быстрого разряда. Ni-Cd батареи устойчивы к глубокому разряду, перезаряду и не требуют моментального заряда как свинцово-кислотный тип. Конструктивно производятся в ударопрочном пластике и хорошо переносят механические повреждения, не боятся вибрации и т.п.
Принцип действия никель-кадмиевых батарей
Щелочные аккумуляторы, электроды которых состоят из гидрата окиси никеля с добавлениями графита, окиси бария и порошкового кадмия. В качестве электролита, как правило, выступает раствор с 20%-ным содержанием калия и добавлением моногидрата лития. Пластины разделены изолирующими сепараторами во избежании замыкания, одна отрицательно заряженная пластина расположена между двумя положительно заряженными.
В процессе разряда никель-кадмиевой батареи происходит взаимодействие между анодом с гидратом окиси никеля и ионами электролита, образуя гидрат закиси никеля. В это же время катод из кадмия образует гидрат окиси кадмия, тем самым создавая разность потенциалов до 1,45В обеспечивая напряжение внутри аккумулятора и во внешней замкнутой цепи.
Процесс заряда никель-кадмиевых аккумуляторов сопровождается окислением активной массы анодов и переходом гидрата закиси никеля в гидрат окиси никеля. Одновременно катод восстанавливается с образованием кадмия.
Достоинством принципа действия никель-кадмиевой батареи является то, что все составляющие, которые образуются в процессе циклов разряда и заряда, почти не растворяются в электролите, а также не вступают в какие-либо побочные реакции.
Рисунок №16. Строение Ni-Cd аккумулятора.
Типы никель-кадмиевых аккумуляторов
В настоящее время батареи Ni-Cd используют чаще всего в промышленности, где требуется обеспечивать питанием разнообразные приложения. Некоторые производители предлагают несколько подвидов никель-кадмиевых аккумуляторов, которые обеспечивают наилучшую работу в определенных режимах:
-
время разряда 1,5 – 5 часов и более – обслуживаемые батареи;
-
время разряда 1,5 – 5 часов и более – необслуживаемые батареи;
-
время разряда 30 – 150 минут – обслуживаемые батареи;
-
время разряда 20 – 45 минут – обслуживаемые батареи;
-
время разряда 3 – 25 минут – обслуживаемые батареи.
Характеристики никель-кадмиевых аккумуляторов
|
Параметр \ Тип |
Никель-кадмиевые / Ni-Cd |
|
Емкость, Ампер/час; |
1 – 1500 |
|
Напряжение элемента, Вольт; |
1,2 |
|
Оптимальная глубина разряда, %; |
60 — 80 |
|
Допустимая глубина разряда, %; |
100 |
|
Циклический ресурс, D.O.D.=80%; |
2300 |
|
Оптимальная температура, °С; |
0 … +20 |
|
Диапазон рабочих температур, °С; |
-50 … +70 |
|
Срок службы, лет при +20°С; |
25 |
|
Саморазряд в мес., % |
4 |
|
Макс. ток разряда |
10 C5 |
|
Макс. ток заряда |
0.4 C5 |
|
Минимальное время заряда, ч |
5 |
|
Требования к обслуживанию |
Малообслуживаемые или необслуживанемые |
|
Уровень стоимости |
средняя (300 – 400$ 100Ач) |
Высокие технические характеристики делают этот тип аккумуляторных батарей очень привлекательным для решения производственных задач, когда требуется высоконадежный источник резервного питания с длительным сроком службы.
Никелево-железные аккумуляторные батареи
Впервые были созданы Вальдемаром Юнгнером в 1899 году, когда он пытался найти более дешевый аналог кадмию в составе никель-кадмиевых батарей. После долгих испытаний Юнгнер отказался от применения железа, т. к. заряд осуществлялся слишком медленно. Несколькими годами позднее, Томас Эдисон создал никель-железный аккумулятор, который осуществлял питание электромобилей «Baker Electric» и «Detroit Electric».
Дешевизна производства позволили никель-железным аккумуляторам стать востребованными в электротранспорте в качестве тяговых батарей, также применяются для электрификации пассажирских вагонов, питания цепей управления. В последние годы о никель-железных аккумуляторах заговорили с новой силой, т. к. они не содержат токсичных элементов вроде свинца, кадмия, кобальта и т. д. В настоящее время некоторые производители продвигают их для систем возобновляемой энергетики.
Принцип действия никелево-железных батарей
Аккумуляция электроэнергии происходит при помощи никель оксида-гидроксида, применяемого в качестве положительных пластин, железа – в качестве отрицательных пластин и жидкого электролита в виде едкого калия. Никелевые стабильные трубки или «карманы» содержат активное вещество
Никелево-железный тип очень надежный, т.к. выдерживает глубокие разряды, частые перезаряды, а также может находится в недозаряженном состоянии, что очень пагубно для свинцово-кислотных батарей.
Характеристики никелево-железных аккумуляторов
|
Параметр \ Тип |
Никель-кадмиевые / Ni-Cd |
|
Емкость, Ампер/час; |
10 – 1000 |
|
Напряжение элемента, Вольт; |
1,2 |
|
Оптимальная глубина разряда, %; |
50 — 80 |
|
Допустимая глубина разряда, %; |
100 |
|
Циклический ресурс, D.O.D.=80%; |
1800 — 2300 |
|
Оптимальная температура, °С; |
+15 … +25 |
|
Диапазон рабочих температур, °С; |
-40 … +60 |
|
Срок службы, лет при +20°С; |
20 |
|
Саморазряд в мес., % |
15 |
|
Макс. ток разряда |
0.25C 5 |
|
Макс. ток заряда |
0.25C 5 |
|
Минимальное время заряда, ч |
12 – 16 |
|
Требования к обслуживанию |
Малообслуживаемые |
|
Уровень стоимости |
средняя, низкая |
Использованные материалы
Исследования компании Boston Consulting Group
Техническая документация ТМ Bosch, Panasonic, EverExceed, Victron Energy, Varta, Leclanché, Envia, Kokam, Samsung, Valence и других.
Какой аккумулятор в автомобилях Тесла
В устройстве электромобиля принципиально важную роль играет аккумуляторная батарея. Именно от ее характеристик зависит расстояние пробега на 1 заряде, длительность зарядки, масса и цена автомобиля.
Компания Tesla оснащает свои электромобили литиевыми батареями тягового типа. Аккумуляторный блок размещается в днище экомобиля и крепится к кузову надежными кронштейнами. Эта особенность конструкции обеспечивает электромобилям заниженный центр тяжести и отличную управляемость.
Какие батареи используются в Тесле?
Батареи Tesla состоят из высокоэффективных Li-ion аккумуляторов цилиндрической формы. Преимущественно их поставляет японский производитель Panasonic. Батареи для первых электромобилей Tesla собирались вручную специалистами из Panasonic. Со временем этот процесс роботизировали, и производственный процесс поставили на конвейер.
Сборка батарей Тесла осуществляется на заводе Gigafactory в США. Роботы собирают АКБ с точной подгонкой элементов, четким соблюдением технологии, поддержанием оптимальной температуры, влажности и стерильности помещения.
Головной завод компании находится в калифорнийском Фримонте.
Для оснащения электромобилей Tesla Model S используются Li-ion аккумуляторы с высокой плотностью энергии. Они производятся в разных странах: Индии, Мексике, КНР, но доработка и конечная комплектация батарей осуществляется в США. Кроме корпорации Panasonic аккумуляторы для сборки АКБ на электромобили Tesla поставляет южнокорейская компания LG Chem, которая входит в группу LG.
Характеристики
В таблице приведены основные характеристики аккумуляторных батарей Tesla:
|
Параметр |
Значение |
|
Типоразмер элементов |
В Tesla Model 3 – ячейки 21700, обозначаемые также 21-70 или Tesla 2170. В батареях для Model S и Model X – Panasonic 18650. |
|
Ближайший аналог по типоразмеру (для 21700) |
18650, 18650В. Ячейки формата 21700 на 5 мм длиннее элементов 18650, и энергоемкость у них на 30% выше. |
|
Тип катодной химии |
Используется, как минимум, 3 разных типа химии. Самый распространенный вариант – LiNiCoAlO2 (тип NCA) c 80% Ni, 15% Co и 5% Al. Для получения максимально возможной энергоемкости с сохранением отличной температурной стабильности используются аккумуляторы с уменьшенным содержанием кобальта и добавлением никеля. В некоторых моделях используется соотношение Ni:Mn:Co, равное 8:1:1. Применяются также ячейки, содержащие кремний. |
|
Материал анода |
Графит |
|
Количество аккумуляторов в АКБ |
В батарее Tesla Roadster – 6831. В варианте Model S с энерговооруженностью 60 кВт·ч – 5375 ячеек. В батарее Model S с энерговооруженностью 85 кВт·ч – 7104 ячеек. |
|
Место установки |
Под днищем |
|
Взаимозаменяемость |
Старые и новые АКБ Тесла имеют универсальные коннекторы и полностью взаимозаменяемы. |
|
Охлаждение |
В новых моделях электромобилей реализован эффективный контур охлаждения на основе антифриза. Литиевые ячейки собраны в 4 группы и расположены вокруг охлаждающих радиаторов. |
|
Номинальное напряжение |
400 В |
|
Расстояние пробега на одном заряде |
При использовании батареи емкостью 85 кВт·ч – до 265 миль (до 426 км). |
|
Вес и размеры |
У самой мощной батареи (на 85 кВт·ч) ≈540 кг, 2100х1500х150 мм. |
|
Срок гарантийного обслуживания |
До 8 лет |
Кроме основной тяговой батареи на 400 В, в электромобилях Тесла есть дополнительная АКБ на 12 В. Она обеспечивает автономное питание бортовых электроприборов, стеклоподъемников и других дополнительных устройств.
Схема сборки
Тяговая АКБ Tesla Model S с энергоемкостью 85 кВт·ч и номинальным напряжением 400 В состоит из 16 последовательно соединенных блоков напряжением по 25 В и энергоемкостью по 5,3 кВт·ч. Каждый из них в свою очередь собирается из 444 ячеек формата 21700. Они соединяются по схеме 6s74p – параллельно соединяется 74 набора, каждый из которых состоит из 6 последовательно соединенных цилиндрических аккумуляторов. Всего в состав сборки входит 7104 элемента питания.
От внешних воздействий батарею защищает металлический корпус с крышкой, которая фиксируется винтами и герметизируется с помощью прокладок и силиконового герметика. На ее внутренней поверхности есть накладки. В аккумуляторных отсеках вверху и внизу находятся листы прессованной слюды. Они необходимы для тепло- и электроизоляции АКБ от корпуса автомобиля.
В каждом из 16 аккумуляторных модулей предусмотрен блок BMU, соединенный с общей BMS платой. Она контролирует параметры работы батареи, защищает ее от токовых перегрузок и других опасных ситуаций. В задней области аккумуляторного блока расположены общие клеммы-выводы (терминал).
Какой ресурс у батареи Теслы?
АКБ электромобиля Tesla Model 3 имеет ресурс 1500 циклов заряд-разряд. В зависимости от условий эксплуатации, она способна обеспечить пробег от 480 до 800 тыс. км. Замена каждого изношенного модуля обходится в 5–7 тыс. $. Но в рамках онлайн-презентации Tesla Battery Day в сентябре 2020 года Илон Маск представил интересные перспективы, касающиеся дальнейшего производства аккумуляторных батарей.
Он пообещал, что примерно через 3 года будет налажено серийное производство АКБ нового поколения – более мощных и долговечных. При этом их цена обещает быть в 2 раза ниже нынешней. Возможно, глава компании Tesla имел в виду литий-железо-фосфатные аккумуляторы, но это только одно из предположений.
В предыдущей статье блога VirtusTec описан принцип работы контроллера Li-ion аккумулятора.
Как состояние аккумулятора влияет на производительность iPhone — Блог re:Store Digest
Изношенный аккумулятор не способен выдавать мощность, необходимую для работы iPhone на максимальной производительности. Поэтому iPhone может замедлять свою работу, предотвращая неожиданное выключение устройства. В iOS 11.3 вы можете узнать состояние своего аккумулятора, определить необходимость его замены, а также отключить замедление, если оно активно на вашем устройстве.
Какие аккумуляторы используются в iPhone
В iPhone используются литий-ионные аккумуляторы, которые обеспечивают максимально быструю зарядку, долгую разрядку и компактные габариты. Эта наиболее современная технология, которая доступна производителям смартфонов сегодня.
Литий-ионный аккумулятор состоит из электродов — катодного материала на алюминиевой фольге и анодного материала на медной фольге. Они разделены пористым сепаратором, пропитанным электролитом, и помещены в герметичный корпус.
Переносчиком заряда в литий-ионных аккумуляторах является положительно заряженный ион лития, который может внедряться в кристаллическую решётку других материалов с образованием химической связи.
Впервые литий-ионные аккумуляторы начали использовать в 1991 году. С тех пор они стали самым популярным источником энергии в портативных устройствах: ноутбуках, цифровых фотоаппаратах, видеокамерах, плеерах и смартфонах.
Каждый аккумулятор — это одновременно и сложный технологический продукт, и расходный материал с ограниченным сроком службы. Со временем емкость и производительность этого элемента питания снижаются, тогда его нужно заменить.
Что нужно знать о химическом старении аккумуляторов
Срок службы аккумулятора iPhone зависит от количества циклов полной перезарядки устройства, а также от условий, в которых оно используется. Рекомендуется сократить время работы со смартфоном при критических температурах — меньше 0°C и больше 35°C.
Если вы не планируете использовать iPhone на протяжении большого промежутка времени, храните его заряженным до 50% и исключите попадание прямых солнечных лучей. Это поможет увеличить срок службы аккумулятора.
Со временем падает максимальная емкость аккумулятора iPhone, поэтому устройство приходится заряжать чаще. Вместе с ней уменьшается и производительность аккумулятора, которую также называют его пиковой мощностью.
Для правильной работы iPhone у него должна быть возможность мгновенно получать питание от аккумулятора. Одним из атрибутов, который влияет на такую мгновенную отдачу заряда, является полное сопротивление аккумулятора.
Полное сопротивление аккумулятора увеличивается по мере его химического старения, в состоянии низкого уровня заряда и при температуре окружающей среды меньше 0°C. При большом химическом возрасте влияние полного сопротивления усиливается.
Как предупреждается выключение старых iPhone
Для правильной работы электронных компонентов iPhone нужно определенное минимальное напряжение. К таким компонентам относятся внутренний накопитель данных устройства, цепи питания и сам аккумулятор.
Система управления питанием определяет способность аккумулятора поставлять необходимое питание и управляет нагрузкой для обеспечения операций. Если мощности питания не хватает, iPhone отключается для обеспечения безопасности комплектующих.
Чтобы предотвратить неожиданное выключение устройства, iPhone 6, iPhone 6 Plus, iPhone 6s, iPhone 6s Plus, iPhone SE, iPhone 7 и iPhone 7 Plus могут динамически контролировать свою пиковую производительность.
Если iPhone неожиданно выключится из-за старого аккумулятора, то автоматически активируется функция динамического контроля пиковой производительности. Она работает на базе данных наблюдения за температурой устройства, состоянием заряда аккумулятора и его полным сопротивлением. Если переменные требуют этого, iOS снижает скорость работы iPhone таким образом, чтобы не допустить его внезапного отключения. Это может проявляться как, например, замедление запуска программ, снижение частоты кадров при прокрутке.
При этом не страдают качество сотовой связи и пропускная способность сети, фото- и видеовозможности iPhone, производительность GPS и точность геолокации, а также гироскоп, акселерометр, барометр и Apple Pay.
Как определить износ вашего аккумулятора и отключить динамическое управление производительностью
В iOS 11.3 система контроля состояния аккумулятора и его влияния на производительность iPhone получила обновление. Теперь вы можете самостоятельно определить необходимость его замены.
Исчерпывающая информация по поводу состояния аккумулятора находится в меню «Настройки» > «Аккумулятор» > «Состояние аккумулятора (бета-версия)».
Если на вашем iPhone включена функция динамического управления производительностью, то здесь можно отключить её. Для этого воспользуйтесь кнопкой «Отключить…» в нижней части данного экрана.
После отключения функции iPhone может работать быстрее обычного. С другой стороны, он может неожиданно выключиться. Если это произойдёт, то управление производительностью автоматически активируется обратно. При желании вы сможете снова отключить его в настройках.
Аккумулятор iPhone рассчитан на сохранение 80% емкости в среднем на протяжении 500 циклов полной перезарядки при соблюдении температурного режима использования. Его фактическая емкость указывается в этом меню.
После падения емкости аккумулятора до 79% и ниже, при его регулярных отключениях и постоянно активной функции управления производительностью его необходимо заменить. Для этого обратитесь в один из официальных сервисных центров Apple.
Электровоз ВЛ80C | Аккумуляторная батарея
Назначение. Аккумуляторная батарея предназначена для питания цепей управления и освещения электровоза при неработающем ТРПШ.
Технические данные
Номинальная емкость……. 125 А-ч
Номинальное напряжение ….. 50 В
Конструкция. Аккумуляторная батарея состоит из 42 щелочных никель-кадмиевых аккумуляторов НК-125, установленных в двух металлических ящиках 2 (рис. 241). В каждом ящике на тележке 6 установлен 21 аккумулятор 14. На дне тележки уложены диски 8, окрашенные Щелочестойкой эмалью н имеющие вырезы для стока электролита в случае его выплескивания. В дне тележки и ящика имеются от верстия для стока электролита наружу.удерживается в горизонтальном положении тросами 7, связанными с крышкой регулировочными болтами 9. В закрытом положении крышка крепится к ящику вверху тремя болтами, сбоку — двумя откидными замками. Для отвода газов вверху ящика вварены две трубки с грибками 3, для забора вентилирующего воздуха на торцовых стенках ящика предусмотрены отверстия. В зимнее время во избежание попадания снега в батарею отверстия закрываются крышками на резьбе изнутри ящика. Тележка и внутренняя поверхность ящнка окрашены щелочестойкой эмалью. Каждый аккумулятор находится в индивидуальном резиновом чехле 4..Между рядами аккумуляторов, а также между рядами аккумуляторов и стенками тележки установлены гетинаксо-вые листы 75. Аккумуляторы плотно прилегают друг к другу. В продольном направлении уплотнение обеспечивается болтами 5 через на-жимныеплиты 16 (деревянную и, гетинак.совую), в поперечном направлении — установкой фанерных листов 12. Аккумуляторы соединены
последовательно медными никелированными шинами 13. Выводы аккумуляторов, шины и оси колес 10 покрываются защитной смазкой.
Аккумулятор НК-125 состоит из,стального бака 7 (рис. 242), в котором расположен блок электродов 9, состоящий из пяти отрицательных электродных пластин, и блок 8 из шести положительных пластин. Активная масса 6 пластин помещается в пакетах 5. Они выполнены в виде плоских стальных никелированных трубок с большим числом малых отверстий для обеспечения проникновения электролита. Для улучшения контакта между пакетами и активной массой к последней добавляют проводящий материал (например, чешуйчатый графит). Положительные и отрицательные пластины изолированы друг от друга эбонитовыми полочками 4. Каждый блок электродов имеет выводную ш пильку. Выводные шпильки 2 проходят сквозь крышку бака через изоляционные втулки. Блок электродов 8 соединен непосредственно с баком. Заливку электролита производят через отверстие, расположенное между выводами. Заливочное отверстие закрывается вентильной пробкой 3. Пробка имеет отверстие для выхода газов, закрытое резиновым кольцом. Изоляцией аккумулятора служит резиновый чехол 1.
Особенности работы аккумуляторной батареи на электровозе. Аккумуляторные батареи устанавливаются на выпускаемые электровозы полностью заряженными, готовыми к эксплуатации.
С целью поддержания батареи в заряженном состоянии на электровозе предусмотрен постоянный подзаряд батареи от выпрямителя 1В-4В через дроссель ДСЗ (рис. 243). Ток подзаряда батареи зависит от степени ее заряда. По мере подзаряда э. д. с. батареи растет, а ток пгдает, достигая наименьшего значения при полностью заряженной батарее. В связи с тем, что при больших отрицательных температурах внутреннее сопротивление батареи велико и для ее подзаряда требуется повышенное напряжение, электрическая схема предусматривает два режима подзаряда: для температуры окружающей среды до -10 °С и ниже -10 °С. Изменение режима подзаряда осуществляется переключением тумблера 7Р. Положение Нормальный заряд тумблера соответствует режиму подзаряда при температуре до-10 °С, положение Усиленный заряд — при температуре ниже — 10 °С. При положении Нормальный заряд вентиль 5В в цепи подзаряда батареи шунтируется резистором RIO. В моменты времени (между импульсами тока подзаряда), когда э. д. с. батареи больше, чем напряжение на выходе выпрямителя, через этот резистор протекает разрядный ток. Ввиду небольшого значения тока (не более 0,2 А) батарея при этом практически не разряжается. Однако этот ток является размагничивающим для дросселя ДСЗ, индуктированное сопротивление которого при размагничивании резко увеличивается, ограничивая ток подзаряда батареи. При переключении тумблера 7Р в положение Усиленный заряд электрическая цепь, шунтирующая вентиль 5В, размыкается, исключая протекание тока, размагничивающего дроссель ДСЗ. В результате индуктивное сопротивление дросселя снижается, а ток и напряжение подзаряда. батареи увеличиваются. На аккумуляторную батарекгсо-ставляется формуляр, отправляемый с электровозом, в .котором отмечают все работы, проводимые с батареей. • . •
VII. ПНЕВМАТИЧЕСКОЕ ОБОРУДОВАНИЕ
⇐ | Выключатель Тумблер | | Электровоз ВЛ80с | | Воздушные резервуары | ⇒
Как аккумуляторы накапливают и разряжают электричество?
Кеннет Бакл, приглашенный ученый из Центра исследований интегрированного производства при Рочестерском технологическом институте, дает это объяснение.Этот вопрос, который кажется простым и прямым, на самом деле наполнен тонкостью и сложностью. Во-первых, необходимо установить определение батареи. Существует множество химических и механических устройств, которые называются батареями, хотя они работают на разных физических принципах.Батарея для целей этого объяснения будет устройством, которое может накапливать энергию в химической форме и преобразовывать эту накопленную химическую энергию в электрическую, когда это необходимо. Это самые распространенные аккумуляторы, имеющие привычную цилиндрическую форму. Нет батарей, которые действительно хранят электрическую энергию; все батареи хранят энергию в какой-то другой форме. Даже в рамках этого ограничительного определения существует множество возможных химических комбинаций, которые могут накапливать электрическую энергию — список слишком длинный, чтобы вдаваться в его краткое объяснение.
Существует два основных типа химических аккумуляторных батарей: перезаряжаемые, или вторичные, и неперезаряжаемые, или первичные. С точки зрения хранения энергии или разряда электричества они похожи, это просто вопрос того, допускают ли задействованные химические процессы многократную зарядку и разрядку.
Прежде чем ответить на этот вопрос, необходимо также различать гальванический элемент и батарею, как я это определил.Первый — это основная единица электрохимического накопления и разряда. Батарея состоит, по крайней мере, из одной, но, возможно, из множества таких элементов, соединенных соответствующим образом. Поскольку фактическое действие накопления и разряда происходит в ячейке, этот ответ будет сосредоточен на том, что происходит на этом уровне.
Все электрохимические ячейки состоят из двух электродов, разделенных некоторым расстоянием. Пространство между электродами заполнено электролитом — ионной жидкостью, проводящей электричество.Один электрод — анод — позволяет электронам выходить из него. Другой — катод — их принимает. Энергия накапливается в определенных соединениях, составляющих анод, катод и электролит — например, цинке, меди и SO 4 соответственно.
Если предположить, что батарея приобрела свое заряженное состояние в результате перезарядки или производства, совокупный эффект химических реакций, происходящих между анодом и катодом, приводит к разряду электричества.Анод подвергается так называемой реакции окисления: во время разряда два или более иона электролита объединяются с анодом, образуя соединение и высвобождая один или несколько электронов. Одновременно катод подвергается реакции восстановления, в которой материал, из которого сделан катод, ионы и свободные электроны объединяются с образованием соединений.
Проще говоря, химическая реакция на аноде высвобождает электроны, а реакция на катоде их поглощает. Когда электрический путь, обеспечиваемый электролитом и внешней электрической цепью, соединяет анод и катод, две одновременные реакции протекают, и электроны, освобожденные на аноде, проходят через внешнее электрическое соединение и химически реагируют на катоде, заставляя элемент функционировать.Ячейка может продолжать разряжаться до тех пор, пока на одном или обоих электродах не закончатся реагенты для соответствующих реакций. В первичной ячейке это означает конец ее срока службы, а во вторичной — это просто время для подзарядки. Для вторичных элементов процесс перезарядки является обратным процессу разряда. Внешний источник постоянного электрического тока подает электроны к аноду и отводит их от катода, заставляя химические реакции происходить в обратном направлении до тех пор, пока элемент не перезарядится.
Вышеупомянутое представляет собой упрощенное объяснение того, как электрохимическая энергия, накопленная в элементе, удаляется как электрическая энергия в процессе разряда и восстанавливается в процессе перезарядки вторичного элемента. Одновременно происходит гораздо больше электрохимических и тепловых процессов, и для большинства практичных комбинаций элементов, упакованных в виде батарей, невозможно полностью охарактеризовать все процессы. Следовательно, это приближение первичных реакций является лишь кратким объяснением того, что на самом деле происходит, хотя оно должно служить для иллюстрации основных принципов в действии.
Проблема с зарядкой: как работают аккумуляторы в телефоне — и почему некоторые взрываются | Смартфоны
Срок службы батареи — взрывоопасная проблема. Буквально, как Samsung с ужасом обнаруживает. Смартфон Galaxy Note 7 компании после выпуска получил высокую оценку за лучшее в своем классе время автономной работы, намного превосходящий своего основного конкурента, iPhone 6S и 7 Plus. Потом он начал взрываться. Samsung выпустила программу отзыва и замены, и запасные части также начали быстро расти, что вынудило компанию полностью приостановить производство.
Это событие стало очередным препятствием в долгой борьбе за улучшение батарей, питающих нашу электронику. В то время как скорость обработки данных удваивается примерно каждые 18 месяцев, емкость аккумулятора увеличивается в той же степени почти за десять лет. Этот пробел начинает вызывать проблемы, но, как выяснила Samsung, его стоимость не так проста.
Смартфона часто хватает менее суток, ноутбука — всего несколько часов, а электромобиль изо всех сил пытается проехать 350 миль. Так почему же время автономной работы все еще остается такой проблемой — и когда мы собираемся это исправить?
Что такое аккумулятор?
Внутри этого пластикового и металлического корпуса находится небольшая коробочка с химическими веществами, готовыми вступить в реакцию и создать электричество.Фотография: BitchBuzz / FlickrБатареи — это небольшие емкости с химической энергией. Когда смартфон подключен к сети, электричество используется для сброса химической реакции в батарее, переносящей электроны с отрицательного анода на катод — положительный конец батареи.
После зарядки аккумулятор может вырабатывать электричество, направляя электроны через цепь, в данном случае смартфон, к аноду, и будет продолжать делать это до тех пор, пока все электроны, содержащиеся в аккумуляторе, не перейдут на анод или встроенный -в выключателе отключает аккумулятор.
Из чего сделан аккумулятор?
Внутри типичной батареи есть анод, катод и электролит — то, через что проходят положительные ионы.
Литий-ионные батареи, используемые в большинстве смартфонов и электроники, имеют катод из оксида металла, состоящий из смеси кобальта, никеля, марганца или железа, анод из пористого графита, который удерживает ионы лития внутри, и электролит из литиевой соли.
Положительно заряженные ионы лития проходят через электролит от анода к катоду, перемещая электроны через смартфон по мере необходимости и обратно к аноду.
Почему этого недостаточно?
Значок низкого заряда батареи на Nokia Lumia 800 в кармане джинсов. Фотография: Мартин Абегглен / FlickrПринцип работы батареи может быть простым, но химия и технология, обеспечивающие ее работу, — нет. Основным ограничивающим фактором для батарей является их удельная энергия.
Батарея может вырабатывать столько электричества, сколько ее химические компоненты могут накапливать. Все, что не является активным материалом внутри батареи, фактически является мертвым грузом, включая корпус, микросхемы контроллера, провода для отвода тока — все они добавляют вес, но не усиливают.
Типичный литий-ионный аккумулятор в смартфоне имеет плотность энергии около 150 ватт-часов на килограмм (Втч / кг). Хотя плотность энергии литий-ионных аккумуляторов улучшилась с момента их появления в начале 1990-х годов, она сдерживается их конструкцией и химическим составом.
Единственный способ немедленно увеличить время автономной работы смартфона с помощью современных технологий — это повысить энергоэффективность электроники смартфона и увеличить размер аккумулятора, но для более тонких и тонких смартфонов требуются все более тонкие и тонкие аккумуляторы.
Почему сокращается срок службы батареи?
Полностью заряжен или нет? Со временем аккумулятор не может накапливать столько энергии, как новый. Фотография: Bastian Greshake / FlickrСрок службы батареи не остается постоянным на протяжении всего срока службы смартфона — он медленно уменьшается с течением времени по мере того, как батарея разряжается и заряжается.
Это связано с тем, что химическая реакция, которая производит электричество, вызывает осаждение тонких слоев лития на электродах, что уменьшает количество, доступное для выработки электричества, и увеличивает внутреннее сопротивление батареи.
Чем выше сопротивление, тем тяжелее батарея должна работать, чтобы поддерживать полезное напряжение, и поэтому количество энергии, которое она может производить за один заряд, уменьшается. Возможно, вы помните этот отрывок из школы:
Напряжение = Ток x Сопротивление (В = ИК)
Почему некоторые батареи взрываются?
Аккумулятор вылетает из корпуса 17-дюймового аккумулятора MacBook Pro из-за набухания. Фотография: J Aaron Farr / FlickrБатареи с гораздо более высокой плотностью энергии, чем литиевые элементы, уже доступны, но они недостаточно безопасны для использования в портативной электронике.
«Чем больше энергии вы вложите в ящик, тем опаснее он будет», — говорит доктор Билли Ву, преподаватель Лондонской школы дизайна им. Дайсона Имперского колледжа. «Безопасность является ключевым моментом, а управление температурным режимом имеет решающее значение. Если батарея нагревается выше 80 ° C, происходит так называемый тепловой разгон, когда компоненты начинают разлагаться, и вот тогда она может взорваться ».
Конкретная причина проблем Samsung с взрывающимися батареями неизвестна, компания просто ссылается на «проблему с аккумуляторными элементами».
Что будет дальше?
На данный момент мы остановились на перезаряжаемой литий-ионной батарее. Фотография: Razor512 / FlickrВ ближайшем будущем развитие аккумуляторов будет происходить за счет приближения существующих литий-ионных технологий к их теоретическим пределам, что увеличит удельную мощность аккумуляторов.
Типичная литий-ионная батарея, в которой используется оксид лития-марганца, имеет теоретическую плотность мощности 280 Втч / кг, но конечный продукт имеет только 150 Втч / кг, поэтому, безусловно, есть возможности для улучшения.
«Речь идет об оптимизации структуры внутри батареи, — говорит Ву. «Если вы представите себе, что внутри вашей батареи, у вас есть пористая структура, полная активного материала».
«Для более высокой выходной мощности вам нужна более пористая структура, чтобы увеличить площадь поверхности и пропустить больше ионов лития за один раз, но поскольку у нее больше отверстий, она удерживает меньше активного материала, что, в свою очередь, дает вам меньшую емкость. ”
Новые, усовершенствованные химические составы батарей, такие как литий-сера и литий-кремний, также разрабатываются компаниями по всей Великобритании, которые в настоящее время разрабатывают эту технологию.
Какое будущее у аккумуляторных технологий?
На комбинированной фотографии показан Samsung Note 7, взрывающийся от давления на полностью заряженную батарею во время испытаний в лаборатории батарей Applied Energy Hub в Сингапуре, 6 октября. Фотография: Эдгар Су / ReutersТвердотельные батареи — одно из возможных направлений будущего, в котором жидкий электролит в батарее будет заменен твердым веществом, что обеспечит значительное повышение безопасности.
«Основное преимущество твердотельных батарей состоит в том, что вы можете вернуться к использованию лития в качестве материала анода, который имеет действительно хорошую мощность и плотность энергии, но небезопасен с жидкими электролитами», — объясняет Ву.
Твердотельные батареи устраняют необходимость в пористом угольном аноде и, следовательно, уменьшают вес батареи, который не способствует выработке энергии.
Металлические воздушные батареи, использующие цинк, литий или алюминий, также не за горами, но, по словам Ву, через 20 лет они будут доступны в коммерческих целях.
Что я могу сделать, чтобы аккумулятор прослужил дольше?
Знакомое зрелище для любого, у кого есть смартфон, планшет или компьютер. Фотография: Сэмюэл Гиббс / The GuardianЕсть несколько вещей, которые вы можете сделать, чтобы продлить срок службы батареи.Характер химической реакции внутри аккумулятора означает, что он должен работать интенсивнее в последние 20% разряда и более 80% заряда.
Содержание литий-ионного аккумулятора примерно между 80% и 20% заряда поможет ему дольше сохранять большую часть своей емкости. В настоящее время разрабатываются интеллектуальные системы управления питанием, которые делают это при подключении к стене на ночь.
Батареи никогда не следует оставлять постоянно подключенными, что особенно актуально для ноутбуков.Они поддерживаются в лучшем рабочем состоянии, если их время от времени разряжать и заряжать. Раз в месяц надо это делать.
Что содержит аккумулятор?
Батареи бывают разных форм и размеров. Есть те, которые можно использовать на один цикл, а также аккумуляторные варианты. Содержимое батареи зависит от типа батареи, и есть большая разница между тем, как работают разные типы, и тем, как они позже утилизируются.
Наш самый распространенный тип батарей: неперезаряжаемые щелочные батареиМаленькие батарейки обычно делят на две группы.Вариант одноразового использования — это «обычные» незакрепленные батарейки, которые вы вставляете и извлекаете из фонарей, пультов дистанционного управления, будильников или игрушек. Когда они будут закончены, их следует утилизировать в мусорном ведре, центре переработки или в магазине. Перезаряжаемые батареи — это батареи вашего смартфона, планшета, электрической зубной щетки, дрели или фотоаппарата. Проще говоря, все гаджеты, которые можно заряжать заново. Когда аккумулятор больше не заряжается, весь гаджет считается электрическими отходами и, следовательно, должен быть переработан в центре утилизации.Меньшие электрические отходы также можно сдать в магазины, торгующие электрооборудованием.
Структура щелочной батареи
Структура нашего наиболее распространенного типа батарей: неперезаряжаемая щелочная батарея Как перерабатываются батареи?Все батареи проходят предварительную обработку перед отправкой их материала на утилизацию или переработку. Здесь мы объясняем различные этапы процесса переработки.
- Батареи, встроенные в продукт, сначала удаляются вручную на предприятии по переработке.Затем батареи сортируются по размеру и содержимому. На первом этапе батарейки кнопочных элементов фильтруются через сетку встряхивания, где они сортируются на отдельные фракции определенного размера. В качестве меры предосторожности, все маленькие кнопочные батареи обрабатываются одним и тем же способом, даже если только некоторые из них содержат ртуть.
- Затем аккумуляторы разделяются на фракции в зависимости от их химического состава. Некоторые из них, такие как кадмий, выводятся из цикла.Другие, например литий, отправляются на переработку.
- Около 80 процентов всех собранных батарей — это щелочные батареи одноразового использования. Когда вы раздавливаете щелочные батареи, вы получаете материал анода и катода батареи в виде порошка. Порошок часто называют черной массой, потому что он становится черным из-за большого количества углерода. Марганец и цинк также содержатся в черной массе, что означает, что черная масса часто добавляется в плавильных печах, где производится сталь. Отделив черную массу от пластика, бумаги и латуни в щелочных батареях, вы можете получить латунь, которая увеличивает общий уровень утилизации батареи примерно на 3 процента..
- Каждая фракция измельчается и обрабатывается в закрытых системах. Например, для литий-ионных аккумуляторов важно разделить металлические корпуса и чувствительные к реакции материалы безопасным способом, чтобы материалы можно было переработать. Щелочные батареи состоят в основном из металла, пластика и большого количества цинка и марганца. В ходе этого процесса металл и пластик сортируются для вторичной переработки, а масса батареи либо перерабатывается, либо утилизируется как опасные отходы.
В 2020 году мы собрали 3 460 396 кг аккумуляторов, что соответствует 0.33 кг на жителя.
Статистика сбора Эль-Кретсена за 2020 год
Опубликовано 26.04.2021
Справочник по аккумуляторным батареям и техническим условиям
КИСЛОТА
Серная кислота. Это электролит или жидкость, содержащаяся в элементах батареи
АКТИВНЫЙ МАТЕРИАЛ
Активным материалом в положительных пластинах батареи является диоксид свинца, а в отрицательных пластинах — металлический губчатый свинец. Когда создается электрическая цепь, эти материалы реагируют с серной кислотой во время зарядки и разрядки в соответствии со следующей химической реакцией
PbO2 + Pb + 2h3SO4 = 2PbSO4 + 2h3O
АКТИВАЦИЯ
Добавление электролита в сухую батарею.
AGM
Абсорбирующий стеклянный мат
AGM BATTERY
Аккумулятор, не содержащий свободного жидкого электролита. Электролит абсорбируется стекломатом, расположенным в каждой из ячеек батареи. Аккумуляторы AGM и VRLA одинаковой конструкции
АМПЕР (Ампер., А.)
Единица измерения скорости электронного потока или тока через цепь
АМПЕР-ЧАС (Ампер-час, Ач)
Единица измерения электрической емкости аккумулятора, полученная путем умножения силы тока в амперах на время разряда в часах.(Например, батарея, которая выдает 5 ампер в течение 20 часов, дает 5 А x 20 часов = 100 Ач емкости)
СУРЬМА
Твердый хрупкий серебристо-белый металл с высоким блеском из семейства мышьяка. Химическая формула Sb, атомный номер 51.
CADMIUM
Металлический элемент, обладающий высокой устойчивостью к коррозии, используемый в качестве защитного покрытия компонентов батареи. Химическая формула Cd, атомный номер 48.
ЕМКОСТЬ
Способность полностью заряженной батареи выдавать определенное количество электроэнергии (Ач) с заданной скоростью (А) в течение определенного периода времени (Час).Емкость батареи зависит от ряда факторов, таких как: вес активного материала, плотность активного материала, адгезия активного материала к сетке, количество, конструкция и размеры пластин, расстояние между пластинами, конструкция разделителей, конкретные плотность и количество доступного электролита, сплавы сетки, конечное предельное напряжение, скорость разряда, температура, внутреннее и внешнее сопротивление, возраст и срок службы батареи.
ТЕСТ ЕМКОСТИ
Тест, при котором батарея разряжается постоянным током при комнатной температуре до тех пор, пока напряжение не упадет до 1.75 вольт на ячейку.
ЯЧЕЙКА
Базовый электрохимический токоподводящий блок в батарее, состоящий из набора положительных пластин, отрицательных пластин, электролита, сепараторов и корпуса. Свинцово-кислотная батарея на 12 вольт состоит из шести ячеек.
ЗАРЯЖЕННЫЙ
Максимальная способность аккумуляторного элемента передавать ток (в амперах). Положительные пластины содержат максимальное количество оксида свинца и минимум сульфата свинца, а отрицательные пластины содержат максимум губчатого свинца и минимум сульфата.Электролит имеет максимальный удельный вес.
ЗАРЯЖЕННЫЙ И СУХИЙ (СУХИЙ ЗАРЯД)
Аккумулятор в сборе с сухими заряженными пластинами и без электролита.
ЗАРЯЖЕННЫЙ И ВЛАЖНЫЙ (ВЛАЖНЫЙ ЗАРЯД)
Полностью заряженный аккумулятор с электролитом (готовый к установке)
ЗАРЯДКА
Процесс преобразования электрической энергии в накопленную химическую энергию
СКОРОСТЬ ЗАРЯДКИ
Ток (в амперах), при котором заряжается аккумулятор.
ЦЕПЬ
Электрическая цепь — это путь, по которому проходит поток электронов. Замкнутая цепь — это полный путь. В разомкнутой цепи есть разорванный или отключенный путь.
ЦЕПЬ (СЕРИЯ)
Цепь, которая имеет только один путь для прохождения тока. Батареи, расположенные последовательно, соединяются с отрицательным полюсом первого к плюсу второго, отрицательным полюсом второго к плюсу третьего и так далее. Если две 12-вольтовые батареи емкостью 50 Ач каждая подключены последовательно, напряжение в цепи равно сумме двух напряжений батареи, или 24 вольта, а емкость комбинации в ампер-часах составляет 50 Ач.
ЦЕПЬ (ПАРАЛЛЕЛЬНАЯ)
Цепь обеспечивает более одного пути для прохождения тока. При параллельном расположении батарей (одинакового напряжения и емкости) все положительные клеммы подключены к одному проводнику, а все отрицательные клеммы — к другому проводнику. Если две 12-вольтовые батареи емкостью 50 Ач каждая подключены параллельно, напряжение в цепи составляет 12 В, а емкость комбинации в ампер-часах составляет 100 Ач.
РЕЙТИНГ ХОЛОДНОЙ РУКОЯТКИ
Количество ампер свинцово-кислотной батареи при нуле градусов по Фаренгейту (-17.8 градусов по Цельсию) может работать в течение 30 секунд и поддерживать не менее 1,2 В на элемент.
CONSTANT CURRENT CHARGE
Зарядное устройство, которое вырабатывает постоянный ток (в амперах) во время процесса зарядки
КОРРОЗИЯ
Деструктивная химическая реакция жидкого электролита с химически активным материалом. (например, разбавление серной кислоты на железе, вызывающее образование продуктов коррозии, таких как ржавчина). Клеммы аккумуляторных батарей подвержены коррозии, если они не обслуживаются должным образом.
ТОК
Скорость потока электричества или движение электронов по проводнику. Это сравнимо с потоком струи воды. Единицей измерения силы тока в системе СИ является ампер (А)
ТОК (ПЕРЕМЕННЫЙ) (AC)
Ток, периодически меняющийся по величине и направлению. Батарея не подает переменный ток.
ТОК (ПРЯМОЙ) (постоянный ток)
Электрический ток, протекающий в электрической цепи только в одном направлении.Батарея выдает постоянный ток (DC) и должна заряжаться постоянным током в направлении, противоположном разряду.
ЦИКЛ
В аккумуляторе одна разрядка плюс одна подзарядка равны одному циклу.
СКОРОСТЬ РАЗРЯДА
Любая указанная сила тока, при которой батарея разряжается
РАЗРЯДКА
Когда батарея выдает ток, говорят, что она разряжается.
ЭЛЕКТРОЛИТ
В свинцово-кислотных аккумуляторах электролитом является серная кислота, разбавленная водой.Это проводник, который поставляет воду и сульфат для электрохимической реакции.
PbO2 + Pb + 2h3SO4 = 2PbSO4 + 2h3O
ЭЛЕМЕНТ
В аккумуляторе набор положительных и отрицательных пластин в сборе с разделителями.
FLOAT CHARGE
Скорость перезарядки, которая немного выше, чем напряжение холостого хода (OCV) батареи
ФОРМИРОВАНИЕ
При производстве аккумуляторов формирование — это процесс зарядки аккумулятора в первый раз.Электрохимически образование превращает пасту оксида свинца на положительных решетках в диоксид свинца, а пасту из оксида свинца на отрицательных решетках — на металлический губчатый свинец.
GLASS MAT
Ткань из стекловолокна с полимерным связующим, например стиролом или акрилом, который используется для удержания активного материала положительных материалов. Стеклянные коврики также поглощают электролит в батарее AGM.
GRID
Каркас из свинцового сплава, поддерживающий активный материал пластины батареи и проводящий ток.
ЗАЗЕМЛЕНИЕ
Опорный потенциал цепи. В автомобильной промышленности — результат прикрепления одного кабеля аккумулятора к кузову или раме транспортного средства, который используется в качестве пути для замыкания цепи вместо прямого провода от компонента. Сегодня более 99% автомобильных и LTV-приложений используют отрицательную клемму аккумулятора в качестве заземления.
ГИДРОМЕТР
Устройство поплавкового типа, используемое для определения степени заряда аккумулятора путем измерения удельного веса электролита.(т.е. концентрация серной кислоты в электролите).
СВИНЦ
Химический элемент, основной состав свинцово-кислотной батареи. Химическая формула Pb, атомный номер 82.
СВИНЦОВОЕ СУРЬЕ
Металлический сплав, обычно используемый в отливках или пластинах аккумуляторных батарей.
СВИНЦЕВЫЙ КАЛЬЦИЙ
Сплав на основе свинца, который иногда используется для компонентов батарей вместо сплавов с сурьмой и свинцом.
ПЕРОКСИД СВИНЦА
Коричневый оксид свинца, который является положительным материалом в полностью сформированной положительной пластине аккумуляторной батареи.
СВИНЦОВАЯ ГУБКА
Главный компонент активного материала полностью сформированной отрицательной пластины аккумуляторного элемента.
СУЛЬФАТ СВИНЦА
Соединение, которое образуется в результате химической реакции серной кислоты с оксидами свинца в элементе батареи.
СЕРНАЯ КИСЛОТА
Основное кислотное соединение серы. Серная кислота в разбавленном виде является электролитом свинцово-кислотной батареи. Химическая формула h3SO4.
TRICKLE CHARGE
Непрерывный низкоскоростной заряд, примерно равный внутренним потерям аккумулятора и способный поддерживать аккумулятор в полностью заряженном состоянии.
ТЕСТЕР НАГРУЗКИ
Прибор, который потребляет ток (разряжается) от батареи, используя электрическую нагрузку, при измерении напряжения. Он определяет способность батареи работать в реальных условиях разряда.
АККУМУЛЯТОР С НИЗКИМ ПОТЕРЬЮ ВОДЫ
Аккумулятор, не требующий периодического добавления воды при нормальных условиях. Также известна как необслуживаемая батарея .
MILLIAMPERE
Одна тысячная ампер (ампер)
МОДИФИЦИРОВАННЫЙ ЗАРЯД ПОСТОЯННОГО НАПРЯЖЕНИЯ
Заряд, при котором напряжение заряда поддерживается постоянным, в то время как фиксированное сопротивление вставлено в цепь зарядки аккумулятора, вызывая повышение напряжения по мере зарядки.
ОТРИЦАТЕЛЬНЫЙ
Обозначение или отношение к электрическому потенциалу. Отрицательный полюс батареи — это точка, из которой при разряде текут электроны.
ОТРИЦАТЕЛЬНАЯ ПЛАСТИНА
Сетка и активный материал, по которому ток течет от внешней цепи, когда батарея разряжается.
ОТРИЦАТЕЛЬНЫЙ КЛЕММ
Клемма батареи, от которой ток течет через внешнюю цепь к положительной клемме, когда батарея разряжается.
ОМ
Единица измерения электрического сопротивления в системе СИ. Также единица электрического сопротивления в электрической цепи.
ЗАКОН ОМА
Выражает соотношение между вольтами (v) и амперами (A) в электрической цепи с сопротивлением (R). Его можно выразить следующим образом
В = ИК
Вольт (v) = амперы (I) x Ом (R). Если известны любые два из трех значений, третье можно рассчитать, используя приведенный выше расчет.
НАПРЯЖЕНИЕ ОТКРЫТОЙ ЦЕПИ
Напряжение залитой свинцово-кислотной аккумуляторной батареей, когда она не подает или не получает питание. Это 2,11 вольта для полностью заряженной аккумуляторной батареи или 12,66 вольта для полностью заряженной 12-вольтовой батареи (6,33 для 6-вольтовой батареи).
ПОЛОЖИТЕЛЬНЫЙ
Обозначение или относящийся к виду электрического потенциала; противоположность отрицательному. Точка или клемма батареи, имеющая более низкий относительный электрический потенциал.
ПОЛОЖИТЕЛЬНЫЙ ТЕРМИНАЛ
Клемма батареи, на которую ток течет во внешней цепи, когда батарея разряжается.
ОСНОВНАЯ БАТАРЕЯ
Этот тип батареи может накапливать и отдавать электрическую энергию, но не может быть перезаряжен.
НОМИНАЛЬНАЯ МОЩНОСТЬ
Ампер Время разряда, которое можно снять с полностью заряженной батареи с определенной постоянной скоростью.
РЕЗЕРВНАЯ МОЩНОСТЬ
Время в минутах, в течение которого новая, полностью заряженная батарея выдает 25 ампер при температуре 80 градусов по Фаренгейту и поддерживает напряжение на клеммах равное или выше 1.75 вольт на ячейку. Этот рейтинг представляет собой время, в течение которого аккумулятор будет продолжать работать с основными принадлежностями в случае выхода из строя генератора переменного тока или генератора автомобиля.
СОПРОТИВЛЕНИЕ (ЭЛЕКТРИЧЕСКОЕ)
Противодействие свободному протеканию тока в цепи. Обычно он измеряется в Ом.
ВТОРИЧНЫЙ АККУМУЛЯТОР
Аккумулятор, который может накапливать и отдавать электрическую энергию и может заряжаться, пропуская через него постоянный ток в направлении, противоположном направлению разряда.
САМОРАЗРЯДКА
Постепенная потеря электроэнергии при хранении батареи.
СЕПАРАТОР
Делитель между положительной и отрицательной пластинами элемента, который позволяет току проходить через него. Сепараторы изготавливаются из различных материалов, таких как полиэтилен, поливинилхлорид, резина, стекловолокно, целлюлоза и т. Д.
КОРОТКОЕ ЗАМЫКАНИЕ
Непреднамеренный обход тока в электрическом устройстве или проводке, как правило, с очень низким сопротивлением и, таким образом, вызывает протекание большого тока.В аккумуляторе короткое замыкание элемента может быть достаточно постоянным, чтобы разрядить элемент и сделать аккумулятор бесполезным.
УДЕЛЬНЫЙ ВЕС (SG)
Плотность жидкости по сравнению с плотностью воды. Удельный вес электролита — это вес электролита по сравнению с весом равного объема чистой воды.
СОСТОЯНИЕ ЗАРЯДА
Количество электроэнергии, хранящейся в батарее в любой момент времени, выраженное в процентах от энергии при полной зарядке.
VOLT
Единица измерения электрического потенциала в системе СИ.
НАПРЯЖЕНИЕ
Разница в электрическом потенциале, которая существует между клеммами батареи или любыми двумя точками в электрической цепи.
ПАДЕНИЕ НАПРЯЖЕНИЯ
Чистая разница в электрическом потенциале (напряжении) при измерении сопротивления или импеданса (Ом). Его отношение к току описано в законе Ома .
VRLA
Свинцово-кислотный клапан с регулируемым клапаном.Герметичная батарея с предохранительным клапаном, предназначенным для сброса избыточного внутреннего давления при поддержании давления, достаточного для рекомбинации кислорода и водорода в воду. VRLA и AGM относятся к батарее одного типа.
WATT
Единица СИ для измерения электрической мощности. (то есть скорость выполнения работы по перемещению электронов за счет электрического потенциала или против него.
Формула: Ватты = Амперы x Вольты
ВАТТ-ЧАС (Ватт-час., WH)
Единица измерения электрической энергии, выражаемая в ваттах x часах.
Глоссарий по батареям| Гель | Мокрый | Затопленные
Свинцово-кислотные батареи
Свинцово-кислотные батареи — самая старая форма аккумуляторных батарей. Перезаряжаемые батареи также называют «вторичными батареями».
Батареи этого типа примечательны тем, что они содержат жидкость в негерметичном контейнере, поэтому необходимо держать батарею в вертикальном положении и хорошо проветривать зону, чтобы обеспечить безопасное рассеивание газообразного водорода, выделяемого этими батареями во время перезарядки.
Несмотря на очень низкое отношение энергии к весу и низкое отношение энергии к объему, их способность обеспечивать высокие импульсные токи означает, что элементы поддерживают относительно большое отношение мощности к весу. Эти особенности, наряду с их низкой стоимостью, делают их привлекательными для использования в автомобилях, поскольку они обеспечивают высокий ток, необходимый для автомобильных стартеров.
Узнайте больше о разнице между автомобильными аккумуляторами и аккумуляторами глубокого разряда.
Лицензия: Некоторая информация на этой странице была взята из Википедии и поэтому выпущена под лицензией CC-BY-SA.
Аккумуляторы с жидким электролитом или залитые батареи
Аккумуляторные батареи с жидким электролитом или с затопленным аккумулятором работают с жидким раствором электролита (аккумуляторная кислота), покрывающим все внутренние части. При перезарядке мокрые батареи выделяют газ. Этот газ должен улетучиваться, поэтому некоторые называют этот тип батареи вентилируемой батареей . Некоторые типы влажных батарей заявляют, что они «герметичны». Это батареи типа VRLA (см. Ниже).
Влажные элементы до сих пор широко используются в автомобилях, стационарных (больших) источниках бесперебойного питания и, конечно же, в автономных энергосистемах.
Сухие элементы или герметичные батареи
Сухие элементы или герметичные батареи составляют большинство батарей, используемых в доме, и встречаются во многих предметах домашнего обихода, включая фонарики, игрушки, радио, фотоаппараты, электроинструменты, мобильные телефоны и портативные компьютеры.
«Сухой элемент» — это антоним аккумуляторов с жидким электролитом. Компания Rainbow Power воздерживается от использования термина «сухой элемент», поскольку он может вводить в заблуждение. Во-первых, сухие батареи не такие сухие, как следует из названия: они содержат влагу в пасте или коврике.Во-вторых, мокрые батареи обычно поставляются без кислоты, которая буквально делает их сухими. (Предостережение: использование влажных батарей в «сухом» состоянии приведет к «мертвым» батареям)
«Герметичный» также немного вводит в заблуждение, поскольку ни один свинцово-кислотный аккумулятор не является действительно герметичным. В большинстве случаев герметичная батарея рекомбинирует кислород, образующийся на положительных пластинах, с водородом отрицательных пластин. Однако батарея может создавать избыточное давление, которое необходимо сбросить, чтобы предотвратить взрыв.
Поэтому мы предпочитаем термин «свинцово-кислотная аккумуляторная батарея с регулируемым клапаном» (VRLA).См. Следующую вкладку.
Свинцово-кислотные батареи с клапанным регулированием
Свинцово-кислотные батареи с клапанным регулированием (или аккумулятор VRLA) — это улучшенный тип аккумуляторных батарей с жидким электролитом. Благодаря своей конструкции батареи VRLA не требуют регулярного добавления воды в элементы и обычно рекламируются как батареи, не требующие обслуживания. Батареи VRLA далее классифицируются как:
- Батареи с абсорбированным стеклом (AGM)
- Гелевые батареи
Эти батареи часто называют герметичными свинцово-кислотными батареями , но они всегда содержат предохранительное давление. предохранительный клапан.В отличие от аккумуляторов wet (также называемых затопленных аккумуляторов ), VRLA не может пролить свой электролит, если его перевернуть. Поскольку в аккумуляторах AGM VRLA используется гораздо меньше электролита (аккумуляторной кислоты), чем в традиционных свинцово-кислотных аккумуляторах, их также иногда называют конструкцией с «кислотным голоданием».
Батареи из абсорбированного стекломата
Батареи из абсорбированного стекломата (AGM) изначально были разработаны для военных как термостойкий и устойчивый к вибрации источник питания.Эти батареи удерживают электролит на сепараторе стекломата.
Некоторые преимущества перед аккумуляторными батареями с жидким электролитом:
- отсутствие разливов кислоты
- низкие эксплуатационные расходы (не требуется доливка)
- термостойкость (работа при -20 ° C)
- устойчивость к вибрации
- они могут быть (иногда! ) разряжены намного глубже без серьезных повреждений
- они могут заряжаться намного быстрее
Гелевые батареи
Гелевые батареи (также известные как «гелевые элементы») представляют собой батареи типа VRLA с «гелеобразным» электролитом.В отличие от свинцово-кислотных аккумуляторов с жидким электролитом, эти аккумуляторы не нужно хранить в вертикальном положении. Гелевые батареи уменьшают испарение электролита, утечку (и последующие проблемы коррозии), характерные для батарей с жидкими элементами, и обладают большей устойчивостью к экстремальным температурам, ударам и вибрации. По химическому составу они такие же, как мокрые (негерметичные) батареи, за исключением того, что сурьма в свинцовых пластинах заменена кальцием.
Литиевые батареи
Литиевые батареи — это фактически одноразовые неперезаряжаемые батареи (или «первичные» батареи), которые используются в небольших устройствах, таких как калькуляторы или таймеры, и известны своим долгим сроком службы.Их также называют литий-металлическими батареями. RPC не продает литий-металлические батареи или первичные батареи в этом отношении. Термин «литиевые батареи», однако, также иногда (неправильно) используется в качестве заголовка для различного химического состава перезаряжаемых литий-ионных батарей.
Литий-ионные батареи
Литий-ионные батареи, или сокращенно Li-ion, представляют собой аккумуляторные батареи с очень высокой плотностью энергии. Это приводит к меньшему размеру и весу батарей по сравнению с батареями других технологий или химического состава.У них также очень низкая скорость саморазряда, а это означает, что они имеют длительный срок хранения; Фактически, литий-ионные батареи остаются почти полностью заряженными даже после многих недель хранения. Самым большим преимуществом является высокая емкость заряда и разряда. Литий-ионные аккумуляторы могут обеспечивать до 100% своей номинальной емкости.
Существует несколько типов литий-ионных батарей с различным химическим составом и другими характеристиками. Компания RPC рекомендует использовать фосфат лития-железа для автономных солнечных систем.
Литий-железо-фосфатные батареи
Литий-железо-фосфатные батареи или LiFePO 4 Батареи представляют собой литий-ионные батареи с плотностью энергии, которая немного ниже, чем у других литий-ионных аккумуляторов (например, LiCoO 2 ) так как они имеют более низкое рабочее напряжение. Однако из-за химического состава катода из фосфата железа LiFePO 4 практически негорючие — даже при быстрой зарядке или разрядке. Этот аспект безопасности дает литий-железофосфату преимущество перед другими химическими веществами, поскольку в домашних условиях часто встречаются всплески высоких токов.Кроме того, LiFePO 4 может обеспечивать более высокие пиковые токи, чем другие литий-ионные батареи.
BU-307: Как работает электролит?
Узнайте больше о катализаторе, который охватывает электроды батареи и заставляет электрический ток течь. Электролит служит катализатором, делающим аккумулятор проводящим, способствуя перемещению ионов от катода к аноду при зарядке и в обратном направлении при разрядке. Ионы — это электрически заряженные атомы, которые потеряли или приобрели электроны.Электролит батареи состоит из растворимых солей, кислот или других оснований в жидком, гелеобразном и сухом форматах. Электролит также бывает в виде полимера, который используется в твердотельной батарее, твердой керамики и расплавленных солей, как в натрий-серной батарее.
В свинцовой кислоте используется серная кислота . При зарядке кислота становится более плотной, так как оксид свинца (PbO 2 ) образуется на положительной пластине, а затем превращается почти в воду при полном разряде.Удельный вес серной кислоты измеряется ареометром. (См. Также BU-903: Как измерить заряд). Свинцово-кислотные батареи бывают залитых и герметичных форматов, также известных как свинцово-кислотные батареи с регулируемым клапаном (VRLA) или необслуживаемые.
Серная кислота бесцветная, с легким желто-зеленым оттенком, растворима в воде и обладает высокой коррозионной активностью. Обесцвечивание до коричневатого оттенка может быть вызвано ржавчиной в результате анодной коррозии или попаданием воды в аккумуляторный блок.
Свинцово-кислотные батареи бывают разной плотности (SG).В батареях глубокого цикла используется плотный электролит с удельной массой до 1,330 для достижения высокой удельной энергии, стартерные батареи имеют средний удельный вес около 1,265, а стационарные батареи имеют низкий удельный вес примерно от 1,225 до умеренной коррозии и способствуют долговечности. (См. BU-903: Как измерить состояние заряда).
Серная кислота служит для широкого спектра применений, а также содержится в очистителях канализации и различных чистящих средствах. Кроме того, он служит в переработке полезных ископаемых, переработке полезных ископаемых, производстве удобрений, нефтепереработке, очистке сточных вод и химическом синтезе.
| ВНИМАНИЕ | Серная кислота может вызвать серьезные повреждения при контакте с кожей и привести к необратимой слепоте при попадании в глаза. Проглатывание серной кислоты вызывает необратимые повреждения. |
Электролитом в NiCd является щелочной электролит (гидроксид калия) . Большинство никель-кадмиевых батарей имеют цилиндрическую форму, в которой несколько слоев положительных и отрицательных материалов намотаны в рулон желе.Версия NiCd для заливки используется в качестве судовой батареи в коммерческих самолетах и в системах ИБП, работающих в жарком и холодном климате, требующих частой езды на велосипеде. NiCd дороже свинцово-кислотной, но служит дольше.
Металлогидрид никеля (NiMH)NiMH использует тот же или аналогичный электролит, что и NiCd, который обычно представляет собой гидроксид калия. Электроды NiMH уникальны и состоят из никеля, кобальта, марганца, алюминия и редкоземельных металлов, которые также используются в Li-ion.NiMH доступен только в герметичных версиях.
Гидроксид калия — это неорганическое соединение с формулой КОН, обычно называемое едким калием. Электролит бесцветен и имеет множество промышленных применений, например, в качестве ингредиента в большинстве мягких и жидких мыл. КОН вреден, если он не переварен.
Литий-ионный (Li-ion) В Li-ionиспользуется жидкий, гелевый или сухой полимерный электролит. Жидкая версия представляет собой горючий органический, а не водный тип, раствор солей лития с органическими растворителями, подобными этиленкарбонату.Смешивание растворов с различными карбонатами обеспечивает более высокую проводимость и расширяет температурный диапазон. Могут быть добавлены другие соли, чтобы уменьшить газообразование и улучшить цикличность при высоких температурах.
Литий-ионный аккумуляторс гелеобразными электролитами получает множество добавок для увеличения проводимости, так же как и литий-полимерный аккумулятор. Настоящий сухой полимер становится проводящим только при повышенных температурах, и эта батарея больше не используется в коммерческих целях. Добавки также вводятся для достижения долговечности и уникальных характеристик.Рецепт засекречен и у каждого производителя есть свой секретный соус. (См. Также BU-808b: Почему умирает литий-ионный аккумулятор?)
Электролит должен быть стабильным, но это не относится к Li-ion. На аноде образуется пассивирующая пленка, которая называется интерфейс твердого электролита (SEI) . Этот слой отделяет анод от катода, но позволяет ионам проходить сквозь него подобно сепаратору. По сути, слой SEI должен формироваться, чтобы батарея могла работать. Пленка стабилизирует систему и продлевает срок службы литий-ионного аккумулятора, но это приводит к снижению емкости.На катоде также происходит окисление электролита, что постоянно снижает емкость. (См. Также BU-701: Как заправить батареи)
Чтобы пленки не становились слишком ограничивающими, добавки смешиваются с электролитом, который расходуется во время формирования слоя SEI. При проведении судебно-медицинской экспертизы отследить их присутствие сложно, а то и невозможно. При этом патентованные добавки являются коммерческой тайной, как их состав, так и используемое количество.
Хорошо известная добавка — виниленкарбонат (ВК).Это химическое вещество увеличивает срок службы литий-ионных аккумуляторов, особенно при более высоких температурах, и сохраняет внутреннее сопротивление на низком уровне по мере использования и старения. ВК также поддерживает стабильную пленку SEI на аноде без побочных эффектов окисления электролита на катоде (Аурбах и др.). Говорят, что академические и исследовательские сообщества отстают от производителей ячеек в знаниях и выборе добавок, отсюда и большой секрет. (См. Также «Добавки и их влияние на эффективность кулоновского цинка» в документе BU-808b: Что вызывает умиротворение литий-ионных аккумуляторов?
Для большинства коммерческих литий-ионных аккумуляторов слой SEI разрушается при температуре ячейки 75–90 ° C (167–194 ° F).Тип элемента и состояние заряда (SoC) влияют на пробой при повышенной температуре. Может возникнуть самонагревание, которое может привести к тепловому выходу из-под контроля, если не охладиться должным образом. Лабораторные испытания, проведенные на ячейках 18650, показали, что такое тепловое явление может развиться в течение двух дней.
Воспламеняемость литий-ионного электролита является еще одной проблемой, и проводятся эксперименты по получению негорючих или восстановленных легковоспламеняющихся электролитов с помощью добавок или разработки неорганических ионных жидкостей. Также проводятся исследования по работе литий-ионных аккумуляторов при низких температурах.На момент написания ни один из этих электролитов не находился в широком коммерческом использовании.
Высыхание или медленное превращение жидкого электролита в твердую форму является еще одним событием старения, которое снижает производительность литий-ионных аккумуляторов. «Когда жидкость уходит, батареи разряжены», — говорит Джефф Дан, специалист по литий-ионным батареям и профессор физики. Жидкость электролита — еще один индикатор состояния, который относится ко всем химическим свойствам аккумуляторов.
Батареи в портативном мире
Материал по Battery University основан на незаменимом новом 4-м издании « Batteries in a Portable World — A Handbook on Battery for Non-Engineers », которое доступно для заказа через Amazon.com.
Когда была изобретена батарея?
Исидор Бухманн, Cadex Electronics, Inc
Батарея, являющаяся технологической необходимостью сегодня, является результатом 400 лет научных усилий.
Одно из самых замечательных и новых открытий за последние 400 лет — электричество. Кто-то может спросить: «Неужели электричество так давно?» Ответ — да, и, возможно, намного дольше, но практическое использование электричества было в нашем распоряжении только с середины до конца 1800-х годов.Одной из первых электрических достопримечательностей, привлекших внимание общественности, был мост через реку Сену с электрической подсветкой во время Всемирной выставки 1900 года в Париже.
Использование электричества может начаться гораздо раньше. При строительстве новой железной дороги в 1936 году недалеко от Багдада рабочие обнаружили доисторическую батарею. Открытие было известно как Багдад, или Парфянская батарея (см. Рис. 1), и считается, что ему 2000 лет, оно восходит к парфянскому периоду [Парфянская империя существовала на территории нынешнего Ирана с 247 г. до н.э. по 224 г. н.э.- Ed .]. Батарея представляла собой глиняный сосуд, наполненный уксусом. Железный стержень, окруженный медным цилиндром, проник в жидкость и произвел электричество от 1,1 до 2 В.
Не все ученые считают парфянскую батарею источником энергии, потому что ее применение неизвестно. [Существуют альтернативные объяснения парфянской батареи, но она работает как батарея. — Ed .] Возможно, что батарея использовалась для гальванического нанесения слоя золота или других драгоценных металлов на поверхность.Говорят, что египтяне нанесли гальваническое покрытие сурьмой на медь более 4300 лет назад.
Эксперименты с современными батареями
Самый ранний метод производства электричества заключался в создании статического заряда в каком-либо веществе. В 1660 году Отто фон Герике (1602–1686) сконструировал первую электрическую машину, состоящую из большого серного шара, который при трении и повороте притягивал перья и маленькие кусочки бумаги. Герике удалось доказать, что возникающие искры имеют электрическую природу.Первым практическим применением статического электричества стал «электрический пистолет», изобретенный Алессандро Вольта (1745-1827). Электрический провод помещали в сосуд, наполненный газом метаном. Когда через провод проходила электрическая искра, банка взрывалась.
ЗатемVolta (см. Рисунок 2) подумал об использовании этого изобретения для обеспечения связи на большие расстояния, хотя и с одним логическим битом. Железная проволока, поддерживаемая деревянными столбами, должна была быть протянута из Комо в Милан, Италия. На приемном конце проволока оканчивалась сосудом, заполненным газообразным метаном.Чтобы сигнализировать о закодированном событии, по проводу посылалась электрическая искра, которая взорвала электрический пистолет. Этот канал связи так и не был построен.
В 1791 году, работая в Болонском университете, Луиджи Гальвани (1737-1798) обнаружил, что мышцы лягушки сокращаются при прикосновении к разным металлическим предметам. Это явление стало известно как «животное электричество» — неправильное название, как позже было доказано. Вдохновленный этими экспериментами, Вольта инициировал серию экспериментов с использованием разнородных металлов.Он попытался объединить цинк, свинец, олово или железо в качестве положительных пластин и медь, серебро, золото или графит в качестве отрицательных пластин.
Ранние батареи
Вольта обнаружил в 1800 году, что определенные жидкости будут генерировать непрерывный поток электроэнергии в сочетании с парой разнородных металлов. Это открытие привело к изобретению первого гальванического элемента, более известного как батарея. Далее Вольта обнаружил, что напряжение будет увеличиваться, когда гальванические элементы ставятся друг на друга.На рисунке 3 показано такое последовательное соединение.
В том же году Вольта сообщил Королевскому обществу о своем открытии непрерывного источника электричества. Эксперименты больше не ограничивались кратковременным отображением искр, продолжавшимся доли секунды. Теперь появился, казалось бы, бесконечный поток электрического тока.
Франция была одной из первых стран, официально признавших открытия Вольта. Франция приближалась к пику научных достижений, и новые идеи приветствовали с распростертыми объятиями.По приглашению Вольта выступил в Институте Франции с серией лекций, на которых присутствовал Наполеон Бонапарт в качестве члена (см. Рис. 4). Наполеон помогал в экспериментах, вытаскивая искры из батареи, плавя стальную проволоку, разряжая электрический пистолет и разлагая воду на его элементы.
После успешных экспериментов Гальвани и открытия гальванического элемента интерес к гальваническому электричеству получил широкое распространение. Сэр Хэмфри Дэви (1778–1829), изобретатель шахтерской предохранительной лампы, сделал новые открытия, когда установил самую большую и мощную электрическую батарею в хранилищах Королевского института.Он соединил батарею с угольными электродами и произвел первый электрический свет. Свидетели сообщили, что его гальваническая дуговая лампа давала «самую яркую восходящую дугу света, которую когда-либо видели».
Дэви начал исследовать химические эффекты электричества в 1800 году и вскоре обнаружил, что при пропускании электрического тока через некоторые вещества происходит разложение, процесс, позже названный электролизом. Генерируемое напряжение напрямую связано с реакционной способностью электролита по отношению к металлу.Дэви понял, что действие электролиза и гальванического элемента было одинаковым.
В 1802 году доктор Уильям Круикшенк разработал первую электрическую батарею, которую можно было производить массово. Круикшанк устроил квадратные листы меди с листами цинка одинакового размера. Эти листы были помещены в длинный прямоугольный деревянный ящик и спаяны. Пазы в коробке удерживали металлические пластины на месте. Затем герметичный ящик был заполнен электролитом из рассола или разбавленной кислотой, напоминая залитую батарею, которая все еще находится у нас сегодня (см. Рис. 5).
Аккумулятор
В 1836 году английский химик Джон Ф. Даниэлл разработал улучшенную батарею, которая вырабатывала более стабильный ток, чем устройство Вольта. До этого все батареи были первичными, а это означало, что их нельзя было перезарядить. В 1859 году французский врач Гастон Планте изобрел первую аккумуляторную батарею. В его основе лежали свинец и кислота, и эта система используется до сих пор.
В 1899 году Вальдмар Юнгнер из Швеции изобрел никель-кадмиевую батарею (NiCd), в которой для положительного электрода использовался никель, а для отрицательного — кадмий.Два года спустя Томас Эдисон создал альтернативную конструкцию, заменив кадмий железом. Высокая стоимость материалов по сравнению с сухими элементами или свинцово-кислотными системами ограничивала практическое применение никель-кадмиевых и никель-железных батарей. Не раньше, чем Шлехт и Акерманн добились значительных улучшений, изобретя спеченную полюсную пластину в 1932 году, NiCd привлек новое внимание [спекание — это процесс плавления никелевого порошка при температуре значительно ниже его точки плавления с использованием высоких давлений].Это привело к увеличению токов нагрузки и увеличению срока службы. Прорыв произошел в 1947 году, когда Нейману удалось полностью герметизировать никель-кадмиевый элемент.
В 1980-х и 1990-х годах внимание было сосредоточено на химии на основе никеля. Обеспокоенные загрязнением окружающей среды в случае небрежной утилизации NiCd, некоторые европейские страны начали ограничивать этот химический состав и попросили промышленность перейти на никель-металлгидрид (NiMH). Многие говорят, что NiMH — это переходный этап к литий-ионному (Li-ion), и это вполне может быть правдой.Большая часть исследований сосредоточена на улучшении литий-ионных аккумуляторов. Литий-ионные аккумуляторы используются не только в сотовых телефонах, ноутбуках, цифровых камерах, инструментах и медицинских устройствах, но и в транспортных средствах. Литий-ионный аккумулятор имеет ряд преимуществ, в том числе более высокую плотность энергии, его легче заряжать и не возникает проблем с обслуживанием, в отличие от никелевых аккумуляторов. Литий-ионные аккумуляторы также не подвержены сульфатированию, которое характерно для систем на основе свинца.
Электричество через магнетизм
Электричество через магнетизм, альтернативный метод производства электричества помимо статического заряда и батарей, появился относительно поздно.В 1820 году Андре-Мари Ампер (1775-1836) заметил, что провода, по которым проходит электрический ток, время от времени притягиваются, а иногда отталкиваются друг от друга. В 1831 году Майкл Фарадей (1791-1867) продемонстрировал, как медный диск обеспечивает постоянный поток электричества при вращении в сильном магнитном поле. Фарадей, помогая Дэви и его исследовательской группе, сумел создать бесконечную электрическую силу, пока продолжалось движение между катушкой и магнитом. Это привело к изобретению электрогенератора, а затем электродвигателя.Вскоре после этого были разработаны трансформаторы, которые могли преобразовывать переменный ток (ac) в любое желаемое напряжение. В 1833 году Фарадей заложил основы электрохимии, опубликовав свои законы электролиза.
Когда в середине 1800-х годов была обнаружена связь с магнетизмом, большие генераторы начали производить постоянный поток электричества. Затем последовали двигатели, которые обеспечили механическое движение, а лампочка Эдисона, казалось, победила тьму. Технология трехфазного переменного тока, разработанная Николой Тесла (1857-1943), позволила линиям электропередачи передавать электроэнергию на большие расстояния.Таким образом, электричество стало доступно человечеству для улучшения общего качества жизни.
Изобретение электронной вакуумной лампы в начале 1900-х годов стало значительным следующим шагом в направлении высоких технологий, позволившим разработать генераторы частоты, усилители сигналов и цифровые переключатели. Это привело к радиовещанию в 1920-х и появлению первого цифрового компьютера под названием ENIAC в 1946 году. Открытие транзистора в 1947 году проложило путь к интегральной схеме 10 лет спустя.Микропроцессор открыл век информации и произвел революцию в том, как мы живем сегодня.
Человечество зависит от электричества, и с ростом мобильности люди все больше и больше переходят к портативным накопителям энергии — сначала для колесных приложений, затем портативности и, наконец, носимых устройств. Какими бы неудобными и ненадежными ни были первые батареи, будущие поколения могут рассматривать сегодняшние технологии как не более чем неуклюжие эксперименты.
История развития батарей.
1600 Уильям Гилберт (Великобритания) Учреждение отделения электрохимии
1791 Луиджи Гальвани (Италия) Открытие «животного электричества»
1800 Алессандро Вольта (Италия) Изобретение гальванического элемента
(диски цинковые и медные)
1802 Уильям Круикшанк (Великобритания) Первая электрическая батарея
серийного производства
1820 Андре Мари Ампер (Франция) Электричество через магнетизм
1833 Майкл Фарадей (Великобритания) Объявление законов Фарадея
1836 Джон Ф.Даниэлл (Великобритания) Изобретение ячейки Даниэля
1839 Уильям Роберт Гроув (Великобритания) Изобретение топливного элемента (h3 / O2)
1859 Гастон Планте (Франция) Изобретение свинцово-кислотной батареи
1868 Жерож Лекланше (Франция) Изобретение Leclanché
элемент (углерод-цинк)
1899 Велдмар Юнгнер (Швеция) Изобретение
никель-кадмиевый аккумулятор
1901 Томас А. Эдисон (США) Изобретение
железно-никелевый аккумулятор
1932 Шлехт и Аккерман Изобретение
опорная плита из спеченного материала
1947 Neumann (Франция) Успешное опломбирование
никель-кадмиевый аккумулятор
1949 Лью Уир, Eveready Battery (США) Изобретение марганцево-щелочных металлов
аккумулятор
1970-е гг. Групповые усилия Разработка регулируемых клапанов
свинцово-кислотный аккумулятор
1990 Групповые усилия Коммерциализация никель-металлического
гидридная батарея
1991 Sony (Япония) Коммерциализация
литий-ионный аккумулятор
1996 Moli Energy (Канада) Введение литий-ионного аккумулятора
с марганцевым катодом
2005 Valence, система A123 (США) Введение литий-ионных аккумуляторов с
катод фосфатный
Иллюстрации от Cadex Electronics Inc.
Исидор Бухманн является основателем и генеральным директором Cadex Electronics Inc, канадской компании, специализирующейся на разработке и производстве современных инструментов для тестирования батарей.

 д.
д.