Катализатор | это… Что такое Катализатор?
У этого термина существуют и другие значения, см. Катализатор (значения).
Схема протекания реакции с катализатором
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Содержание
|
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3).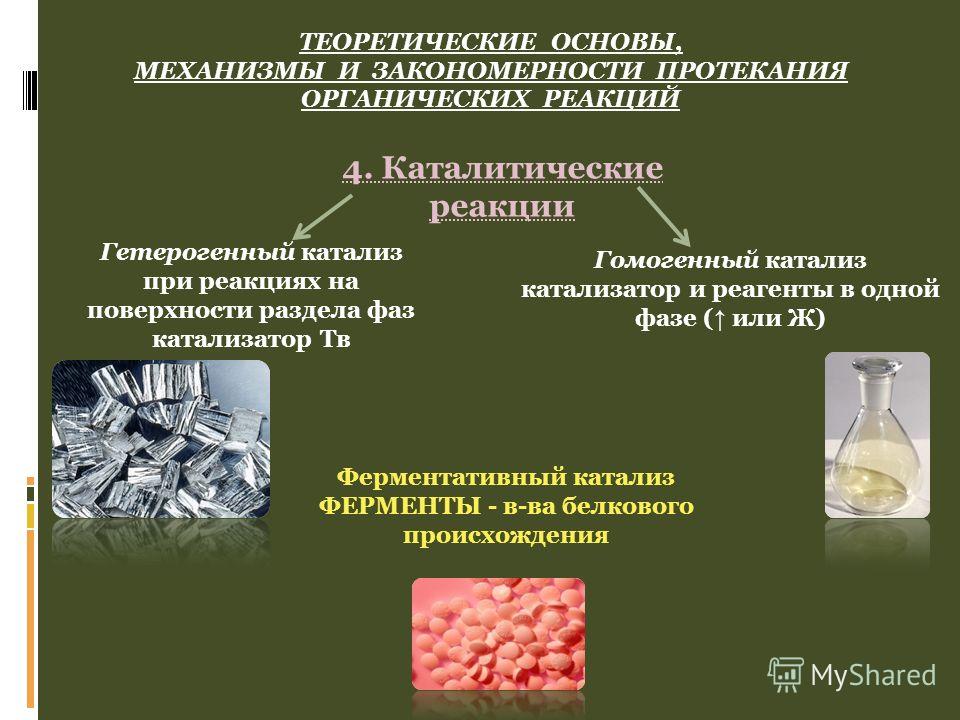 В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Основная статья: Каталитический конвертер
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
 [4]
[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
- Ингибитор
- Ферментативный ингибитор
- Активатор (катализ)
- Энергия активации
- Катализ
Ссылки
Разница между Катализатором и Реагентом
Основное различие между Катализатором и Реагентом состоит в том, что Катализаторы не расходуются во время химической реакции, тогда как Реагенты могут расходоваться во время химической реакции.
Катализатор и регент — два важных термина, которые часто используются в аналитической химии для описания химических реакций. Некоторые люди также используют два термина «реагент» и «реактив» взаимозаменяемо, хотя между ними есть небольшая разница. Катализатор представляет собой вещество, которое может увеличить скорость конкретной химической реакции, в то время как реагент представляет собой вещество или смесь для использования в химическом анализе или других реакциях.
Содержание
- Обзор и основные отличия
- Что такое Катализатор
- Что такое Реагент
- В чем разница между Катализатором и Реагентом
- Заключение
Что такое Катализатор?
Катализатор представляет собой вещество, которое может увеличить скорость реакции химической реакции. Процесс увеличения скорости реакции — это «катализ». Наиболее специфическим свойством катализатора является то, что химическая реакция не расходует катализаторы во время протекания реакции. Однако это вещество непосредственно участвует в реакции. Следовательно, это вещество рециркулирует, и его можно отделить от реакционной смеси, чтобы использовать его в другой реакции. Более того, нам нужно лишь небольшое количество катализатора для катализа химической реакции.
Однако это вещество непосредственно участвует в реакции. Следовательно, это вещество рециркулирует, и его можно отделить от реакционной смеси, чтобы использовать его в другой реакции. Более того, нам нужно лишь небольшое количество катализатора для катализа химической реакции.
Как правило, химические реакции происходят быстрее, когда есть катализатор. Это потому, что это вещество может обеспечить альтернативный путь реакции. Альтернативный путь всегда имеет более низкую энергию активации, чем обычный путь (который происходит в отсутствие катализатора). Кроме того, катализатор имеет тенденцию образовывать промежуточное соединение с реагентом, и он регенерирует позже. Напротив, если вещество снижает скорость реакции, оно называется ингибитором.
График, показывающий, как катализатор снижает энергию активации реакцииКатализаторы классифицируются как гомогенные или гетерогенные. Если он является гомогенным, то это означает, что катализатор и реагенты находятся в одной и той же фазе вещества (то есть в жидкой фазе). С другой стороны, если катализатор находится в фазе, отличной от фазы реагентов, то это гетерогенный катализатор. Здесь газообразные реагенты адсорбируются на твердой поверхности катализатора.
С другой стороны, если катализатор находится в фазе, отличной от фазы реагентов, то это гетерогенный катализатор. Здесь газообразные реагенты адсорбируются на твердой поверхности катализатора.
Что такое Реагент?
Реагент представляет собой вещество или смесь веществ для использования в химическом анализе или других реакциях. Это может быть либо катализатор, который увеличивает скорость реакции, либо реагент, который расходуется во время реакции.
Сера является исходным материалом для различных реакций синтеза, таким образом, это реагентЕсли вещество никак не может повлиять на химическую реакцию, то оно не может быть реагентом. Например, растворители, такие как вода, могут быть только средой для химической реакции, но не реагентом, потребляемым во время химической реакции, или катализатором, который увеличивает скорость реакции. Кроме того, реагенты представляют собой либо соединения, либо смеси.
В чем разница между Катализатором и Реагентом?
Катализатор представляет собой вещество, которое может увеличить скорость химической реакции, в то время как реагент представляет собой вещество или смесь для использования в химическом анализе или других реакциях. Основное различие между катализатором и реагентом состоит в том, что катализаторы не расходуются во время химической реакции, тогда как реагент может расходоваться во время химической реакции.
Основное различие между катализатором и реагентом состоит в том, что катализаторы не расходуются во время химической реакции, тогда как реагент может расходоваться во время химической реакции.
Кроме того, еще одно различие между катализатором и реагентом состоит в том, что катализаторы регенерируются после завершения химической реакции, в то время как реагенты могут регенерироваться, и могут не регенерироваться. Некоторые примеры катализаторов: железо — катализатор синтеза аммиака, цеолит — катализатор нефтеотдачи и т.д. Примеры реагентов: реактив Гриньяра, реактив Толлена, реактив Фелинга и т.д.
Основная информация — Катализатор против Реагента
Катализатор представляет собой вещество, которое может увеличить скорость химической реакции, в то время как реагент представляет собой вещество или смесь веществ для использования в химическом анализе или других реакциях. Основное различие между катализатором и реагентом состоит в том, что катализаторы не расходуются во время химической реакции, тогда как реагент может расходоваться во время химической реакции.
Химический катализатор – определение, реакция, типы и примеры
Катализатор химической реакции
Химический катализатор – это постороннее вещество, которое увеличивает скорость реакции за счет снижения энергии активации без изменения в конце химического или биологического процесса . Катализатор в химии можно просто определить как вещество, которое увеличивает скорость самой химической реакции, оставаясь неизменной по массе, активности и химическому составу.
Катализатор играет важную роль во многих химических и реальных биологических процессах и работает над поиском альтернативного пути, при котором энергия активации уменьшается, но кинетическая скорость реакции увеличивается.
Что такое катализ?
Явление, при котором катализаторы проявляют свою активность, определяется как реакция катализа в химии. Например, ион водорода действует как положительный катализатор при гидролизе сложного эфира или сахара, не влияя на химическое равновесие.
- Гомогенный катализ
- Гетерогенный катализ
Что такое отрицательный катализатор?
Иногда инородное вещество замедляет скорость процесса химического синтеза или даже останавливает реакцию, что называется отрицательным катализатором.
Но такое общее определение не полностью удовлетворяет отрицательным катализаторам, потому что отрицательные катализаторы иногда необратимо изменяют химический процесс. Поэтому такие вещества в химии правильно называют ингибитором. Например, серная кислота действует как ингибитор при разложении перекиси водорода.
Характеристики катализатора
Катализатор, используемый в реакции катализа, имеет некоторые общие и определенные характеристики в химии или химической науке.
Важнейшие характеристики катализатора остаются неизменными в виде молекулярной массы, плотности, концентрации и химической формулы составляющих элементов в конце реакции. Однако физическое состояние химических веществ, например размер частиц или цвет химического катализатора, может быть изменено.
Например, диоксид марганца, используемый для разложения хлората калия, после завершения химической реакции превращается в мелкодисперсный порошок.
Катализатор может увеличить скорость или скорость химических реакций. Он не может запустить реакцию, а только увеличивает или уменьшает скорость реакции.
Катализатор не влияет на конечное состояние химического равновесия. Это означает, что сам катализатор не расходуется во время химической реакции. Он регенерирует в конце реакции.
Например, 1,7 г платины производят 1,8 см3 кислорода в минуту при разложении перекиси водорода. Но платина остается активной даже при образовании 10 л кислорода в реакции катализа.
Как катализаторы влияют на равновесие?
Катализатор не влияет на конечное состояние равновесия, полученное из уравнения Вант-Гоффа,
ΔG 0 = − RT lnk
где k = константа равновесия свободной энергии, но увеличивает энтропию системы. Определение термодинамики или уравнение свободной энергии показывает тот факт, что катализатор не изменяет свободную энергию и константу равновесия химической реакции.
Константа равновесия,
k = k 1 /k 2
где k 1 и k 2 = скорость прямой и обратной реакции
Если катализатор увеличивает скорость прямого процесса или k 1 увеличивается, чтобы сохранить k постоянным, k 2 также увеличивается в той же степени.
Следовательно, катализаторы увеличивают скорость обоих типов, как прямой, так и обратной реакции, что способствует более быстрому достижению равновесия, но не влияет на равновесие по принципу Ле Шателье.
Каталитическое действие катализаторов
Исходя из определения и примера, катализаторы играют особую роль в конкретной каталитической реакции в науке. Поэтому мы не можем использовать один и тот же общий катализатор для каждого химического процесса.
Например, диоксид марганца может катализировать разложение хлората калия, но не нитрата калия.
Смена катализатора определяет характер химического продукта реакции в химии.
Например, монооксид углерода и водород в присутствии никелевого катализатора образуют газообразный метан, а в присутствии оксида цинка — молекулы метилового спирта.
| Химические реакции | химический катализатор |
| CO + H 2 → CH 4 + H 2 O | наличие Ni |
| CO + H 2 → CH 3 OH | наличие ZnO |
| HCOOH → H 2 + CO 2 | присутствие Cu или ZnO |
| HCOOH → H 2 O + CO | наличие Al 2 O 3 |
Оптимальная температура, при которой эффективность или роль природных катализаторов, таких как ферменты, наиболее заметна в химической науке и биологии.
В реакции биологического катализа каталитическое действие фермента увеличивается с повышением удельной теплоемкости или температуры. Но эффективность падает после определенной температуры из-за коагуляции фермента.
Но эффективность падает после определенной температуры из-за коагуляции фермента.
Типы катализаторов химической реакции
В реальной жизни наиболее распространенные химические катализаторы и катализируемые реакции делятся на два типа:
- гомогенный катализатор
- гетерогенный катализатор
Гомогенный катализатор
В реакциях гомогенного катализа катализатор образует одну фазу с реагентами. Многие гомогенные катализируемые реакции были изучены в газовой фазе и жидкой фазе.
Примеры гомогенного катализатора
Скорость реакции при гомогенном катализе неизменно пропорциональна концентрации катализатора.
Наиболее распространенными примерами таких катализирующих химических реакций в газовой фазе являются:
- Окисление диоксида серы до триоксида серы, катализируемое диоксидом азота.
- Разложение закиси азота на азот и кислород, катализируемое NO 2 .
- Разложение эфиров или ацетальдегида с помощью йодного катализатора.

В гетерогенном катализе химический катализатор и реагенты образуют отдельные фазы, и часто поверхность или поверхность раздела отвечают за каталитические свойства.
Гетерогенный катализатор
Реакции гетерогенного катализа означают, что твердое вещество служит катализатором, а реагенты представляют собой газообразные или жидкие фазы. Один или несколько из этих реагентов абсорбируются на поверхности твердого тела. Следовательно, поверхность обеспечивает альтернативный путь для снижения энергии активации или увеличения скорости реакции.
В большинстве реакций теплота адсорбции увеличивает энергию активации реагента, и равновесие достигается легко. Реакция твердого поверхностного катализатора состоит из четырех последовательных химических стадий,
- Диффузия газов на поверхность
- Адсорбция газов на поверхности
- Реакции на поверхности
- Десорбция или диффузия продуктов с поверхности в объем.
Процессы диффузии и десорбции очень быстрые и не играют существенной роли в реакциях гетерогенного катализа.
Пример гетерогенного катализатора
Каталитическая функция на поверхности катализаторов специфична по своей природе, и разные каталитические элементы эффективны для разных типов каталитических реакций.
| Гомогенная реакция | Примеры катализаторов |
| гидрирование/дегидрирование | Никель, медь, ZnO, Cr 2 O 3 |
| дегидратация/гидратация | Ал 2 О 3 |
| крекинг нефти | SiO 2 -Al 2 O 3 гель |
| синтез аммиака | железо |
| полимеризация | Al(Et) 3 , TiCl 4 |
Поверхности переходных металлов, такие как никель или медь, представляют собой очень хороший список гетерогенных поверхностей для гидрирования алкенов или олефинов.
Это связано с тем, что водород сильно поглощается поверхностью никелевого или медного катализатора, а молекулы воды сильно поглощаются поверхностью алюмооксидного катализатора.
Электрон является катализатором
Эберсон, Л. в Реакции переноса электрона в органической химии 172–189 (Springer, 1987).
Книга Google Scholar
Шанон, М. и Тобе, М.Л. Механистическая концепция неорганической и органической химии. Анжю. хим. Междунар. Эд . англ. 21 , 1–23 (1982).
Google Scholar
Баулд, Н.Л. в Достижения в химии переноса электронов Vol. 2 (изд. Мариано, PS) 1–66 (Джай, 1992).
Google Scholar
Ширакава, Э. Катализируемое одним электроном сочетание арилгалогенидов. Юкигосейкагаку-Кёкайси [Дж. Синтез. Орг. Chem.] 71 , 526–533 (2014).
Катализируемое одним электроном сочетание арилгалогенидов. Юкигосейкагаку-Кёкайси [Дж. Синтез. Орг. Chem.] 71 , 526–533 (2014).
Артикул Google Scholar
Карран, Д. П. Дизайн и применение цепных реакций свободных радикалов в органическом синтезе. Часть 1. Synthesis 417–439 (1988).
Карран, Д. П. Разработка и применение свободнорадикальных цепных реакций в органическом синтезе. Часть 2. Synthesis 489–513 (1988).
Робертс, Б. П. Катализ реакций отщепления атома водорода с обращением полярности: концепции и приложения в органической химии. Хим. соц. Ред. 28 , 25–35 (1999).
Артикул КАС Google Scholar
Buckel, W. & Golding, B.T. в Encyclopedia of Radicals in Chemistry, Biology and Materials Vol. 3 (ред. Чатгилиалоглу и К. Студер, А.) 1501–1546 (Wiley, 2012).
3 (ред. Чатгилиалоглу и К. Студер, А.) 1501–1546 (Wiley, 2012).
Google Scholar
Hawker, C.J., Bosman, A.W. & Harth, E. Синтез нового полимера с помощью живой радикальной полимеризации, опосредованной нитроксидом. Хим. Ред. 101 , 3661–3688 (2001).
Артикул КАС пабмед Google Scholar
Фишер, Х. Стойкий радикальный эффект: принцип селективных радикальных реакций и живой радикальной полимеризации. Хим. Ред. 101 , 3581–3610 (2001).
Артикул КАС пабмед Google Scholar
Штудер А. Стойкий радикальный эффект в органическом синтезе. Хим. Евро. J. 7 , 1159–1164 (2001).
Артикул КАС пабмед Google Scholar
Studer, A. Свободнорадикальная химия олова с использованием стойкого радикального эффекта: изомеризация алкоксиамина, реакции присоединения и полимеризации. Хим. соц. 33 , 267–273 (2004).
Свободнорадикальная химия олова с использованием стойкого радикального эффекта: изомеризация алкоксиамина, реакции присоединения и полимеризации. Хим. соц. 33 , 267–273 (2004).
Артикул КАС пабмед Google Scholar
Нараянам, Дж. М. Р. и Стивенсон, С. Р. Дж. Фотоокислительно-восстановительный катализ в видимом свете: применение в органическом синтезе. Хим. соц. 40 , 102–113 (2011).
Артикул КАС пабмед Google Scholar
Прайер, С.К., Ранкик, Д.А. и Макмиллан, Д.В.К. Фотоокислительно-восстановительный катализ в видимом свете с комплексами переходных металлов: применение в органическом синтезе. Хим. Откр. 113 , 5322–5363 (2013).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Карран, Д. П. Наконец-то свободен! Природа Хим. 4 , 958 (2012).
П. Наконец-то свободен! Природа Хим. 4 , 958 (2012).
Артикул КАС Google Scholar
Studer, A. & Curran, D.P. Органокатализ и активация C–H встречаются с реакциями переноса радикалов и электронов. Анжю. хим. Междунар. Эд. 50 , 5018–5022 (2011).
Артикул КАС Google Scholar
Giese, B. et al. Избыточный транспорт электронов через ДНК: один электрон восстанавливает более одного повреждения, вызванного УФ-излучением. Анжю. хим. Междунар. Эд. 43 , 1848–1851, (2004).
Артикул КАС Google Scholar
Borhani, D.W. & Greene, F.D. Триазолиндионы. Превращение в деаза-димеры с помощью катализа с переносом электрона. Возможная анион-радикальная реакция Дильса-Альдера. Ж. Орг. хим. 51 , 1563–1570 (1986).
51 , 1563–1570 (1986).
Артикул КАС Google Scholar
Алдер Р. В. Цепной катализ реакций замещения с переносом электронов. Хим. коммун. 1184–1186 (1980).
Баннетт, Дж. Ф. и Ким, Дж. К. Доказательства радикального механизма ароматического «нуклеофильного» замещения. Дж. Ам. хим. соц. 92 , 7463–7464 (1970).
Артикул КАС Google Scholar
Bardagí, JI, Vaillard, VA & Rossi, RA в Encyclopedia of Radicals in Chemistry, Biology and Materials Vol. 1 (ред. Чатгилиалоглу, К. и Студер, А.) 333–364 (Wiley, 2012).
Google Scholar
Budén, ME, Vaillard, VA, Martin, S.E. и Rossi, RA. Синтез карбазолов путем внутримолекулярного арилирования диариламидных анионов. Ж. Орг. хим. 74 , 4490–4498 (2009).
Ж. Орг. хим. 74 , 4490–4498 (2009).
Артикул пабмед КАС Google Scholar
Томе И., Бессон С., Кляйне Т. и Болм С. Катализируемый основаниями синтез замещенных индазолов в мягких условиях без переходных металлов. Анжю. хим. Междунар. Эд. 52 , 7509–7513 (2013).
Артикул КАС Google Scholar
Yanagisawa, S. & Itami, K. tert -Опосредованное бутоксидом арилирование связи C–H ароматических соединений галоаренами. ChemCatChem 3 , 827–829 (2011).
Артикул КАС Google Scholar
Ширакава Э. и Хаяши Т. Реакции сочетания арилгалогенидов без использования переходных металлов. Хим. лат. 41 , 130–134 (2012).
Артикул КАС Google Scholar
Чан, Т. Л., Ву, Ю., Чой, П. Ю. и Квонг, Ф. Ю. Радикальный процесс, направленный на развитие реакций образования ароматических углерод-углеродных связей без переходных металлов. Хим. Евро. J. 19 , 15802–15814 (2013).
Л., Ву, Ю., Чой, П. Ю. и Квонг, Ф. Ю. Радикальный процесс, направленный на развитие реакций образования ароматических углерод-углеродных связей без переходных металлов. Хим. Евро. J. 19 , 15802–15814 (2013).
Артикул КАС пабмед Google Scholar
Yanagisawa, S., Ueda, K., Taniguchi, T. & Itami, K. Калий t -бутоксид сам по себе может стимулировать биарильное связывание электронодефицитных азотных гетероциклов и галоаренов. Орг. лат. 10 , 4673–4676 (2008).
Артикул КАС пабмед Google Scholar
Вс, C-L. и другие. Эффективный органокаталитический метод конструирования биарилов путем активации ароматических C – H. Природа Хим. 2 , 1044–1049 (2010).
Артикул КАС Google Scholar
Shirakawa, E. , Itoh, K-I., Higashino, T. & Hayashi, T. Опосредованное трет-бутоксидом арилирование бензола арилгалогенидами в присутствии каталитического производного 1,10-фенантролина. Дж. Ам. хим. соц. 132 , 15537–15539 (2010).
, Itoh, K-I., Higashino, T. & Hayashi, T. Опосредованное трет-бутоксидом арилирование бензола арилгалогенидами в присутствии каталитического производного 1,10-фенантролина. Дж. Ам. хим. соц. 132 , 15537–15539 (2010).
Артикул КАС пабмед Google Scholar
Лю, В. и др. Органокатализ при кросс-сочетании: катализируемое ДМЭДА прямое С-Н арилирование неактивированного бензола. Дж. Ам. хим. соц. 132 , 16737–16740 (2010).
Артикул КАС пабмед Google Scholar
Бонин, Х., Сотье, М. и Фелпин, Ф-Х. Прямое C – H арилирование гетероаренов с участием переходных металлов с участием арильных радикалов. Доп. Синтез. Катал. 356 , 645–671 (2014).
Артикул КАС Google Scholar
Ширакава Э. и др. Кросс-сочетание арильных реагентов Гриньяра с арилиодидами и бромидами через путь SRN1. Анжю. хим. Междунар. Эд. 51 , 2198–221 (2012).
и др. Кросс-сочетание арильных реагентов Гриньяра с арилиодидами и бромидами через путь SRN1. Анжю. хим. Междунар. Эд. 51 , 2198–221 (2012).
Артикул КАС Google Scholar
Учияма, Н., Ширакава, Э. и Хаяси, Т. Перекрёстное взаимодействие Гриньяра, индуцированное переносом одного электрона, с участием ионных радикалов в качестве эксклюзивных промежуточных соединений. Хим. коммун. 49 , 364–366 (2013).
Артикул КАС Google Scholar
Ширакава Э., Ватанабэ Р., Мураками Т. и Хаяши Т. Реакция кросс-сочетания алкенилгалогенидов с арильными реагентами Гриньяра, индуцированная переносом одного электрона. Хим. коммун. 49 , 5219–5221 (2013).
Артикул КАС Google Scholar
Чжоу, С. и др. Органические доноры суперэлектронов: инициаторы взаимодействия галоаренов с аренами без переходных металлов. Хим. науч. 5 , 476–482 (2014).
Органические доноры суперэлектронов: инициаторы взаимодействия галоаренов с аренами без переходных металлов. Хим. науч. 5 , 476–482 (2014).
Артикул КАС Google Scholar
Чжао, Х., Шен, Дж., Го, Дж., Йе, Р. и Цзэн, Х. Маркоциклический ароматический пентамер пиридона в качестве высокоэффективного органического катализатора для прямого арилирования неактивированных аренов. Хим. коммун. 49 , 2323–2325 (2013).
Артикул КАС Google Scholar
Dewanji, A., Murarka, S., Curran, D.P. & Studer, A. Фенилгидразин в качестве инициатора прямого C–H-арилирования арена посредством гомолитического ароматического замещения, стимулируемого основанием. Орг. лат. 15 , 6102–6105 (2013).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Budén, ME, Guastavino, JF & Rossi, R. A. Фотоиндуцированное прямое C–H-арилирование при комнатной температуре посредством гомолитического ароматического замещения, стимулируемого основанием. Орг. лат. 15 , 1174–1177 (2013).
A. Фотоиндуцированное прямое C–H-арилирование при комнатной температуре посредством гомолитического ароматического замещения, стимулируемого основанием. Орг. лат. 15 , 1174–1177 (2013).
Артикул пабмед КАС Google Scholar
Shirakawa, E., Zhang, X. & Hayashi, T. Реакция типа Мизороки-Хека, опосредованная трет-бутоксидом калия. Анжю. хим. Междунар. Эд. 50 , 4671–4674 (2011).
Артикул КАС Google Scholar
Сун, С.-Л., Гу, Ю.-Ф., Ван, Б. и Ши, З.-Дж. Прямое арилирование алкенов арилиодидами/бромидами посредством органокаталитического радикального процесса. Хим. Евро. J. 17 , 10844–10847 (2011).
Артикул КАС пабмед Google Scholar
Рюпинг М., Лейендекер М., Дас А., Пуассон Т. и Буй Л. Калий трет- -бутоксидопосредованная циклизация/изомеризация бензофуранов по типу Хека из органокаталитических реакций радикального кросс-сочетания. Хим. коммун. 47 , 10629–10631 (2011).
и Буй Л. Калий трет- -бутоксидопосредованная циклизация/изомеризация бензофуранов по типу Хека из органокаталитических реакций радикального кросс-сочетания. Хим. коммун. 47 , 10629–10631 (2011).
Артикул КАС Google Scholar
Ли, Си Джей. Кросс-дегидрогенизирующее связывание (CDC): изучение образования связей C-C помимо превращений функциональных групп. Согл. хим. Рез. 42 , 335–344 (2009).
Артикул КАС пабмед Google Scholar
Йенг, К. С. и Донг, В. М., Каталитическая дегидрогенная перекрестная связь: образование углерод-углеродных связей путем окисления двух углерод-водородных связей. Хим. Ред. 111 , 1215–1292 (2011).
Артикул КАС пабмед Google Scholar
Wu, Y. , Wang, J., Mao, F. & Kwong, F.Y. Катализируемая палладием кросс-дегидрогенизирующая функционализация C( sp 2 )–Н связи. Хим. азиатский. J. 9 , 26–47 (2014).
, Wang, J., Mao, F. & Kwong, F.Y. Катализируемая палладием кросс-дегидрогенизирующая функционализация C( sp 2 )–Н связи. Хим. азиатский. J. 9 , 26–47 (2014).
Артикул КАС пабмед Google Scholar
Жирар, С. А., Кнаубер, Т. и Ли, К.-Дж. Кросс-дегидрогенизирующее связывание связей Csp3–H: универсальная стратегия образования связи C–C. Анжю. хим. Междунар. Эд. 53 , 74–100 (2014).
Артикул КАС Google Scholar
Wertz, S., Leifert, D. & Studer, A. Перекрестное дегидрирование посредством гомолитического ароматического замещения, промотируемого основаниями (BHAS): синтез флуоренонов и ксантонов. Орг. лат. 15 , 928–931 (2013).
Артикул КАС пабмед Google Scholar
Ши, З. и Глориус, Ф. Синтез флуоренонов посредством внутримолекулярного дегидрогенативного арилирования альдегидов, стимулируемого солью четвертичного аммония. Хим. науч. 4 , 829–833 (2013).
и Глориус, Ф. Синтез флуоренонов посредством внутримолекулярного дегидрогенативного арилирования альдегидов, стимулируемого солью четвертичного аммония. Хим. науч. 4 , 829–833 (2013).
Артикул КАС Google Scholar
Финкбайнер П. и Нахтсхайм Б. Дж. Йод в современном окислительном катализе. Synthesis 45 , 979–999 (2013).
Артикул КАС Google Scholar
Leifert, D., Daniliuc, C.G. & Studer, A. 6-Ароилированные фенантридины посредством гомолитического ароматического замещения, промотированного основанием (BHAS). Орг. лат. 15 , 6286–6289 (2013).
Артикул КАС пабмед Google Scholar
Ryu, I., Sonoda, N. & Curran, D.P. Тандемные радикальные реакции монооксида углерода, изонитрилов и других реагентов, эквивалентных геминальным радикальным акцепторам/радикальным предшественникам синтона. Хим. 96 , 177–194 (1996).
Хим. 96 , 177–194 (1996).
Артикул КАС пабмед Google Scholar
Spagnolo, P. & Nanni, D. в Encyclopedia of Radicals in Chemistry, Biology and Materials Vol. 2 (ред. Чатгилиалоглу, К. и Студер, А.) 1019–1057 (Wiley, 2012).
Google Scholar
Эйзенбергер П., Гишиг С. и Тони А. Новые соединения на основе гипервалентного йода 10-I-3 для электрофильного трифторметилирования. Хим. Евро. J. 12 , 2579–2586 (2006).
Артикул КАС пабмед Google Scholar
Вин М.С., Виноградова Е.В., Тони А. Электрофильное трифторметилирование аренов и N-гетероаренов с использованием реагентов гипервалентного йода. J. Fluorine Chem. 131 , 951–957 (2010).
Артикул КАС Google Scholar
Матусек, В.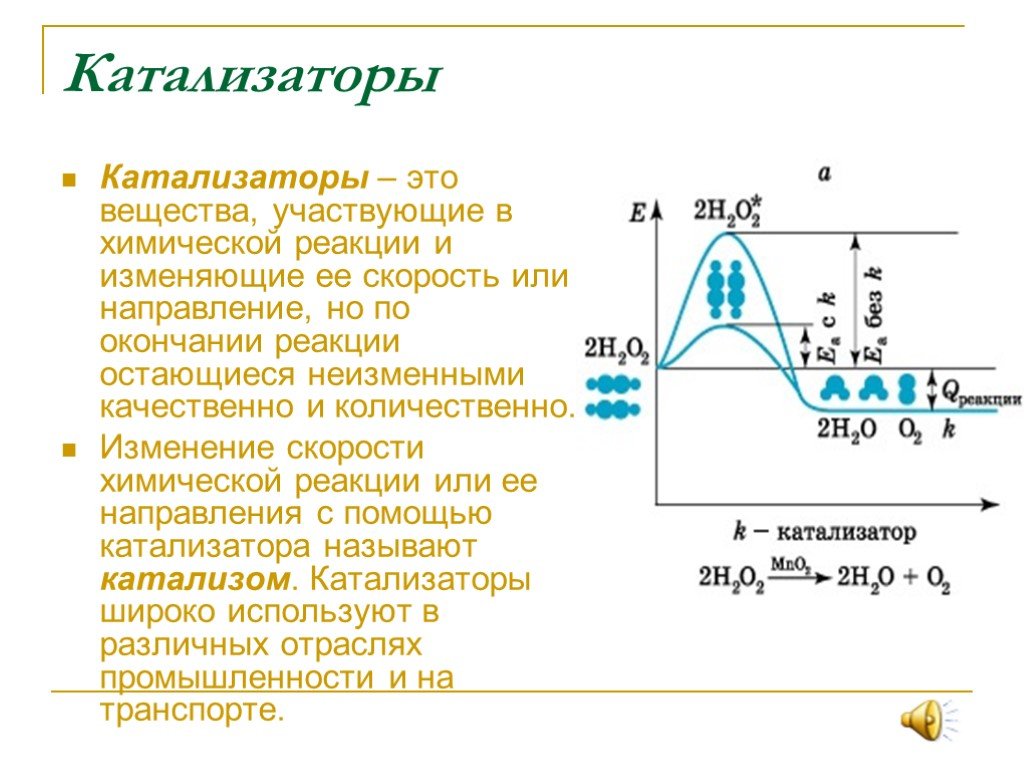 , Тони, А., Бизе, В. и Кахард, Д. Синтез α-CF3-замещенных карбонильных соединений с относительным и абсолютным стереоконтролем с использованием электрофильных реагентов для переноса CF3. Орг. лат. 13 , 5762–5765 (2011).
, Тони, А., Бизе, В. и Кахард, Д. Синтез α-CF3-замещенных карбонильных соединений с относительным и абсолютным стереоконтролем с использованием электрофильных реагентов для переноса CF3. Орг. лат. 13 , 5762–5765 (2011).
Артикул КАС пабмед Google Scholar
Zhang, B., Mück-Lichtenfeld, C., Daniliuc, C.G. & Studer, A. 6-Трифторметилфенантридины путем радикального трифторметилирования изонитрилов. Анжю. хим. Междунар. Эд. 52 , 10792–10795 (2013).
Артикул КАС Google Scholar
Wang, Q., Dong, X., Xiao, T. & Zhou, L. PhI(OAc)2-опосредованный синтез 6-(трифторметил)фенантридинов путем окислительной циклизации 2-изоцианобифенилов с CF3SiMe3 в присутствии металла- бесплатные условия. Орг. лат. 15 , 4846–4849 (2013).
Артикул КАС пабмед Google Scholar
Штудер А. «Возрождение» радикального трифторметилирования. Анжю. хим. Междунар. Эд. 51 , 8950–8958 (2012).
«Возрождение» радикального трифторметилирования. Анжю. хим. Междунар. Эд. 51 , 8950–8958 (2012).
Артикул КАС Google Scholar
Ji, Y. et al. Врожденное C–H трифторметилирование гетероциклов. Проц. Натл акад. науч. США 108 , 14411–14415 (2011).
Артикул КАС пабмед ПабМед Центральный Google Scholar
Zhang, H. et al. Алкоксикарбонилирование арилгалогенидов без переходных металлов. Анжю. хим. Междунар. Эд. 51 , 12542–12545 (2012).
Артикул КАС Google Scholar
Чатгилиалоглу С., Крич Д., Комацу М. и Рю И. Химия ацильных радикалов. Хим. Ред. 99 , 1991–2069 (1999).
Артикул КАС пабмед Google Scholar
Мацубара, Х. , Фальзон, С. Т., Рю, И. и Шиссер, С. Х. Радикал, маскирующийся под электрофилы: компьютерное исследование реакций внутримолекулярного присоединения арильных радикалов к иминам. Орг. биомол. хим. 4 , 1920–1926 (2006).
, Фальзон, С. Т., Рю, И. и Шиссер, С. Х. Радикал, маскирующийся под электрофилы: компьютерное исследование реакций внутримолекулярного присоединения арильных радикалов к иминам. Орг. биомол. хим. 4 , 1920–1926 (2006).
Артикул КАС пабмед Google Scholar
Saveant, J.M. Катализ химических реакций электродами. Согл. хим. Рез. 13 , 323–329 (1980).
Артикул КАС Google Scholar
Франке Р. и Литтл Р. Д. Окислительно-восстановительный катализ в органическом электросинтезе: основные принципы и последние разработки. Хим. соц. Ред. 43 , 2492–2521 (2014).
Артикул КАС пабмед Google Scholar
Уэйд, П. А., Моррисон, Х. А. и Корнблюм, Н. Влияние света на замещение с переносом электрона у насыщенного атома углерода.
