Сера. Химия серы и ее соединений
1. Положение серы в периодической системе химических элементов
2. Электронное строение атома серы
3. Физические свойства и нахождение в природе
4. Соединения серы
5. Способы получения
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с галогенами
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с окислителями
6.2.2. Взаимодействие с щелочами
Сероводород
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
3.4. Взаимодействие с солями тяжелых металлов
Сульфиды
Химические свойства сульфидов
Оксиды серы
1. Оксид серы (IV)
Оксид серы (IV)
2. Оксид серы (VI)
Серная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация серной кислоты
3.2. Основные свойства серной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с солями
3.6. Качественная реакция на сульфат-ионы
3.7. Окислительные свойства серной кислоты
Сернистая кислота
Соли серной кислоты – сульфаты
Сера
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии:
Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:
Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:
Электронная конфигурация серы во втором возбужденном состоянии:
Таким образом, максимальная валентность серы в соединениях равна
Степени окисления атома серы – от -2 до +4. Характерные степени окисления -2, 0, +4, +6.
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета.
Это хрупкое вещество желтого цвета.
Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны». Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96оС, а при обычной температуре превращающееся в ромбическую серу.
Пластическая сера – это вещество, состоящее из длинных полимерных цепей. Коричневая резиноподобная аморфная масса, нерастворимая в воде.
В природе сера встречается:
- в самородном виде;
- в составе сульфидов (сульфид цинка ZnS, пирит FeS2, сульфид ртути HgS — киноварь и др.)
- в составе сульфатов (CaSO4·2H2O гипс, Na2SO4·10H2O — глауберова соль)
Соединения серы
Типичные соединения серы:
| Степень окисления | Типичные соединения |
| +6 | Оксид серы(VI) SO3 Серная кислота H2SO4 Сульфаты MeSO4 Галогенангидриды: SО2Cl2 |
| +4 | Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты MeSO Гидросульфиты MeHSO3 Галогенангидриды: SOCl2 |
| –2 | Сероводород H2S Сульфиды металлов MeS |
Способы получения серы
1.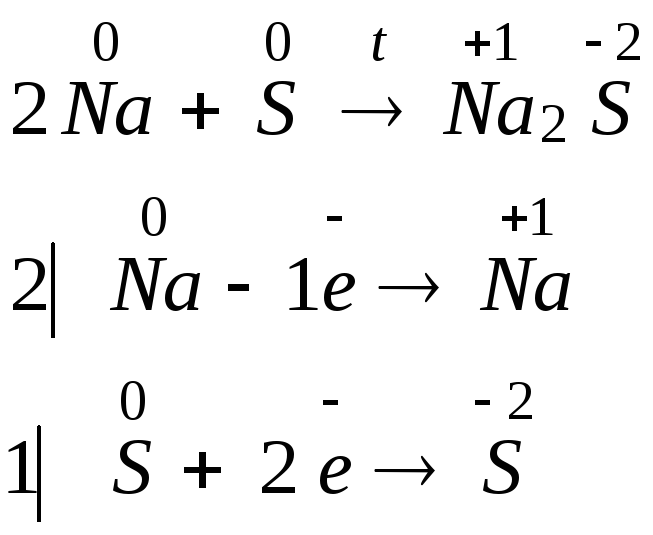 В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара.
В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара.
2. Способ получения серы в лаборатории – неполное окисление сероводорода.
2H2S + O2 → 2S + 2H2O
3. Еще один способ получения серы – взаимодействие сероводорода с оксидом серы (IV):
2H2S + SO2 → 3S + 2H2O
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1. При горении серы на воздухе образуется оксид серы (IV):
S + O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2P + 3S → P2S3
2P + 5S → P2S5
2S + C → CS2
1. 4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S + 2Al → Al2S3
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
S + H2 → H2S
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например, азотная кислота окисляет серу до серной кислоты:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
Серная кислота также окисляет серу. Но, поскольку S+6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2H2SO4 → 3SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
S + Na2SO3 → Na2S2O3
2. 2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S + NaOH → Na2SO3 + Na2S + H2O
При взаимодействии с перегретым паром сера диспропорционирует:
S + H2O (пар) → 2H2S + SO2
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.
Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.
Способы получения сероводорода
В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц. ) → S + 2NO2 + 2H2O
) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц. ) → S + SO2 + 2H2O
) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сульфиды
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
| Растворимые в воде | Нерастворимые в воде, но растворимые в минеральных кислотах | Нерастворимые ни в воде, ни в минеральных кислотах (только в азотной и серной конц.) | Разлагаемые водой, в растворе не существуют |
| Сульфиды щелочных металлов и аммония | Сульфиды прочих металлов, расположенных до железа в ряду активности. Белые и цветные сульфиды (ZnS, MnS, FeS, CdS) | Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS) | Сульфиды трехвалентных металлов (алюминия и хрома (III)) |
| Реагируют с минеральными кислотами с образованием сероводорода | Не реагируют с минеральными кислотами, сероводород получить напрямую нельзя | Разлагаются водой
| |
| ZnS + 2HCl → ZnCl2 + H2S | Al2S3 + 6H2O → 2Al(OH)3 + 3H2S | ||
Способы получения сульфидов
1. Сульфиды получают при взаимодействии серы с металлами. При этом сера проявляет свойства окислителя.
Сульфиды получают при взаимодействии серы с металлами. При этом сера проявляет свойства окислителя.
Например, сера взаимодействует с магнием и кальцием:
S + Mg → MgS
S + Ca → CaS
Сера взаимодействует с натрием:
S + 2Na → Na2S
2. Растворимые сульфиды можно получить при взаимодействии сероводорода и щелочей.
Например, гидроксида калия с сероводородом:
H2S + 2KOH → K2S + 2H2O
3. Нерастворимые сульфиды получают взаимодействием растворимых сульфидов с солями (любые сульфиды) или взаимодействием сероводорода с солями (только черные сульфиды).
Например, при взаимодействии нитрата меди и сероводорода:
Pb(NO3)2 + Н2S → 2НNO3 + PbS
Еще пример: взаимодействие сульфата цинка с сульфидом натрия:
ZnSO4 + Na2S → Na2SO4 + ZnS
Химические свойства сульфидов
1. Растворимые сульфиды гидролизуются по аниону, среда водных растворов сульфидов щелочная:
Растворимые сульфиды гидролизуются по аниону, среда водных растворов сульфидов щелочная:
K2S + H2O ⇄ KHS + KOH
S2– + H2O ⇄ HS– + OH–
2. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
Например, сульфид кальция растворяется в соляной кислоте:
CaS + 2HCl → CaCl2 + H2S
А сульфид никеля, например, не растворяется:
NiS + HСl ≠
3. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого вещества, либо до сульфата.
Например, сульфид меди (II) растворяется в горячей концентрированной азотной кислоте:
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
или горячей концентрированной серной кислоте:
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
гор.) → CuSO4 + 4SO2 + 4H2O
4. Сульфиды проявляют восстановительные свойства и окисляются пероксидом водорода, хлором и другими окислителями.
Например, сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS + 4H2O2 → PbSO4 + 4H2O
Еще пример: сульфид меди (II) окисляется хлором:
СuS + Cl2 → CuCl2 + S
5. Сульфиды горят (обжиг сульфидов). При этом образуются оксиды металла и серы (IV).
Например, сульфид меди (II) окисляется кислородом до оксида меди (II) и оксида серы (IV):
2CuS + 3O2 → 2CuO + 2SO2
Аналогично сульфид хрома (III) и сульфид цинка:
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
2ZnS + 3O2 → 2SO2 + ZnO
6. Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−.
Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−.
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
7. Сульфиды трехвалентных металлов (алюминия и хрома) разлагаются водой (необратимый гидролиз).
Например, сульфид алюминия разлагается до гидроксида алюминия и сероводорода:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Разложение происходит и взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
Например, сульфид натрия реагирует с хлоридом алюминия в растворе. Но сульфид алюминия не образуется, а сразу же необратимо гидролизуется (разлагается) водой:
3Na2S + 2AlCl3 + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
Оксиды серы
| Оксиды серы | Цвет | Фаза | Характер оксида |
| SO2 Оксид сера (IV), сернистый газ | бесцветный | газ | кислотный |
| SO3 Оксид серы (VI), серный ангидрид | бесцветный | жидкость | кислотный |
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV):
1. Сжигание серы на воздухе:
Сжигание серы на воздухе:
S + O2 → SO2
2. Горение сульфидов и сероводорода:
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например, сульфит натрия взаимодействует с серной кислотой:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
4. Обработка концентрированной серной кислотой неактивных металлов.
Например, взаимодействие меди с концентрированной серной кислотой:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя.
За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов.
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 + 2NaOH(изб) → Na2SO3 + H2O
SO2(изб) + NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 + Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 + H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 + O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 + 2HNO3 → H2SO4 + 2NO2
Озон также окисляет оксид серы (IV):
SO2 + O3 → SO3 + O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 + PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 + 2Н2S → 3S + 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
SO2 + С → S + СO2
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
2SO2 + O2 ↔ 2SO3
Сернистый газ окисляют и другие окислители, например, озон или оксид азота (IV):
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
2. Серный ангидрид является типичным кислотным оксидом, взаимодействует с щелочами и основными оксидами.
Например, оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3 + NaOH(избыток) → NaHSO4
Еще пример: оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.

- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв. ) + H2SO4 → NaHSO4 + HCl
) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц. ) + Hg → HgSO4 + SO2 ↑ + 2H2O
) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц. ) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Сернистая кислота
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
H2SO3 ↔ HSO3– + H+
HSO3– ↔ SO32– + H+
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
H2SO3 ↔ SO2 + H2O
Соли серной кислоты – сульфаты
Серная кислота образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
1. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
2. Сульфаты таких металлов, как медь Cu, алюминий Al, цинк Zn, хром Cr, железо (II) Fe подвергаются термическому разложению на оксид металла, диоксид серы SO2 и кислород O2;
2CuSO4 → 2CuO + SO2 + O2 (SO3)
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2ZnSO4 → 2ZnO + SO2 + O2
2Cr2(SO4)3 → 2Cr2O3 + 6SO2 + 3O2
При разложении сульфата железа (II) в FeSO4 Fe (II) окисляется до Fe (III)
4FeSO4 → 2Fe2O3 + 4SO2 + O2
Сульфаты самых тяжелых металлов разлагаются до металла.
3. За счет серы со степенью окисления +6 сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями.
Например, сульфат кальция при сплавлении реагирует с углеродом с образованием сульфида кальция и угарного газа:
CaSO4 + 4C → CaS + 4CO
4. Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова соль
CaSO4 ∙ 2H2O − гипс
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O − кристаллическая сода
Сульфид натрия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Хромат натрия, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Сернистый натрий
Сернистый натрий
ГОСТ 2053-77 или ГОСТ 596-89
Na2S
Сульфид натрия (сернистый натрий) — сложное неорганическое вещество с химической формулой Na2S.
сульфид натрия представляет собой монолитную массу, чешуйки или гранулы которые по цвету могут варьироваться от светло-коричневых до темно-коричневых. Сульфид натрия хорошо растворяется в воде, его соприкосновение с кислотами вызывает выделение сероводорода, горючего взрывоопасного газа.
Сульфид натрия — бескислородная соль. В обычном состоянии — порошок белого цвета, очень гигроскопичный. Плавится без разложения, термически устойчивый. Технический сульфид натрия желтоватый или коричневатый(красноватый) содержит в себе до 60 % сульфида натрия. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
Получение сульфида натрия (сернистого натрия)
В промышленности — прокаливание минерала мирабилит Na2SO4 · 10H2O.
Химические свойства сульфида натрия (сернистого натрия)
Взаимодействует с разбавленной соляной кислотой:
Взаимодействует с концентрированной серной кислотой:
Реагирует с водным раствором перманганата калия:
В реакции с йодом оседает чистая сера:
Применение сульфида натрия (сернистого натрия)
Сульфид натрия применяется в техническом виде для операций металлургического, легкого, химического и другого отраслевого производства. В частности при помощи сульфида натрия производятся сернистые красители и целлюлоза. Используется как компонент для флотации цинковой и цинково-свинцово-железистых руд. В зависимости от марки и вида (гранулы или чешуйки) сульфид натрия может использоваться в различных процессах, в частности марка А применяется на предприятиях по производству изделий из кожи и текстиля, а марка В является незаменимым компонентом для некоторых линий производства цветного металлопроката.
Используется как компонент для флотации цинковой и цинково-свинцово-железистых руд. В зависимости от марки и вида (гранулы или чешуйки) сульфид натрия может использоваться в различных процессах, в частности марка А применяется на предприятиях по производству изделий из кожи и текстиля, а марка В является незаменимым компонентом для некоторых линий производства цветного металлопроката.
Сульфид натрия применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии.
Сульфид натрия ядовит.
Занимательная химия
Бегающий натрий
Взаимодействие натрия с водой сопровождается щелчками. Почему?
При контакте с водой металлический натрий (как и другие щелочные металлы) окисляется; выделяется газообразный водород, а в растворе появляется гидроксид натрия:
2Na
+ 2Н2О = 2NaOH
+ Н2↑.
Эта реакция сопровождается большим тепловыделением, так что натрий плавится. При этом плотность расплавленного металла меньше плотности воды, поэтому капелька расплавленного натрия бегает по поверхности воды: ее подталкивают пузырьки выделяющегося водорода то в одну, то в другую сторону; лопающиеся пузырьки водорода и создают звуковой эффект реакции.
Ртуть — пошница
Можно ли получить металлический натрий при электролизе водного раствора хлорида натрия NaCl? He спешите с ответом: натрий энергично взаимодействует с водой, выделяя из нее водород…
Получение натрия возможно, если катодом будет все время обновляемая
ртуть
Hg. Тогда выделяющийся на ртути натрий тотчас же будет в ней растворяться,
образуя амальгаму:
Тогда выделяющийся на ртути натрий тотчас же будет в ней растворяться,
образуя амальгаму:
Na+ + e— = Na°; Na + Hg = Na(Hg).
Амальгама, вытекая из электролизера, попадает в перегонную установку, где ртуть отгоняется, конденсируется в жидкость и возвращается в электролизер. Натрий, температура кипения которого намного выше, чем ртути, остается в кубе перегонной установки, откуда и извлекается.
Растворите серу в воде
При комнатной температуре сера практически нерастворима в чистой воде, однако при высокой температуре она взаимодействует с перегретым водяным паром:
3S + 2Н2О = 2H2S↑ + SO2↑.
Если долго кипятить серу в растворе гидроксида натрия NaOH, то тоже происходит окислительно-восстановительная реакция диспропорционирования, в которой одни атомы серы отдают, а другие — принимают электроны:
3S + 6NaOH = Na2SO3 + 2Na2S + 3Н2О.
Получаемые в результате реакции сульфит натрия Na2SO3 и сульфид натрия Na2S отлично растворяются в воде. Кипячение серы в водном растворе сульфида натрия или сульфита натрия тоже приводит к образованию растворимых веществ — дисульфида натрия Na2S2:
Na2S + S = Na2S2
или тиосульфата натрия Na2SO3S:
Na2SO3 + S = Na2SO3S.
Легкость образования этих соединений объясняется способностью серы к «катенации» — образованию цепочек атомов —S—…— S—.
Красный сульфат бария?
К фиолетовому водному раствору перманганата калия КМnО4, содержащему сульфат калия K2SO4, добавили водный раствор хлорида бария ВаС12. Ко всеобщему удивлению, из раствора выпал красный осадок, хотя известно, что сульфат бария белый.
При сливании растворов протекала реакция осаждения сульфата бария:
K2SO4 + BaCl2 = BaSO4↓ + 2KС1.
Присутствие КМnО4 вызвало равномерное распределение ионов этого вещества по всему объему каждого образовавшегося кристаллика осадка из-за изоморфизма КМnО4 и BaSO4. Осадок представлял собой не чистый BaSO4, а твердый раствор на его основе, где часть анионов SO2- замещена на анионы МnО4, а часть катионов Ва2+ — на катионы K+. Поэтому такой осадок не обесцвечивается даже при самой тщательной промывке.
Удобный способ
Однажды на лекции демонстрировался опыт: плавление серы в пробирке. Вдруг все почувствовали отвратительный запах. Лекция была сорвана. «В чем дело?…» — недоумевал профессор.
Все оказалось просто: в пробирку с серой попали кусочки парафина с пробковой крышки склянки, в которой хранился порошок серы. Смесь парафина — предельного углеводорода с примерной формулой С20Н42 — и серы при нагревании выделяет сероводород H2S:
C20H42 + 21S = 21H2S↓ + 20C.
Чем сильнее нагревается смесь, тем в больших количествах происходит выделение газа. Если прекратить нагревание, то реакция останавливается и сероводород не выделяется. Поэтому реакция очень удобна для получения сероводорода в учебных лабораториях.
Ацетон из ацетата
Студент решил побыстрее высушить ацетат кальция Са(СН3СОО)2. Фарфоровую чашку с веществом он поставил в нагретую муфельную печь, не погасив стоящую рядом газовую горелку. Произошла вспышка, и из муфеля выбросило язык пламени, опаливший лицо студента…
При сильном нагревании ацетата кальция образуется ацетон, который очень летуч и легко воспламеняется:
Ca(CH3COO)2 = (CH3)2CO↑ + CaCO3.
В чистом состоянии ацетон — бесцветная низкокипящая жидкость, имеющая своеобразный запах. По своему строению ацетон — простейший кетон. Приведенная здесь реакция использовалась раньше для получения ацетона.
Остановленный эксперимент
Лаборанта попросили высушить для предстоящего синтеза этиловый спирт. Недолго думая, тот налил спирт в колбу и хотел добавить концентрированную серную кислоту: зная серную кислоту как обезвоживающее средство, лаборант решил, что она свяжет воду, а спирт из смеси можно будет без помехи отогнать и собрать уже «сухим». Почему коллеги не дали лаборанту осуществить его намерения?
Если бы лаборант выполнил задуманные операции, то был бы неизбежен несчастный случай из-за перегрева перегонной установки, что грозило взрывом; кроме того, существовала реальная угроза потери лаборантом сознания. Дело в том, что серная кислота действительно отнимает воду у спирта, причем не только присутствующую в его растворе как примесь, но и химически связанную; спирт превращается в диэтиловый эфир:
2С2Н5ОН = (С2Н5)2О + Н2О.
Диэтиловый эфир, в быту называемый просто эфиром, имеет температуру кипения около 35°С и легко воспламеняется. Он обладает также наркотическим действием, и поэтому раньше его применяли в качестве наркоза. Эфир нельзя долго хранить на свету при соприкосновении с воздухом: в нем образуются органические пероксидные соединения, способные взрываться.
«Бессеребреники»
Известно, что главной составной частью фотоматериалов служат галогениды серебра. Существуют ли светочувствительные составы-«бессребреники»?
В процессах копирования, особенно в полиграфии для изготовления печатных форм, широко применяют бессеребряные светочувствительные материалы. Они чаще всего содержат дихроматы аммония, натрия или калия и органические клеящие вещества — желатин, альбумин, шеллак или коллаген. Правда, светочувствительность таких материалов невелика и хорошо проявляется только под действием синих, фиолетовых или ультрафиолетовых лучей. Суть процесса в том, что желатин или заменяющие его органические вещества теряют способность к набуханию на тех участках, где материал подвергался освещению. Причина этого в г Том, что, например, дихромат аммония (NH4)2Cr2O7 под действием света и только в присутствии перечисленных органических веществ переходит в соединение хрома (III) — сульфат хрома Cr2(
Взаимодействие натрия и серы при растирании
В фарфоровую ступку насыпьте примерно три столовых ложки серы. Если сера у вас в виде комочков — разотрите ее. Возьмите кусочек натрия размером примерно 5 х 5 х 15 мм, промокните его от масла фильтровальной бумагой и разрежьте на несколько частей.
Кусочки натрия положите в ступку и сильными движениями разотрите содержимое. Через некоторое время начнется потрескивание, появятся желтые искры. Продолжите растирание. Реакция пойдет активнее — смесь вспыхнет, во все стороны полетят расплавленные капельки натрия и серы. Пламя будет то затухать, то вспыхивать с новой силой. Эксперимент длится несколько минут.
Иногда бывает, что, несмотря на активное растирание, реакция не начинается. В таких случаях пестик следует слегка смочить водой.
Техника безопасности. Эксперимент выполняют в маске из оргстекла для защиты глаз и лица от горящих брызг натрия и серы. Руку, в который вы держите пестик, обматывают полотенцем (как показано на фотографии) — это предохранит от возможных ожогов. В ходе эксперимента образуется много сернистого газа, поэтому реакцию проводят под вытяжкой или на свежем воздухе.
Опыт требует строгих мер противопожарной безопасности. Фарфоровую ступку ставят на кафельную плитку или большой металлический лист. Поблизости не должно быть никаких легковоспламеняющихся предметов, поскольку он непременно загорятся от брызг натрия и серы. Держите наготове воду, чтобы гасить возможные возгорания окружающих предметов, но если реакция выйдет из-под контроля помните, что воду ни в коем случае нельзя лить в горящую смесь — это может привести к сильной вспышке или взрыву.
После реакции в ступке могут остаться капельки натрия. Чтобы их обезвредить ждут полного охлаждения, потом добавляют в ступку воду при осторожном растирании длинной деревянной палочкой (защитная маска!).
Источник www.chemistry-chemists.com
Руководство по актуальной дозировке сульфацетамида натрия / серы и меры предосторожности
Проверено с медицинской точки зрения Drugs.com. Последнее обновление: 7 сентября 2020 г.
Применимо к следующей силе: 10% -5%; 10% -1%; 10% -2%; 9,5% -5%; 10% -5% со смягчающими веществами; 10% -4%; 9% -4%; 8% -4%; 9% -4,5%; 9,8% -4,8%; 10% -4% с очищающим средством; 9% -4,5% с очищающим средством; 10% -4,5%
Обычная доза для взрослых для:
Обычная детская доза для:
Дополнительная информация о дозировке:
Обычная доза для взрослых от прыщей
Сульфацетамид натрия-сера для местного применения 8% -4% суспензия :
1-2 раза в день, влажная кожа и работа до полной пены.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4,5% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -1% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -4% пена для местного применения :
Вымойте пораженный участок. Втирайте пену в пораженный участок 1-2 раза в день. При удалении смойте через 1-2 минуты.
Сульфацетамид натрия-сера местный 10% -4% местный тампон :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -5% пена для местного применения :
Тщательно очистите и высушите полотенцем.Втирайте пену в пораженный участок от 1 до 3 раз в день.
Сульфацетамид натрия-сера местный 10% -5% местный тампон :
1-2 раза в день, влажная ткань и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите. Выбросьте ткань.
Обычная доза для взрослых для акне, розацеа
Сульфацетамид натрия-сера для местного применения 8% -4% суспензия :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд.Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4,5% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -1% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -4% пена для местного применения :
Вымойте пораженный участок. Втирайте пену в пораженный участок 1-2 раза в день. При удалении смойте через 1-2 минуты.
Сульфацетамид натрия-сера местный 10% -4% местный тампон :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -5% пена для местного применения :
Тщательно очистите и высушите полотенцем.Втирайте пену в пораженный участок от 1 до 3 раз в день.
Сульфацетамид натрия-сера местный 10% -5% местный тампон :
1-2 раза в день, влажная ткань и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите. Выбросьте ткань.
Обычная доза для взрослых при себорейном дерматите
Сульфацетамид натрия-сера для местного применения 8% -4% суспензия :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд.Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4,5% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -1% жидкость для местного применения :
1-2 раза в день, влажная кожа и работа до полной пены.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -4% пена для местного применения :
Вымойте пораженный участок. Втирайте пену в пораженный участок 1-2 раза в день. При удалении смойте через 1-2 минуты.
Сульфацетамид натрия-сера местный 10% -4% местный тампон :
1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -5% пена для местного применения :
Тщательно очистите и высушите полотенцем.Втирайте пену в пораженный участок от 1 до 3 раз в день.
Сульфацетамид натрия-сера местный 10% -5% местный тампон :
1-2 раза в день, влажная ткань и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите. Выбросьте ткань.
Обычная детская доза от прыщей
Сульфацетамид натрия-сера для местного применения 8% -4% суспензия :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд.Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4,5% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -1% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и втирайте в полную пену.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -4% пена для местного применения :
12 лет и старше: Промыть пораженный участок. Втирайте пену в пораженный участок 1-2 раза в день. При удалении смойте через 1-2 минуты.
Сульфацетамид натрия-сера местный 10% -4% местный тампон :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -5% пена для местного применения :
12 лет и старше: Тщательно очистите и высушите полотенцем.Втирайте пену в пораженный участок от 1 до 3 раз в день.
Сульфацетамид натрия-сера местный 10% -5% местный тампон :
12 лет и старше: 1-2 раза в день, влажная ткань и втирайте до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите. Выбросьте ткань.
Обычная детская доза для акне, розацеа
Сульфацетамид натрия-сера для местного применения 8% -4% суспензия :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4,5% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -1% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и втирайте в полную пену.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -4% пена для местного применения :
12 лет и старше: Промыть пораженный участок. Втирайте пену в пораженный участок 1-2 раза в день. При удалении смойте через 1-2 минуты.
Сульфацетамид натрия-сера местный 10% -4% местный тампон :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -5% пена для местного применения :
12 лет и старше: Тщательно очистите и высушите полотенцем.Втирайте пену в пораженный участок от 1 до 3 раз в день.
Сульфацетамид натрия-сера местный 10% -5% местный тампон :
12 лет и старше: 1-2 раза в день, влажная ткань и втирайте до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите. Выбросьте ткань.
Обычная детская доза при себорейном дерматите
Сульфацетамид натрия-сера для местного применения 8% -4% суспензия :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 9% -4,5% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -1% жидкость для местного применения :
12 лет и старше: 1-2 раза в день, влажная кожа и втирайте в полную пену.Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -4% пена для местного применения :
12 лет и старше: Промыть пораженный участок. Втирайте пену в пораженный участок 1-2 раза в день. При удалении смойте через 1-2 минуты.
Сульфацетамид натрия-сера местный 10% -4% местный тампон :
12 лет и старше: 1-2 раза в день, влажная кожа и работа до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите.
Сульфацетамид натрия-сера для местного применения 10% -5% пена для местного применения :
12 лет и старше: Тщательно очистите и высушите полотенцем.Втирайте пену в пораженный участок от 1 до 3 раз в день.
Сульфацетамид натрия-сера местный 10% -5% местный тампон :
12 лет и старше: 1-2 раза в день, влажная ткань и втирайте до полной пены. Очистите лицо от 10 до 20 секунд. Промойте и высушите. Выбросьте ткань.
Корректировка дозы для почек
Суспензия 8% -4% сульфацетамида натрия-серы для местного применения, 10% -4% жидкости для местного применения сульфацетамида натрия-серы и 10% -5% пены сульфацетамида натрия-серы для местного применения не следует использовать пациентам с заболеваниями почек.
Коррекция дозы для печени
Данных нет
Диализ
Данных нет
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Соединения серы тиосульфат натрия — Большая химическая энциклопедия
В дополнение к соединениям, описанным в следующих параграфах, см. Также сероводород, меркаптан, тиосульфат натрия, серная кислота, серная кислота, тиоциановая кислота, тиоктановая кислота, тиофен и тиомочевина.[Стр.1570]Тиосульфат натрия является побочным продуктом производства Sulfur Black и других серных красителей (qv), где органические нитросоединения обрабатываются раствором полисульфида натрия с получением тиосульфата. Красители были нерастворимыми и были восстановлены путем размножения. Футрат обрабатывают активированным углем и фильтруют, чтобы получить раствор тиосульфата натрия. После концентрирования и кристаллизации конечный продукт анализирует приблизительно 96% Na2S202 5h30 (34) (см. Красители И … [Стр.29]
Определение.Наиболее точным (68) методом определения меди в ее соединениях является электрогравиметрия из раствора серной и азотной кислот (45). Чистые соединения меди можно легко титровать с использованием этилендиаминтетуксусной кислоты (ЭДТА) до конечной точки SNAZOXS или мурекида. Лодометрическое титрование с использованием тиосульфата натрия до конечной точки крахмал-йодид является одним из наиболее распространенных методов, используемых в промышленности. Последнее титрование происходит быстрее, чем электролиз, почти такое же точное и гораздо более устойчивое к примесям, чем титрование с ЭДТА.Гравиметрия также использовалась для тиоцианата (68). [Pg.256]
В дополнение к реакциям, которые производят элементарную серу, также происходят конкурирующие реакции, которые производят нежелательные побочные продукты, такие как тиосульфат натрия. Это вредно, потому что тиосульфат остается в растворе, и его концентрацию, как правило, можно снизить только путем стравливания части запасов раствора. Этот поток отходов продувки раствором опасен в основном потому, что он также содержит соединения ванадия.Ключом к снижению содержания металлов в потоке отходов является снижение скорости образования тиосульфата. [Стр.127]
Активность серы по отношению к комплексам платины привела к исследованию так называемых «спасающих» средств для уменьшения побочных эффектов терапии платиной без ущерба для ее противоопухолевой активности. Эти нуклеофильные соединения серы включают тиосульфат натрия (STS), диэтилдитио-карбамат натрия (Naddtc), (S) — 2 — [(3-аминопропил) амино] этилфосфоротиоевую кислоту (WR-2721, этиол, амифостин), глутатион (GSH). , метионин, тиомочевина, цистеин, -ацетилцистеин, пеницилламин, биотин, сульфатиазол, 2-меркаптоэтансульфонат натрия (месна) и его димер (ди) месна (BNP-7787).Защитный эффект этих соединений обусловлен либо предотвращением, либо обращением аддуктов Pt-S в белках. Некоторые из наиболее перспективных из вышеупомянутых соединений (см. Рис. 1) будут рассмотрены ниже. [Pg.344]
Сера может быть эффективно удалена из соединения, органического или неорганического, путем контакта с никелем Ренея. Это действие было описано Обри (118) как некаталитическое по природе. Один атом серы удаляется из тиосульфата натрия на холоде, давая сульфит натрия, из которого сера может быть полностью удалена при 100 °.Хотя серу можно полностью удалить из сульфида олова, из сульфида сурьмы ее можно удалить лишь частично. Ниже приведены некоторые неорганические соединения, из которых наблюдалось удаление серы с помощью никеля Ренея (119). [Pg.444]
Процедура В подходящий химический стакан, колбу и т. Д. Поместите 250 миллилитров (8,5 унций жидкости) холодной воды, а затем добавьте и растворите 51 грамм (1,8 унции) гидроксида натрия. Учтите, что гидроксид натрия при растворении в воде выделяет чрезмерное тепло, поэтому будьте осторожны.После этого добавляйте небольшими порциями за раз по 50 г (1,7 унции) порошковой серы и во время добавления энергично перемешивайте смесь. Обратите внимание, что при желании можно добавить больше серы. После этого продолжайте перемешивать смесь примерно 30 минут. Через 30 минут смесь готова к употреблению. Несмотря на то, что смесь будет загрязнена тиосульфатом натрия, ее можно использовать непосредственно для восстановления нитросоединений. [Стр.92]
Следующая процедура используется при анализе йодозо и йодоксисоединений.В 200-куб. колбу йода помещают на 100 куб. воды, 10 куб. 6 н. серной кислоты, 2 г. йодида калия, не содержащего йодата, 10 мл. хлороформа и, наконец, образец около 0,25 г. Колбу встряхивают пятнадцать минут (или дольше, если реакция не завершена), затем смесь титруют 0,1 н. Тиосульфатом натрия. Если образец чистый, изменение цвета в слое хлороформа может быть принято за конечную точку, но если присутствуют примеси, необходимо использовать крахмал, поскольку примеси придают хлороформ коричневатый цвет.Этот растворитель желателен, поскольку он облегчает реакцию с иодидом калия за счет растворения продуктов реакции. Йодозобензол можно отличить от йодоксибензола, поскольку первый восстанавливает иодид-ион в насыщенном растворе бората натрия, тогда как последний — нет1. Вовлеченные реакции: … [Стр.96]
Неорганические соединения серы, такие как метабисульфит натрия, сульфит , и тиосульфат … [Pg.368]
Несовместим с галогенидами, анионными эмульгаторами и суспендирующими агентами, трагакант крахмал, тальк, метабисульфит натрия, тиосульфат натрия, динатрий, эдетат, силикаты, алюминий и другие металлы, аминокислоты, аммиак и соли аммония, соединения серы, каучук и некоторые пластмассы.[Pg.522]
Кистозы, шрамы, безрецептурные продукты и многое другое
Мы включаем продукты, которые, по нашему мнению, будут полезны нашим читателям. Если вы покупаете по ссылкам на этой странице, мы можем получить небольшую комиссию. Вот наш процесс.
Какое отношение сера имеет к акне?
Слово «сера» может вызвать воспоминания о научных занятиях, но оказывается, что этот обильный элемент является основным продуктом естественной медицины. Благодаря своим антимикробным свойствам сера веками использовалась для лечения акне и других кожных заболеваний.
Также легко добраться. Сера широко доступна в безрецептурных продуктах от прыщей, а также в некоторых рецептурных версиях.
Продолжайте читать, чтобы узнать больше об этом ингредиенте для борьбы с прыщами, в том числе о типах угрей, которые он может лечить, и о безрецептурных продуктах, которые вы можете попробовать дома.
В качестве местного средства от прыщей сера действует так же, как перекись бензоила и салициловая кислота. Но в отличие от этих других ингредиентов для борьбы с прыщами, сера, как правило, мягче воздействует на вашу кожу.
Сера помогает высушить поверхность кожи, поглощая излишки кожного жира (кожного сала), которые могут способствовать высыпанию прыщей. Он также высушивает омертвевшие клетки кожи, чтобы очистить поры.
Некоторые продукты содержат серу вместе с другими ингредиентами для борьбы с прыщами, такими как резорцин.
Сера лучше всего действует при высыпаниях, образованных сочетанием мертвых клеток кожи и избытка кожного сала. К ним относятся более легкие формы прыщей, такие как белые и черные точки.
Тем не менее, важно помнить, что результаты могут различаться у разных пользователей.Это также может сработать на некоторых прорывах, но не на других. Первый шаг — определить, какой у вас тип прыщей. Затем вы можете поговорить со своим дерматологом о том, подходит ли вам сера.
Легкая форма: белые точки и черные точки
Классифицируемые как невоспалительные, белые точки и черные точки являются наиболее легкими формами прыщей. Они возникают, когда жирные и омертвевшие клетки кожи объединяются и застревают в волосяных фолликулах.
Если забитая пора открыта вверху, это черная точка. Если у забитой поры закрытый верх, это белая точка.
Сера — это одно безрецептурное средство от прыщей, которое может помочь от белых и черных точек, потому что оно нацелено на два основных элемента: мертвые клетки кожи и кожный жир. Салициловая кислота также может помочь при этой форме прыщей, но если у вас чувствительная кожа, вы можете попробовать серу.
Умеренные: папулы и пустулы
Папулы и пустулы представляют собой форму умеренного воспалительного акне. Оба образуются из-за разрушения стенок пор, что делает их восприимчивыми к засорению. Затем поры затвердевают и могут стать болезненными.
Основное различие между ними в том, что пустулы больше и содержат больше гноя. Пустулы также обычно имеют желтую или белую головку.
Сера не является достаточно сильным средством для лечения акне средней степени тяжести. В целом, он менее эффективен, чем другие ингредиенты от прыщей, такие как перекись бензоила. Вместо этого вы можете рассмотреть другой безрецептурный продукт, такой как ProActiv Emergency Blemish Relief.
Тяжелая форма: узелки и кисты
Тяжелая форма акне состоит из воспалительных узелков и кист.Они возникают, когда поры сильно воспаляются и раздражаются. Они также находятся глубже под кожей, что затрудняет их лечение. Сильные прыщи могут быть болезненными на ощупь, со временем могут покраснеть и появиться рубцы.
Учитывая серьезный характер узелков и кист, эту форму прыщей нельзя лечить в домашних условиях. Если вы пробовали перекись бензоила и не увидели результатов, сера, скорее всего, тоже не подойдет. Вам нужно будет обратиться за помощью к дерматологу.
Они могут порекомендовать рецепт, например, антибиотик или производное витамина А, называемое изотретиноином (аккутаном).Для удаления стойких кист может потребоваться операция.
Шрамы
Если у вас в анамнезе были высыпания прыщей, есть вероятность, что у вас также может быть несколько шрамов от прыщей. Они могут различаться по цвету и размеру, но у шрамов от прыщей есть одна общая черта: от них сложно избавиться.
Поскольку сера высыхает и удаляет омертвевшие клетки кожи, теоретически она может также уменьшить появление шрамов. Однако сера не должна быть вашим первым средством лечения. Для стойких шрамов можно использовать осветляющее средство для кожи, например, сверхмощную осветляющую сыворотку Admire My Skin.
Как и другие ингредиенты для прыщей, сера может вызывать раздражение. Однако это считается более безопасным выбором для чувствительной кожи. А при использовании в качестве точечного лечения сера также может помочь избавиться от высыпаний прыщей у сухой и комбинированной кожи.
Сера может быть достаточно мягкой для чувствительной кожи, но все же существует риск побочных эффектов. Возможна чрезмерная сухость и раздражение.
При первом использовании серы от прыщей наносите один раз в день. Вы можете постепенно увеличивать нанесение до двух или трех раз в день, как только ваша кожа привыкнет к продукту.
Еще одно соображение — запах. Сера традиционно имеет запах «тухлых яиц», в отличие от большинства родственных продуктов от прыщей. Попробуйте протестировать продукты из серы в местном магазине косметики, чтобы убедиться, что они не содержат неприятных запахов.
Хотя сера является ингредиентом некоторых точечных средств, она также доступна в других средствах от прыщей, таких как очищающие средства и маски. Типы серных продуктов, которые вы используете, также определяют дозировку. Например, вы можете наносить лосьон максимум два раза в день, а точечные процедуры — до трех раз в день.
Перед использованием любого нового средства от прыщей обязательно проведите пластырь, чтобы узнать, чувствительны ли вы к сере или другим ключевым ингредиентам. Чтобы провести патч-тест:
- Выберите небольшой участок кожи вдали от лица, например на внутренней стороне руки.
- Нанесите небольшое количество продукта и подождите 24 часа.
- При отсутствии побочных эффектов можно наносить средство на лицо. Но если у вас появилось покраснение, сыпь или крапивница, прекратите использование продукта.
Некоторые популярные серосодержащие средства от прыщей:
Сера широко доступна в аптеках и косметических магазинах для лечения прыщей.Вы даже можете найти продукты из серы в Интернете.
Если вы не видите результатов с продуктами серы, отпускаемыми без рецепта, спросите своего дерматолога о версиях, отпускаемых по рецепту. Они часто содержат сульфацетамид натрия, еще один компонент прыщей.
Прежде всего, проявите терпение при лечении серой и следите за своей кожей на предмет любых изменений. Прежде чем вы начнете видеть результаты, может пройти до трех месяцев.
МСМ Сера против серы | Dherbs, Новости Dherbs, Альтернативная медицина, Травяные средства, Травяные продукты, Травяные добавки, Натуральные средства правовой защиты, Сера МСМ, Органическая сера, Серная кислота
Сера и метилсульфонилметановая сера — вещества, которые обычно неправильно понимают.Многие люди путают серу МСМ с обычной серой, но они очень разные.
Хотя оба они представляют собой серу, формы различны. Сера МСМ может рассматриваться как органическая сера и, следовательно, на 100% безопасна. Этот вид серы может безопасно и эффективно усваиваться и усваиваться человеческим организмом.
Обычная сера, также известная как оксид серы, перерабатывается в серную кислоту. Эта форма серы неорганическая и токсична для человеческого организма. Этот вид серы не может перевариваться или поглощаться человеческим организмом.
История
Это разновидность серной кислоты, которую врачи прописывали людям еще в 1950-х, 1960-х и 1970-х годах. Это вызвало множество побочных реакций, особенно на коже людей. При наружном нанесении на кожу кожа пытается вывести ядовитую серу из крови. Кожа, являясь крупнейшим органом выделения в организме, выделяет серную кислоту, потому что она опасна для организма и потенциально смертельна.
Серная кислота использовалась в мазях и кремах для местного применения для лечения артритов , и поскольку токсичное вещество было нанесено на кожу, оно попало в кровоток, а затем кровь использовала кожу, чтобы попытаться удалить токсичное вещество.
Многие люди называют серную кислоту серой, поэтому, когда они слышат о сере МСМ, они приравнивают серу МСМ к серной кислоте, что создает рискованную ситуацию.
Сера по сравнению с серной кислотой
Очень легко отличить серу МСМ от оксида серы. МСМ Сера имеет белый цвет, а оксид серы — желтый цвет. Этот желтый цвет становится ясным, когда его обрабатывают и превращают в серную кислоту, промышленный продукт.
Сера. Неметаллический, поливалентный химический элемент без вкуса и запаха в основном встречается в желтой кристаллической форме или в массовом объеме, особенно в вулканических областях.Его атомный номер 16, а атомный вес 32,06. Он используется для производства серной кислоты и используется в следующих промышленных целях:
- Металлургия
- Вулканизация каучука
- Нефтепереработка
Сера обладает способностью лечить следующие состояния:
- Подагра
- Ревматизм
- Бронхит
Органическая сера, наряду с такими элементами, как цинк, кремний и биотин, являются элементами красоты, полезными для кожи.Они помогают укрепить структурную целостность кожи.
Диетические источники
Сера
Сера — это ключевое вещество, которое делает чеснок «королем трав». Тем не менее, есть противоречие с органической серой, хотя по своей природе. Сера в луке не вызывает слезы при резке лука. Лук производит химическое раздражающее вещество, называемое синпропантиалом-S-оксидом, которое стимулирует слезные железы глаза, заставляя их слезиться.
Син-пропантиаль-S-оксид начинается как вещество, называемое слезоточивым фактором-синтазой, ранее не обнаруженный фермент , открытый японцами в 2002 году. Когда лук разрезается, в воздух выбрасывается синтаза слезоточивого фактора. Фермент синтаза превращает аминокислоты в сульфеновую кислоту. Нестабильная сульфеновая кислота превращается в синропантиаль-S-оксид, и это вещество выделяется в воздух и вступает в контакт с нашими глазами.
Значит, при резке лука слезятся глаза не от серы.Это другое вещество.
Сера МСМ считается диетической серой. В основном это производное лигнина сосны. Лигнин — это молекула растений, которая является частью клеточной стенки растения. Сера МСМ или метил-сульфонил-метан — это относительно новая диетическая форма серы, которая обнаруживается в тканях человека. Это естественное питательное вещество, которое содержится в рационе человека, особенно в диетах на основе растений. Он попадает в рацион через цикл серы, который происходит, когда океанский планктон выделяет соединения серы, которые поднимаются в озон, где ультрафиолетовый свет заставляет МСМ и ди-метилсульфоксид возвращаться на поверхность Земли через дождь.Растения концентрируют МСМ и в конечном итоге возвращают его на Землю и в море. Испарение в воздух приводит к его возвращению на Землю.
Льготы
МСМ сера поддерживает здоровые соединительные ткани, такие как сухожилия, мышцы и связки, и, таким образом, полезна при таких проблемах со здоровьем, как артрит, остеоартрит, ревматоидный артрит, бурсит, подагра и мышечные боли. Сера МСМ фактически считается строительным материалом для белка. Вещество также выводит токсины из крови и лимфатической системы.
Сера по своей органической природе присутствует во всех клетках в форме сульфата. Когда сера вступает в контакт с натрием, калием, магнием и селеном, образуется сульфат.
Разновидности
Сера содержится в человеческих волосах, коже и ногтях.
Многие аминокислоты содержат серу в качестве компонента. МСМ выполняет множество функций, которые очень важны для здоровья человека и общего благополучия.
Использует
Сера также необходима для выработки инсулина и настоятельно рекомендуется для так называемых диабетиков.
Люди с артритом и спортивными травмами хорошо реагируют на МСМ при приеме внутрь. МСМ необходим для исцеления, потому что он ускоряет процесс заживления. Многие профессиональные спортсмены потребляют серу МСМ, когда получают травму и нуждаются в быстром восстановлении.
MSM-сера может использоваться для продвижения:
- Рост волос
- Рост ногтей
- Структурная целостность кожных покровов;
- Производство инсулина
- Заживление поврежденных сухожилий, связок и мышц, переломов костей и боли
- Исцеление от артрита, бурсита, ревматизма, остеоартрита, растяжений и слепоты
- Повышение фертильности, особенно у мужчин
- Очистка крови
- Детоксикация клеток
- Удаление паразитов и глистов
- Питание мужских и женских гонад
Источники серы
Сера является очень важным элементом для оптимального здоровья и благополучия и настоятельно рекомендуется Dherbs.com. Убедитесь, что витамин C потребляется с серой MSM, потому что витамин C зависит от серы для усвоения.
Продукты, богатые серой:
- Репчатый лук
- Чеснок
- Брюссельская капуста
- Капуста
- Кале
- Семечки подсолнечника
- Чечевица
- Соевые бобы
- Репа
- Фасоль
- Зародыши пшеницы
Заводы по производству серы включают:
- Хвощ полевой
- Люцерна
- Листья чапараля
- Корень лопуха
- Листья и корень одуванчика
- Кошачья мята
- Чеснок
- Листья и ягоды красной малины
- Лобелия
- Ягоды можжевельника
Это вещество также содержится в следующих глинах для кожи лица:
- Бентонитовая глина
- Французская зеленая глина
- Марокканская красная глина
И поскольку сера широко доступна, ее можно использовать для балансировки чакр.Сера — красивый желтый цвет, что означает, что это полезный камень для третьей чакры, солнечного сплетения.
Третья чакра энергетической системы человека занимается вопросами личной власти, интеллекта, амбиций, драйва, самооценки, самооценки и эго.
Сера никогда не должна использоваться для приготовления эликсира, если, конечно, кусок серы не помещен в стеклянный контейнер или сосуд и помещен в чашу с водой (эликсиром), что называется «непрямым методом». Свойства серы будут по-прежнему воздействуют на воду таким образом и лучше всего использовать наружно.
Серу можно наносить непосредственно на тело для балансировки чакр. Таким образом, это не окажет негативного воздействия на кожу. Во время сеансов балансировки чакр одежду обычно носят так, чтобы кусок серы лежал на материале одежды, а не непосредственно на коже человека.
2015-08-27T11: 59: 15-07: 00
Количество диоксида серы, образованного метабисульфитом натрия в кислых растворах
Не лекционный зал, а круглый стол с местом для Вас!
60 000 тем за 36 лет.Образование, алоха и развлечения
, тема 26494
2004
В. Как я могу определить, сколько диоксида серы образуется при обработке шестивалентного хрома метабисульфитом натрия? Я просмотрел некоторые тексты, в которых диоксид серы не упоминается как побочный продукт процесса. Однако, зная, что диоксид серы образуется при контакте между метабисульфитом натрия и кислотой / водой, я бы подумал, что образуется некоторое количество SO2. Следует отметить, что я обрабатываю шестивалентный хром в резервуаре емкостью 53 000 галлонов и обычно добавляю порошок прямо из пакета.Возможно, тексты, которые я прочитал, предполагают, что метабисульфит натрия смешивается с водой перед добавлением хромовой кислоты, и, возможно, SO2 образуется в процессе смешивания, а не в процессе обработки. Тем не менее, мне нужно знать, сколько SO2 образуется на фунт метабисульфита натрия, смешанного с кислым раствором.
Заранее благодарим за ответы.
Дерек БертонМенеджер по очистке сточных вод — Эллиджей, Джорджия, США
2003 г.
A. Это интересный вопрос, на который, я надеюсь, вы получите ответ, но я думаю, что вряд ли ответ будет простым!
Уравнения нейтрализации шестигранника хрома бисульфитом широко распространены и приняты как:
1a).Na2S2O5 + h3O => 2NaHSO3
1б). 3NaHSO3 + 2h3CrO4 + 3h3SO4 => Cr2 (SO4) + 3NaHSO4 + 5h3O
Эти уравнения не показывают выброса SO2. Однако это кажется совершенно противоречащим опыту, поэтому уравнения, вероятно, не совсем точны и полны. Интересно взглянуть на распечатанные и принятые уравнения нейтрализации гексагонального хрома диоксидом серы:
2a). SO2 + h3O <=> h3SO3
2b). 3h3SO3 => Cr2 (SO4) 3 + 5h3O
В этой версии мы видим обратимое уравнение равновесия между газом SO2 и h3SO3 в уравнении 2a.Я не химик, но я думаю, что уравнение 1a, вероятно, не раскрывает всей истории, так что когда Na2S2O5 смешивается с подкисленной водой, а не с нейтральной водой, происходит дополнительная реакция, которая выделяет диоксид серы. Фактически, мой опыт показывает, что чем ниже pH, тем неприятнее дымление, что укрепляет мою уверенность в том, что кислота реагирует с метабисульфитом с выделением диоксида серы. Надеюсь, кто-нибудь предложит нам свое уравнение для этого. Но мой промежуточный вывод заключается в том, что вы обнаружите, что количество выделяемого диоксида серы пропорционально количеству добавленной серной кислоты, а не количеству нейтрализованного хрома.
Хотя в текстах говорится, что нейтрализация обычно проводится при pH 2,5-3,0, чтобы протекать с разумной скоростью, и часто нецелесообразна при pH выше 4,0, это может быть неверно для периодической реакции, и дымообразование будет значительно уменьшено. при более высоком pH.
Хотя вы, естественно, хотите измерить или спрогнозировать выброс SO2 в качестве промежуточной цели, реальная цель состоит в том, чтобы максимально приблизить его к нулю. В этом свете, возможно, вы могли бы провести несколько лабораторных экспериментов по добавлению метабисульфита в воду, добавлению разбавленного бисульфита к хромовой кислоте и, наконец, добавлению стехиометрического количества серной кислоты.
Тед Муни, P.E.
finish.com — Пайн-Бич, Нью-Джерси
Стремление к жизни Алоха
2004
A. Хотя совершенно очевидно, что SO2 выделяется при подкислении метабисульфита натрия, его можно почувствовать даже без особого запаха, если какое-либо подкисление, реальная проблема заключается в том, сколько метабисульфита требуется для уменьшения количества хрома. Вы действительно не хотите подкислять метабисульфит и вытеснять SO2, так как это может вызвать приступ астмы.
Справочник по гальванике предлагает 1.43 фунта на каждый фунт хрома против 0,96 фунта диоксида серы. Из этого вы можете рассчитать количество эффективного SO2, если хотите. Как видно из реакций Теда, серная кислота или ионы H + являются частью реакции, поэтому, если вы добавляете метабисульфит без кислоты, свободные ионы H + быстро расходуются, pH повышается и реакция прекращается. При pH 5 реакция отсутствует, ниже 3 и происходит мгновенное снижение, поэтому вы должны постоянно добавлять кислоту, если хотите работать в диапазоне 3-4.
Джеффри Уайтлоу
— Порт Мельбурн, Австралия
2004
А.Нет сомнений в том, что SO2 образуется при обработке Cr + 6 SBS. Однако это, вероятно, очень небольшое количество, поскольку принятый порог запаха для SO2 составляет около 0,5 ppm или 1,3 мг / м3. Пределы безопасной работы приближены к 5,0 ppm или 13 мг / м3.
По сравнению с фунтами и фунтами SBS, которые обычно используются для обработки Cr + 6, количество SO2, выделяемого из раствора, должно быть относительно незначительным. Так уж получилось, что очень мало SO2 может произвести очень и очень сильный запах.
Я также ожидаю, что на скорость выделения SO2 будут влиять другие факторы, такие как температура, скорость вентиляции и т. Д.
Chad DannemannВода и сточные воды — Хьюстон, Техас
1 февраля 2012 г.
В. Есть ли способ быстро изменить реакцию на SO3? В моем растворе есть метабисульфит натрия, и я хочу остановить образование SO2.
— Скрэнтон
6 февраля 2012 г.

 Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС
Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС