три закона термодинамики. Как построить вечный двигатель первого, второго начала?
В продолжение нашего курса «Физика для чайников» начнем рассматривать основы такого важнейшего раздела как термодинамика.
Активное развитие термодинамики началось в девятнадцатом веке. Именно тогда люди начали строить первые паровые машины, а потом активно внедрять их в производство. Началась промышленная революция, и, естественно, всем хотелось увеличить коэффициент полезного действия машин, чтобы произвести больше продукции, доехать подальше и в конце-концов получить больше денег. Все это очень хорошо стимулировало развитие науки и наоборот. Но давайте ближе к сути вопроса.
Парогенераторная прожекторная установка
Термодинамика – раздел физики, изучающий макроскопические системы, их наиболее общие свойства, способы передачи и превращения энергии в таких системах.
Что такое макроскопические системы? Это системы, состоящие из очень большого числа частиц.
Термодинамическая система – реально или мысленно выделяемая макроскопическая физическая система, состоящая из большого числа частиц, не требующая для своего описания привлечения микроскопических характеристик отдельных частиц. Соответственно, для описания термодинамической системы используются макроскопические параметры, не относящиеся к каждой частице, но описывающие систему целиком. Это температура, давление, объем, масса системы и проч.
Важно отметить, что термодинамические системы могут быть замкнутыми и незамкнутыми. Замкнутая система – это такая система, которую при помощи реальной или воображаемой оболочки оградили от окружающей среды, при этом количество частиц в системе остается постоянным.
Замкнутая система – это такая система, которую при помощи реальной или воображаемой оболочки оградили от окружающей среды, при этом количество частиц в системе остается постоянным.
Система может находится в разных состояниях. Например, мы взяли баллон с газом и начали его нагревать. Тем самым мы изменили энергию молекул газа, они стали двигаться быстрее, и система перешла в какое-то новое состояние с более высокой температурой. Но что будет, если систему оставить в покое? Тогда система через какое-то время придет в состояние термодинамического равновесия.
Что это значит?
Термодинамическое равновесие – это состояние системы, в котором ее макроскопические параметры (температура, объем и др.) остаются неизменными с течением времени.
Термодинамика стоит на трех своих столпах. Существуют три основных постулата или три закона термодинамики. Они называются соответственно первым, вторым и третьим началами термодинамики. Рассмотрим первое начало или первый закон термодинамики.
Рассмотрим первое начало или первый закон термодинамики.
Первое начало термодинамики
Первое начало термодинамики гласит:
В любой изолированной системе запас энергии остается постоянным.
К слову, у данного постулата есть еще несколько эквивалентных формулировок. Приведем их ниже:
Количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил.
Невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Запишем также математическое выражение первого начала термодинамики:
Здесь Q — количество теплоты, дельта U — изменение внутренней энергии, A — работа против внешних сил. Для различных термодинамических процессов в силу их особенностей запись первого начала будет выглядеть по-разному.
Почему невозможен вечный двигатель первого рода?
Людей издревле привлекала ее величество Халява. Философский камень, превращающий любой металл в золото, скатерть самобранка, с которой не нужно готовить, джин, исполняющий любые желания. Еще одной такой идеей была идея вечного двигателя.
Философский камень, превращающий любой металл в золото, скатерть самобранка, с которой не нужно готовить, джин, исполняющий любые желания. Еще одной такой идеей была идея вечного двигателя.
Если никто не пытался найти скатерть-самобранку, то вечный двигатель пытались изобрести очень много раз. На протяжении веков разные люди спрашивали себя: как построить вечный двигатель? Согласно историческим записям первым такую попытку предпринял в двенадцатом веке некий индийский ученый. Затем было еще множество попыток, в том числе плотно занимался вопросом и Леонардо да Винчи. Наконец, в девятнадцатом веке светлые головы Германа Гельмгольца и Джеймса Джоуля сформулировали первое начало динамики и подтвердили его опытами, чем развеяли все сомнения. В помощь также статья, о том, как делать презентацию в ворде и powerpoint.
Вечный двигатель Леонардо да ВинчиВечный двигатель невозможен, потому что так устроен мир. Об этом говорят нам законы термодинамики. Согласно первому началу термодинамики, количество теплоты, полученное системой, идет на изменение внутренней энергии системы, а также на совершение работы против внешних сил. Например, газ, помещенный в цилиндр с поршнем, получая определенное количество теплоты, увеличивает свою внутреннюю энергию, молекулы движутся быстрее, газ занимает больший объем и толкает поршень (работа против внешних сил). Иными словами, если работа совершается без внешнего притока энергии, она может совершаться лишь за счет внутренней энергии системы, которая рано иди поздно иссякнет, преобразовавшись в совершенную работу, на чем все закончится и система придет к состоянию термодинамического равновесия. Ведь энергия в мире никуда не уходит и не приходит, ее количество остается постоянным, а меняется лишь форма. Конечно, Вы обратили внимание на то, что речь идет о так называемом вечном двигателе первого рода (который может совершать работу без энергии). Спешим заверить, существование вечного двигателя второго рода также невозможно и объясняется вторым началом термодинамики, о котором мы поговорим в ближайшем будущем.
Например, газ, помещенный в цилиндр с поршнем, получая определенное количество теплоты, увеличивает свою внутреннюю энергию, молекулы движутся быстрее, газ занимает больший объем и толкает поршень (работа против внешних сил). Иными словами, если работа совершается без внешнего притока энергии, она может совершаться лишь за счет внутренней энергии системы, которая рано иди поздно иссякнет, преобразовавшись в совершенную работу, на чем все закончится и система придет к состоянию термодинамического равновесия. Ведь энергия в мире никуда не уходит и не приходит, ее количество остается постоянным, а меняется лишь форма. Конечно, Вы обратили внимание на то, что речь идет о так называемом вечном двигателе первого рода (который может совершать работу без энергии). Спешим заверить, существование вечного двигателя второго рода также невозможно и объясняется вторым началом термодинамики, о котором мы поговорим в ближайшем будущем.
Надеемся, знакомство с термодинамикой прошло для Вас приятно и Вы полюбите ее всем сердцем. Если же этого не произойдет, Вы всегда можете поручить выполнение задач по термодинамике нашим авторам, пока сами занимаетесь более приятными делами.
Если же этого не произойдет, Вы всегда можете поручить выполнение задач по термодинамике нашим авторам, пока сами занимаетесь более приятными делами.
просто и понятно о его применении в физике
8 комментариев
Содержание:
Определение
Простая формулировка первого закона термодинамики может звучать примерно так: изменение внутренней энергии той или иной системы возможно исключительно при внешнем воздействии. То есть другими словами, чтобы в системе произошли какие-то изменения необходимо приложить определенные усилия извне. В народной мудрости своеобразным выражением первого закона термодинамики могут служить пословицы – «под лежачий камень вода не течет», «без труда не вытащишь рыбку из пруда» и прочая.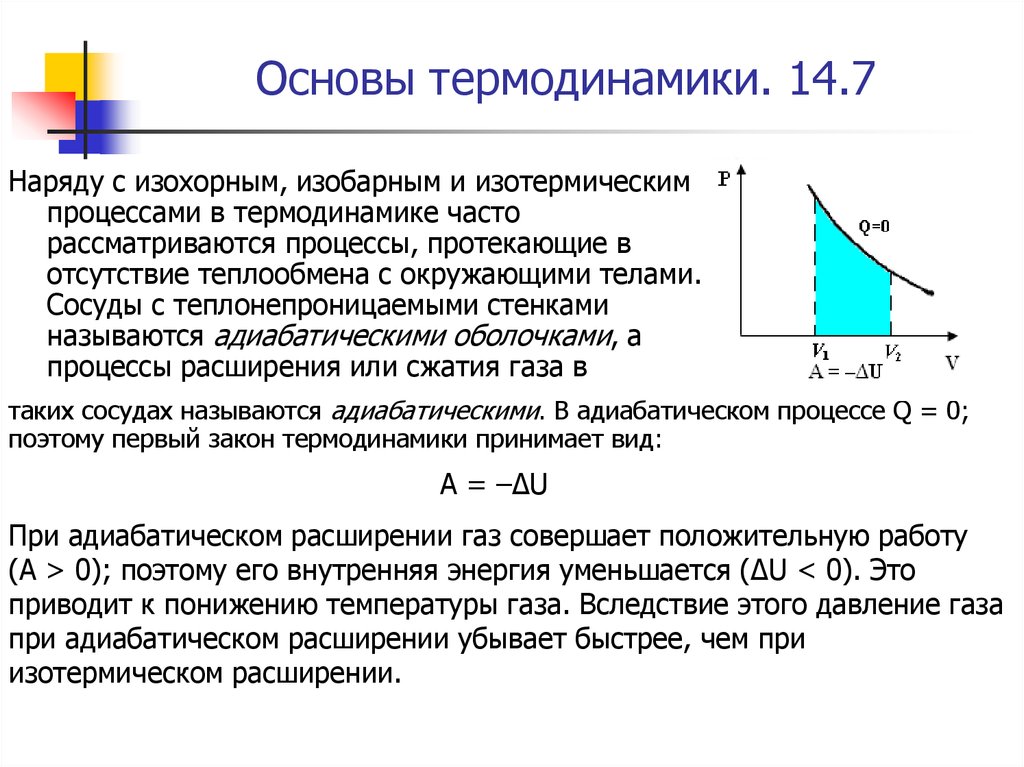
Интересный факт: именно первый закон термодинамики устанавливает, почему потерпели неудачу все многочисленные попытки ученых, исследователей, изобретателей изобрести «вечный двигатель», ведь его существование является абсолютно невозможным согласно этому самому закону, почему, смотрите абзац выше.
В начале нашей статьи было максимального простое определение первого закона термодинамики, в действительности в академической науке существует целых четыре формулировки сути данного закона:
- Энергия ни откуда не появляется и ни куда не пропадает, она лишь переходит из одного вида в другой (закон сохранения энергии).
- Количество теплоты, полученной системой, идет на совершение ее работы против внешних сил и изменение внутренней энергии.

- Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе, и не зависит от способа, которым осуществляется этот переход.
- Изменение внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Формула
Формулу первого закона термодинамики можно записать таким образом:
Q = ΔU + A
Количество теплоты Q, передаваемое системе равно суме изменения ее внутренней энергии ΔU и работы A.
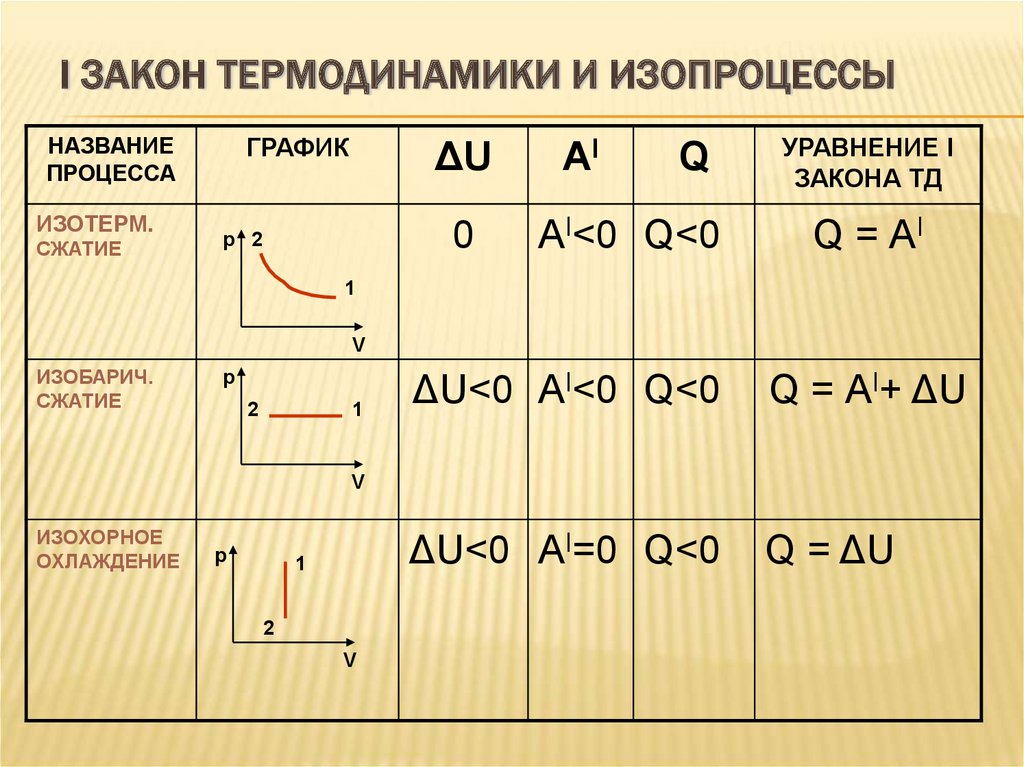
Процессы
Также первый закон термодинамики имеет свои нюансы в зависимости от проходящих термодинамических процессов, которые могут быть изохронными и изобарными, и ниже мы детально опишем о каждом из них.
Закон для для изохорного процесса
Изохорным процессом в термодинамике называют процесс, происходящий при постоянном объеме. То есть, если будь-то в газе или жидкости нагреть вещество в сосуде, произойдет изохорный процесс, так как объем вещества останется неизменным. Это условие имеет влияние и на первый закон термодинамики, проходящий при изохорном процессе.
То есть, если будь-то в газе или жидкости нагреть вещество в сосуде, произойдет изохорный процесс, так как объем вещества останется неизменным. Это условие имеет влияние и на первый закон термодинамики, проходящий при изохорном процессе.
В изохорном процессе объем V является константой, следовательно, газ работы не совершает A = 0
Из этого выходит следующая формула:
Q = ΔU = U (T2) – U (T1).
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
Закон для для изобарного процесса
Аналогично изобарным процессом называется термодинамический процесс, происходящий в системе при постоянном давлении и массе газа. Следовательно, в изобарном процессе (p = const) работа, совершаемая газом, выражается следующим уравнением первого закона термодинамики:
A = p (V2 – V1) = p ΔV.
Изобарный первый закон термодинамики дает:
Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
Практическое применение
Первый закон термодинамике имеет практическое применение к различным процессам в физике, например, позволяет вычислить идеальные параметры газа при разнообразных тепловых и механических процессах. Помимо сугубо практичного применение можно этому закону найти применение и философское ведь что ни говорите, но первый закон термодинамики является выражением одного из самых общих законов природы – закона сохранения энергии. Еще Еклезиаст писал, что ничто ни откуда не появляется и никуда не уходит, все пребывает вечно, постоянно трансформируясь, в этом и кроется вся суть первого закона термодинамики.
Видео
И в завершение нашей статьи вашему вниманию образовательное видео о первом законе термодинамике и внутренней энергии.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском – First Law of Thermodynamics.
Первый закон термодинамики — формула, формулировка и применение
Законы термодинамики, как правило, довольно просто сформулировать и понять, поэтому легко можно недооценить действие, оказываемое ими. Они влияют на многие процессы, в том числе на то, как энергия может быть использована во Вселенной. Последствия первого закона термодинамики затрагивают почти все аспекты научных исследований.
Они влияют на многие процессы, в том числе на то, как энергия может быть использована во Вселенной. Последствия первого закона термодинамики затрагивают почти все аспекты научных исследований.
Содержание
- Определение и понятие
- Математическое представление
- История открытия
- Термодинамические системы
- Применение на практике
- Основные изопроцессы
Определение и понятие
Термодинамика — это раздел физики, который занимается взаимоотношениями между теплом и другими формами энергии. В частности, он описывает, как тепловая энергия преобразуется в другие виды и влияет на материю. Основные принципы термодинамики содержат три закона:
 Изменение энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
Изменение энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами. Предельно изолированная система обычно равна нулю и во всех случаях определяется только количеством различных основных состояний, которые она имеет. В частности, энтропия чистого кристаллического вещества (идеальный порядок) при абсолютной нулевой температуре равна нулю. Это выражение верно, если идеальный кристалл имеет только одно состояние с минимальной энергией.
Предельно изолированная система обычно равна нулю и во всех случаях определяется только количеством различных основных состояний, которые она имеет. В частности, энтропия чистого кристаллического вещества (идеальный порядок) при абсолютной нулевой температуре равна нулю. Это выражение верно, если идеальный кристалл имеет только одно состояние с минимальной энергией.Эти законы не имеют особого отношения к тому, как и почему происходит теплообмен, что имеет смысл для открытий, которые были сформулированы до того, как атомная теория была полностью принята. Они имеют дело с общей суммой энергетических и тепловых переходов внутри системы и не учитывают специфическую природу теплопередачи на атомном или молекулярном уровне.
Математическое представление
Физики обычно используют единообразные условные обозначения для представления величин в I законе термодинамики. Они выглядят так:

Формула первого закона термодинамики выглядит следующим образом: ∆U=Q+A. Это даёт математическое представление первого закона, который оказывается очень полезным и может быть переписан несколькими способами:
Анализ термодинамического процесса в классе физики обычно включает анализ ситуации, когда одна из этих величин либо равна 0, либо контролируется разумным образом. Например, в адиабатном процессе теплообмен (Q) равен 0, в изохорном работа (W) тоже имеет значение 0.
История открытия
История термодинамики начинается с Отто фон Герике, который в 1650 году построил первый в мире вакуумный насос и продемонстрировал его действие, используя свои магдебургские полушария. Ученый был вынужден произвести такой эксперимент, чтобы опровергнуть давнее предположение Аристотеля о том, что «природа не терпит вакуума».
Ученый был вынужден произвести такой эксперимент, чтобы опровергнуть давнее предположение Аристотеля о том, что «природа не терпит вакуума».
Вскоре после этого в 1656 году английский физик и химик Роберт Бойль узнал о конструкции Герике и по согласованию с учёным Робертом Гуком построил воздушный насос. Используя его, они заметили корреляцию между давлением, температурой и объёмом. Со временем был сформулирован закон Бойля, согласно которому давление и объём обратно пропорциональны.
Изучение тепла как отдельной формы энергии началось примерно в 1798 году, когда сэр Бенджамин Томпсон (также известный как граф Румфорд), британский военный инженер, заметил, что тепло может генерироваться пропорционально количеству проделанной работы. Эта фундаментальная концепция в итоге стала следствием I закона термодинамики.
Французский физик Сади Карно впервые сформулировал базовый принцип термодинамики в 1824 году. Его учёный использовал для определения своего теплового двигателя цикла Карно. В итоге этот принцип перешел во второй закон термодинамики немецкого физика Рудольфа Клаузиуса. Ему нередко приписывают и формулировку первого закона.
В итоге этот принцип перешел во второй закон термодинамики немецкого физика Рудольфа Клаузиуса. Ему нередко приписывают и формулировку первого закона.
Одной из причин быстрого развития термодинамики в XIX веке была необходимость разработки эффективных паровых двигателей во время промышленной революции.
Термодинамические системы
По словам профессора физики университета штата Миссури Макки, энергию можно разделить на две части. К одной из них принадлежит поршень, движущийся и толкающий газ.
Макки объясняет: «Когда я приставляю два образца металла друг к другу, два атома сталкиваются, одна из частиц отрывается быстрее другой, я не могу удержаться от наблюдения за этим процессом. Это происходит в очень маленьком масштабе времени, на небольшом расстоянии и много раз в секунду. Итак, мы просто делим всю передачу энергии на две группы: то, что мы будем отслеживать, и то, что не будем. Последний из них называется теплом». Термодинамические системы обычно рассматриваются как открытые, закрытые или изолированные:
 Например, кастрюля с кипящим супом получает энергию из печи, излучает тепло из емкости и выделяет вещество в виде пара. Это открытая система.
Например, кастрюля с кипящим супом получает энергию из печи, излучает тепло из емкости и выделяет вещество в виде пара. Это открытая система.Однако на практике совершенно изолированные системы не могут существовать. Все системы передают энергию в окружающую среду посредством излучения независимо от того, насколько они изолированы. Суп в термосе останется горячим только в течение нескольких часов и достигнет комнатной температуры на следующий день.
В другом примере звёзды белых карликов, которые больше не производят энергию, могут быть изолированы световыми годами почти до идеального вакуума в межзвёздном пространстве, но в итоге они будут охлаждаться с нескольких десятков тысяч градусов почти до абсолютного нуля в связи с потерей энергии из-за излучения. Хотя этот процесс занимает больше времени, чем нынешний век Вселенной, его не остановить.
Хотя этот процесс занимает больше времени, чем нынешний век Вселенной, его не остановить.
Применение на практике
Наиболее распространённым практическим применением I закона является тепловой двигатель. Он преобразует тепловую энергию в механическую и наоборот. Большинство таких двигателей попадает в категорию открытых систем. Их основной принцип использует взаимосвязь между теплом, объёмом и давлением рабочей жидкости, которая обычно является газом. В некоторых случаях она может подвергаться фазовым переходам от газа к жидкости и обратно во время цикла.
Если газ подвергается нагреванию, он расширяется, но когда он ограничен, давление увеличивается. Если нижняя стенка удерживающей камеры является верхом подвижного поршня, то давление оказывает силу на поверхность, заставляя его двигаться вниз. Это движение затем можно использовать для выполнения работы, равной суммарному усилию, приложенному к верхней части поршня, умноженному на расстояние, на которое он перемещается.
Существуют многочисленные вариации основного теплового двигателя. Например, паровые двигатели полагаются на внешнее сгорание, чтобы нагреть бак котла, содержащий рабочую жидкость, обычно воду. Она превращается в пар, а затем давление используется для привода поршня, который преобразует тепловую энергию в механическую. Однако в автомобильных двигателях используется внутреннее сгорание, когда жидкое топливо испаряется, смешивается с воздухом и воспламеняется внутри цилиндра над подвижным поршнем, приводящим его в движение вниз.
Холодильники и тепловые насосы — это двигатели, которые преобразуют механическую энергию в тепло. Большинство из них попадает в категорию закрытых систем. Когда газ сжимается, его температура увеличивается. Он может затем передавать тепло в окружающую среду. Затем, когда сжатому газу позволяют расширяться, его температура становится ниже, чем была до сжатия, потому что часть его тепловой энергии оказалась удалена во время горячего цикла. Холодный газ может затем поглощать тепловую энергию из окружающей среды. Это принцип работы кондиционера.
Это принцип работы кондиционера.
Кондиционеры на самом деле не производят холод, они удаляют тепло. Рабочая жидкость переносится наружу механическим насосом, где нагревается компрессией. После этого он передаёт это тепло наружной среде через теплообменник с воздушным охлаждением. Затем он возвращается в помещение, где ему разрешается расширяться и охлаждаться, чтобы он мог поглощать тепло из воздуха через другой теплообменник.
Тепловой насос — это просто кондиционер, работающий в обратном направлении. Тепло от сжатой рабочей жидкости используется для обогрева здания. После этого он переносится наружу, где расширяется и становится холодным, что позволяет ему поглощать тепло из наружного воздуха, который даже зимой обычно теплее, чем холодная рабочая жидкость.
В геотермальных или наземных системах кондиционирования воздуха и тепловых насосах используются длинные U-образные трубки в глубоких скважинах или набор горизонтальных труб, погруженных в большую площадь, по которой циркулирует рабочая жидкость, а тепло передаётся на землю или из нее. Другие системы используют реки или океаническую воду для нагрева или охлаждения рабочей жидкости.
Другие системы используют реки или океаническую воду для нагрева или охлаждения рабочей жидкости.
Основные изопроцессы
Поскольку тепловые двигатели могут пройти сложную последовательность шагов, упрощённая модель часто используется для иллюстрации принципов термодинамики. В частности, можно рассмотреть газ, который расширяется и сжимается в цилиндре с подвижным поршнем при заданном наборе условий. Применение первого закона термодинамики к изопроцессам содержит два таких набора:
 Однако этот процесс не нарушает фундаментальных ограничений по эффективности, поскольку само по себе расширение не является циклическим процессом.
Однако этот процесс не нарушает фундаментальных ограничений по эффективности, поскольку само по себе расширение не является циклическим процессом. Многие природные явления адиабатны, потому что времени для значительного теплового потока недостаточно. Например, когда тёплый воздух поднимается в атмосферу, он расширяется и охлаждается по мере того, как давление падает при наборе высоты. Но он является хорошим теплоизолятором, поэтому нет значительного теплового потока от него. В этом случае окружающий воздух играет роль стенок изолированного цилиндра и подвижного поршня.
Например, когда тёплый воздух поднимается в атмосферу, он расширяется и охлаждается по мере того, как давление падает при наборе высоты. Но он является хорошим теплоизолятором, поэтому нет значительного теплового потока от него. В этом случае окружающий воздух играет роль стенок изолированного цилиндра и подвижного поршня.
Тёплый воздух работает против давления, создаваемого окружающим воздухом при его расширении, поэтому его температура должна падать. Более подробный анализ этого адиабатического расширения объясняет бо́льшую часть понижения температуры с высотой, учитывая известный факт, что на вершине горы холоднее, чем у её основания.
Тепло, подаваемое при постоянном давлении, также известно как изобарный процесс. При нем не происходит изменения давления во время подачи тепла в систему.
Первое начало термодинамики рассматривается многими как основа концепции сохранения энергии. В основном это говорит о том, что энергия, которая поступает в систему, не может быть потеряна по пути, но должна быть использована для того, чтобы изменить внутреннюю энергию, либо выполнить работу. С этой точки зрения он является одним из самых обширных научных понятий, когда-либо обнаруженных.
С этой точки зрения он является одним из самых обширных научных понятий, когда-либо обнаруженных.
Предыдущая
ФизикаЗакон Кулона — взаимодействие электрических зарядов, формула и задачи
Следующая
ФизикаПостроение изображений в линзах — виды, правила и формулы
Первый закон термодинамики – формула, определение, применение
Важнейшим законом, на котором основываются термодинамические расчеты для самых различных случаев, является Первый Закон термодинамики (иногда говорится Первое Начало термодинамики). Рассмотрим этот закон подробнее.
Содержание
- Энергия и ее сохранение
- Первый Закон термодинамики
- Вечный Двигатель и Первый Закон термодинамики
- Что мы узнали?
Энергия и ее сохранение
Энергия – это общая физическая мера взаимодействий и движений в Природе. Понятие энергии было использовано еще Аристотелем для обозначения механической работы. Позже оно было математически формализовано Г. Лейбницем (он, фактически описал кинетическую энергию), а впервые использовано в современном смысле Т. Юнгом.
Позже оно было математически формализовано Г. Лейбницем (он, фактически описал кинетическую энергию), а впервые использовано в современном смысле Т. Юнгом.
Одно из важнейших свойств энергии – ее сохранение в замкнутой системе. Энергия не может возникать и исчезать. Все процессы в Природе лишь перераспределяют энергию между различными телами и видами.
Однако, доказать это свойство удалось далеко не сразу. Если рассмотреть примеры различных механических процессов с потерей энергии в результате трения, то все выглядит так, как будто механическая энергия исчезает. То, что при трении происходит нагрев, было известно давно, однако, то, что тепло является энергией, которая при трении перешла из кинетической во внутреннюю, впервые отмечено лишь в конце XVIIв Г. Лейбницем.
Современный вид закон сохранения энергии принял в работах Р. Майера.
Рис. 1. Р. Майер.
Позже он был расширен Дж. Джоулем, а окончательную строгую формулировку получил в трудах Г. Гельмгольца.
Полное теоретическое обоснование закона было получено лишь в 1918 г Э. Нёттер. Было доказано, что закон сохранения энергии – это следствие симметрии времени (равноправности всех моментов времени в замкнутой инерциальной системе).
Первый Закон термодинамики
Закон сохранения энергии, распространенный на тепловые явления, стал называться Первым Законом (иногда говорится Первым Началом) термодинамики.
Если в механике рассматривается энергия движения тел, то термодинамика рассматривает их внутреннюю энергию, а также ее изменение за счет совершения работы либо за счет теплообмена. Вся энергия, полученная телом за счет этих двух способов, пойдет на увеличение внутренней энергии. То есть, суть Первого Закона термодинамики будет сформулирована следующим образом.
Изменение внутренней энергии системы равно сумме работы внешних сил над системой и количества теплоты, переданной системе.
Математически формула первого закона термодинамики имеет вид:
$$ΔU=A+Q,$$
где:
- $ΔU$ – изменение внутренней энергии системы;
- $A$ – работа внешних сил над системой;
- $Q$ – количество теплоты, переданное системе.

Рис. 2. Первый Закон термодинамики.
Из представленной формулы Первого Закона термодинамики следует, что, после того, как системе были подведены тепло и работа, говорить о том, что тело «содержит» это количество теплоты или работы нельзя. Подводимая к телу теплота или совершаемая работа влияет только на изменение внутренней энергии. Определение же общего количества внутренней энергии тела может быть получено в рамках не термодинамики, а молекулярно-кинетической теории. Характеристикой общей внутренней энергии тела является температура.
Также из данной формулы можно получить закон сохранения внутренней энергии. В самом деле, для изолированной системы работа внешних сил и количество теплоты равно нулю ( $A = 0$ и $Q = 0$). А значит, $ΔU = U_2 – U_1 = 0$ или $U_2 = U_1$, то есть:
$$U=const, при A=0,Q=0$$
Внутренняя энергия изолированной системы постоянна.
Вечный Двигатель и Первый Закон термодинамики
Устройство, совершающее работу без затрат энергии, называется Вечным Двигателем первого рода. Применение такого устройства сулит пользователю огромную выгоду. Многие изобретатели прошлого пытались построить такую машину, но всегда терпели неудачу.
Применение такого устройства сулит пользователю огромную выгоду. Многие изобретатели прошлого пытались построить такую машину, но всегда терпели неудачу.
Рис. 3. Примеры Вечного Двигателя первого рода.
Причина кроется в нарушении таким Вечным Двигателем Первого Закона термодинамики.
Если система не получает тепло, то полезная работа (то есть, работа, которую совершает система над внешними объектами) может быть совершена только за счет уменьшения внутренней энергии:
$$А_{полезн}=-ΔU$$
А значит, рано или поздно запасы внутренней энергии будут израсходованы, и двигатель не сможет совершать полезную работу. Смысл же Вечного Двигателя в постоянном совершении работы.
Что мы узнали?
Первый Закон термодинамики гласит, что изменение внутренней энергии системы равно сумме работы внешних сил и количества теплоты, переданной системе. Этот закон является следствием закона сохранения энергии, который, в свою очередь, является следствием симметрии времени. Первый Закон термодинамики обосновывает невозможность существования Вечного Двигателя первого рода.
Первый Закон термодинамики обосновывает невозможность существования Вечного Двигателя первого рода.
Предыдущая
ФизикаАдиабатный процесс – формула, уравнение с примерами
Следующая
ФизикаУравнение Менделеева-Клапейрона – формула для идеального газа, вывод
Формулировки второго закона термодинамики
Как генерируется энергия, как она преобразуется из одной формы в другую и что происходит с энергией в замкнутой системе? На все эти вопросы помогут дать ответ законы термодинамики. Подробнее сегодня будет рассмотрен второй закон термодинамики.
Законы в повседневной жизни
Законы управляют повседневной жизнью. В дорожных законах говорится, что нужно остановиться на знаках остановки. Правительственные требуют предоставить часть своей зарплаты государству и федеральному правительству. Даже научные применимы к повседневной жизни. Например, закон силы тяжести предсказывает довольно плохой результат для тех, кто пытается летать. Другой набор научных законов, которые влияют на повседневную жизнь, – это законы термодинамики. Итак, можно привести ряд примеров, чтобы увидеть, как они влияют на повседневную жизнь.
Другой набор научных законов, которые влияют на повседневную жизнь, – это законы термодинамики. Итак, можно привести ряд примеров, чтобы увидеть, как они влияют на повседневную жизнь.
Первый закон термодинамики
Первый закон термодинамики гласит, что энергия не может быть создана или уничтожена, но можно преобразовать ее из одной формы в другую. Это также иногда называют законом сохранения энергии. Итак, как это относится к повседневной жизни? Ну, взять, к примеру, компьютер, который вы используете сейчас. Он питается энергией, но откуда эта энергия? Первый закон термодинамики говорит нам, что эта энергия не могла появиться из-под воздуха, поэтому она откуда-то появилась.
Можно отследить эту энергию. Компьютер питается от электричества, но откуда это электричество? Правильно, с электростанции или гидроэлектростанции. Если рассматривать вторую, то она будет связана с плотиной, которая сдерживает реку. У реки есть связь с кинетической энергией, а это означает, что река течет. Плотина превращает эту кинетическую энергию в потенциальную энергию.
Плотина превращает эту кинетическую энергию в потенциальную энергию.
Как работает гидроэлектростанция? Вода используется для вращения турбины. При вращении турбины приводится в действие генератор, который будет создавать электричество. Это электричество может быть проложено полностью в проводах от электростанции до вашего дома, чтобы при подключении шнура питания к электрической розетке электричество проникало в ваш компьютер, чтобы он мог работать.
Что произошло здесь? Уже было определенное количество энергии, которая была связана с водой в реке как кинетическая энергия. Потом она превратилась в потенциальную энергию. Затем плотина приняла эту потенциальную энергию и превратила ее в электричество, которое затем смогло попасть в ваш дом и привести в действие компьютер.
Второй закон термодинамики
Изучив этот закон, можно понять, как работает энергия и почему все движется к возможному хаосу и беспорядку. Второй закон термодинамики еще называют законом энтропии. Вы когда-нибудь задумывались, как возникла Вселенная? Согласно Теории Большого Взрыва, до того, как зародилось все вокруг, вместе собралось огромное количество энергии. После Большого Взрыва появилась Вселенная. Все это хорошо, только что это была за энергия? В начале времени вся энергия во Вселенной содержалась в одном относительно небольшом месте. Эта интенсивная концентрация представляла собой огромное количество того, что называется потенциальной энергией. Со временем она распространилась по огромному пространству нашей Вселенной.
После Большого Взрыва появилась Вселенная. Все это хорошо, только что это была за энергия? В начале времени вся энергия во Вселенной содержалась в одном относительно небольшом месте. Эта интенсивная концентрация представляла собой огромное количество того, что называется потенциальной энергией. Со временем она распространилась по огромному пространству нашей Вселенной.
В гораздо меньших масштабах резервуар воды, удерживаемый плотиной, содержит потенциальную энергию, так как ее расположение дает возможность протекать через плотину. В каждом случае запасенная энергия, однажды выпущенная, распространяется и делает это без каких-либо прилагаемых усилий. Другими словами, высвобождение потенциальной энергии является спонтанным процессом, который возникает без необходимости в дополнительных ресурсах. По мере того, как энергия распространяется, часть ее преобразуется в полезную и выполняет определенную работу. Остальная преобразуется в непригодную, просто называемую теплотой.
Поскольку Вселенная продолжает распространяться, она содержит все менее и менее полезную энергию. Если менее полезная доступна, меньше работы может быть сделано. Так как вода течет через плотину, она также содержит менее полезную энергию. Это уменьшение полезной энергии с течением времени называется энтропией, где энтропия – это количество неиспользуемой энергии в системе, а система – это просто совокупность объектов, составляющих целое.
Если менее полезная доступна, меньше работы может быть сделано. Так как вода течет через плотину, она также содержит менее полезную энергию. Это уменьшение полезной энергии с течением времени называется энтропией, где энтропия – это количество неиспользуемой энергии в системе, а система – это просто совокупность объектов, составляющих целое.
Энтропия также может упоминаться как количество случайностей или хаоса в организации без организации. По мере того как полезная энергия уменьшается с течением времени, дезорганизация и хаос увеличиваются. Таким образом, по мере освобождения накопленной потенциальной энергии не все это преобразуется в полезную. Все системы испытывают это увеличение энтропии с течением времени. Это очень важно понять, и это явление называют вторым законом термодинамики.
Энтропия: случайность или дефект
Как вы, возможно, догадались, второй закон следует за первым, который обычно называют законом сохранения энергии, и он утверждает, что энергия не может быть создана и ее нельзя уничтожить. Другими словами, количество энергии во Вселенной или любой системе является постоянным. Второй закон термодинамики обычно называют законом энтропии, и он считает, что с течением времени энергия становится менее полезной, а качество ее уменьшается со временем. Энтропия – это степень случайности или дефектов, которые имеет система. Если система очень неупорядоченная, то она обладает большой энтропией. Если в системе много неисправностей, то энтропия низкая.
Другими словами, количество энергии во Вселенной или любой системе является постоянным. Второй закон термодинамики обычно называют законом энтропии, и он считает, что с течением времени энергия становится менее полезной, а качество ее уменьшается со временем. Энтропия – это степень случайности или дефектов, которые имеет система. Если система очень неупорядоченная, то она обладает большой энтропией. Если в системе много неисправностей, то энтропия низкая.
Говоря простыми словами, второй закон термодинамики гласит, что энтропия системы не может со временем уменьшаться. Это означает, что в природе вещи переходят от состояния порядка к состоянию беспорядка. И это необратимо. Система никогда не станет более упорядоченной сама по себе. Другими словами, в природе энтропия системы всегда увеличивается. Один из способов подумать об этом – это ваш дом. Если вы его никогда не будете убирать и пылесосить, то довольно скоро у вас будет ужасный бардак. Энтропия увеличилась! Чтобы уменьшить ее, необходимо применять энергию для использования пылесоса и швабры, чтобы очистить от пыли поверхность. Дом сам себя не уберет.
Дом сам себя не уберет.
Что представляет собой второй закон термодинамики? Формулировка простыми словами гласит, что при изменении энергии из одной формы в другую форму, материя либо движется свободно, либо энтропия (беспорядок) в замкнутой системе увеличивается. Различия в температуре, давлении и плотности имеют тенденцию выравниваться горизонтально через некоторое время. Из-за силы тяжести плотность и давление не выравниваются вертикально. Плотность и давление на дне будут больше, чем сверху. Энтропия – это мера распространения материи и энергии везде, где у нее есть доступ. Наиболее распространенная формулировка второго закона термодинамики в основном связана с Рудольфом Клаузиусом, который говорил:
Невозможно построить устройство, которое не производит другого эффекта, чем перенос тепла из тела с более низкой температурой в тело с более высокой температурой.
Другими словами, все пытается поддерживать ту же температуру с течением времени. Существует много формулировок второго закона термодинамики, в которых используются разные термины, но все они означают одно и то же. Другое заявление Клаузиуса:
Существует много формулировок второго закона термодинамики, в которых используются разные термины, но все они означают одно и то же. Другое заявление Клаузиуса:
Тепло само по себе не происходит от холодного до более горячего тела.
Второй закон применим только к крупным системам. Он касается вероятного поведения системы, в которой нет энергии или материи. Чем больше система, тем более вероятен второй закон.
Еще одна формулировка закона:
Полная энтропия всегда увеличивается в самопроизвольном процессе.
Увеличение энтропии ΔS при протекании процесса должно превышать или быть равным отношению количества теплоты Q, переданного системе, к температуре Т, при которой теплота передается. Формула второго закона термодинамики:
Термодинамическая система
В общем смысле формулировка второго закона термодинамики простыми словами гласит, что температурные различия между системами, находящимися в контакте друг с другом, имеют тенденцию к выравниванию и что работа может быть получена из этих неравновесных различий. Но при этом происходит потеря тепловой энергии, а энтропия увеличивается. Различия давления, плотности и температуры в изолированной системе имеют тенденцию выравниваться, если им предоставляется возможность; плотность и давление, но не температура, зависят от силы тяжести. Тепловой двигатель представляет собой механическое устройство, которое обеспечивает полезную работу из-за разницы в температуре двух тел.
Но при этом происходит потеря тепловой энергии, а энтропия увеличивается. Различия давления, плотности и температуры в изолированной системе имеют тенденцию выравниваться, если им предоставляется возможность; плотность и давление, но не температура, зависят от силы тяжести. Тепловой двигатель представляет собой механическое устройство, которое обеспечивает полезную работу из-за разницы в температуре двух тел.
Термодинамическая система – это та, которая взаимодействует и обменивается энергией с областью вокруг нее. Обмен и передача должны произойти, по крайней мере, двумя способами. Один путь должен быть передачей тепла. Если термодинамическая система «находится в равновесии», она не может изменять свое состояние или статус без взаимодействия с окружающей средой. Проще говоря, если вы находитесь в равновесии, вы «счастливая система», вы ничего не можете сделать. Если вы что-то захотите сделать, вы должны взаимодействовать с окружающим миром.
Второй закон термодинамики: необратимость процессов
Невозможно иметь циклический (повторяющийся) процесс, который полностью преобразует тепло в работу. Также невозможно иметь процесс, который переносит тепло от холодных объектов на теплые объекты без использования работы. Некоторое количество энергии в реакции всегда теряется для нагревания. Кроме того, система не может преобразовать всю свою энергию в рабочую энергию. Вторая часть закона более очевидна.
Также невозможно иметь процесс, который переносит тепло от холодных объектов на теплые объекты без использования работы. Некоторое количество энергии в реакции всегда теряется для нагревания. Кроме того, система не может преобразовать всю свою энергию в рабочую энергию. Вторая часть закона более очевидна.
Холодное тело не может нагревать теплое тело. Тепло естественным образом стремится течь от более теплых до более прохладных областей. Если тепло перейдет от более прохладного к более теплым, это противоречит тому, что является «естественным», поэтому система должна выполнить некоторую работу, чтобы это произошло. Необратимость процессов в природе – второй закон термодинамики. Это, пожалуй, самый известный (по крайней мере, среди ученых) и важный закон всей науки. Одна из его формулировок:
Энтропия Вселенной стремится к максимуму.
Другими словами, энтропия либо остается неизменной, либо становится больше, энтропия Вселенной никогда не может снизиться. Проблема в том, что это всегда верно. Если взять флакон духов и распылить его в комнате, то скоро ароматные атомы заполнят все пространство, и этот процесс является необратимым.
Проблема в том, что это всегда верно. Если взять флакон духов и распылить его в комнате, то скоро ароматные атомы заполнят все пространство, и этот процесс является необратимым.
Взаимосвязи в термодинамике
В законах термодинамики описываются взаимосвязи между тепловой энергией или теплом и другими формами энергии, и как энергия влияет на материю. Первый закон термодинамики гласит, что энергия не может быть создана или уничтожена; общее количество энергии во Вселенной остается неизменным. Второй закон термодинамики посвящен качеству энергии. В нем говорится, что по мере передачи или преобразования энергии все больше и больше теряется полезной энергии. Второй закон также гласит, что существует естественная тенденция превращения любой изолированной системы в более неупорядоченное состояние.
Даже когда порядок увеличивается в определенном месте, когда вы принимаете во внимание всю систему, включая окружающую среду, всегда наблюдается увеличение энтропии. В другом примере кристаллы могут образовываться из раствора соли, когда вода выпаривается. Кристаллы более упорядочены, чем молекулы соли в растворе; однако испаренная вода гораздо более беспорядочна, чем жидкая вода. Процесс, взятый в целом, приводит к чистому увеличению беспорядка.
Кристаллы более упорядочены, чем молекулы соли в растворе; однако испаренная вода гораздо более беспорядочна, чем жидкая вода. Процесс, взятый в целом, приводит к чистому увеличению беспорядка.
Работа и энергия
Во втором законе объясняется, что невозможно преобразовать тепловую энергию в механическую энергию со 100-процентной эффективностью. Можно привести пример с автомобилем. После процесса нагрева газа, чтобы увеличить его давление для привода поршня, в газе всегда остается некоторое количество тепла, которое нельзя использовать для выполнения каких-либо дополнительных работ. Это отработанное тепло должно быть отброшено путем его передачи в радиатор. В случае с автомобильным двигателем это делается путем извлечения отработанного топлива и воздушной смеси в атмосферу.
Кроме того, любое устройство с подвижными частями создает трение, которое преобразует механическую энергию в тепло, которое обычно непригодно и должно быть удалено из системы путем переноса его в радиатор. Когда горячее и холодное тело контактируют друг с другом, тепловая энергия будет поступать из горячего тела в холодное тело до тех пор, пока они не достигнут теплового равновесия. Тем не менее, тепло никогда не вернется в другую сторону; разница температур двух тел никогда не будет спонтанно увеличиваться. Перемещение тепла от холодного тела к горячему телу требует работы, которую должен выполнять внешний источник энергии, такой как тепловой насос.
Когда горячее и холодное тело контактируют друг с другом, тепловая энергия будет поступать из горячего тела в холодное тело до тех пор, пока они не достигнут теплового равновесия. Тем не менее, тепло никогда не вернется в другую сторону; разница температур двух тел никогда не будет спонтанно увеличиваться. Перемещение тепла от холодного тела к горячему телу требует работы, которую должен выполнять внешний источник энергии, такой как тепловой насос.
Судьба Вселенной
Второй закон также предсказывает конец Вселенной. Это конечный уровень беспорядка, если везде будет постоянное тепловое равновесие, никакая работа не может быть выполнена, и вся энергия будет заканчиваться как случайное движение атомов и молекул. По современным данным, Метагалактика – это расширяющаяся нестационарная система, о тепловой смерти Вселенной и речи быть не может. Тепловая смерть – это состояние теплового равновесия, при котором прекращаются все процессы.
Это положение ошибочно, так как второй закон термодинамики применяется только к замкнутым системам. А Вселенная, как известно, безгранична. Однако сам термин «тепловая смерть Вселенной» иногда используется для обозначения сценария будущего развития Вселенной, согласно которому она так и будет расширяться до бесконечности во тьму пространства, пока не обратится в рассеянный холодный прах.
А Вселенная, как известно, безгранична. Однако сам термин «тепловая смерть Вселенной» иногда используется для обозначения сценария будущего развития Вселенной, согласно которому она так и будет расширяться до бесконечности во тьму пространства, пока не обратится в рассеянный холодный прах.
Второй закон термодинамики – формула, определение кратко
4.4
Средняя оценка: 4.4
Всего получено оценок: 307.
4.4
Средняя оценка: 4.4
Всего получено оценок: 307.
Все процессы в природе происходят с сохранением энергии. Об этом говорит Первый Закон термодинамики. При этом энергия может изменять свою форму, и передаваться между телами. Направление передачи энергии устанавливает Второй Закон термодинамики (иногда говорят Второе Начало термодинамики). Кратко рассмотрим его суть.
Направление потоков энергии
Изучая процессы передачи энергии между телами, можно заметить, что энергия всегда передается от тела, обладающего большей энергией, к телу, у которого энергии меньше.
При этом Первый Закон термодинамики вовсе не запрещает и обратные процессы. Холодное тело, температура которого выше абсолютного нуля, обладает некоторой внутренней энергией, а значит, эту энергию можно передать телу с более высокой температурой, нарушения Первого Закона не произойдет.
Однако опыт говорит о том, что таких процессов в Природе не бывает. Следовательно, существует закон, определяющий направление передачи энергии. Этот закон получил название Второго Закона (начала) термодинамики.
Второй Закон термодинамики
Второй Закон термодинамики был сформулирован в работах физика Р.Клаузиуса. Он дал ему следующее определение:
Невозможно перенести тепло от более холодной системы к более горячей без других изменений в обеих системах или окружающих телах.
Замечание «без других изменений» принципиально. Оно говорит о том, что передача тепла от более холодного тела к горячему все же возможна, но при этом необходимо затратить дополнительную энергию.
Второй Закон термодинамики распространяется на любые процессы, в которых изменяется внутренняя энергия тел. Превращение механической энергии в тепло также подчиняется этому закону. Обратный процесс, когда внутренняя энергия тела превратится в механическую, возможен только с затратами дополнительной энергии.
Обратимые и необратимые процессы
Следствием Второго Закона термодинамики является необратимость всех процессов в Природе.
Обратимый процесс – это процесс, который может происходить в прямом и обратном направлении, проходя через одни и те же промежуточные состояния без изменений в окружающих телах. Процесс, который может самопроизвольно протекать только в одном направлении, а для протекания в обратном направлении необходимо внешнее воздействие, называется необратимым.
Поскольку практически во всех процессах в Природе происходит изменение внутренней энергии, все они являются необратимыми. Обратимыми они являются только с некоторой степенью точности. Например, процесс одного колебания маятника можно считать обратимым – прямое и обратное качание груза практически полностью зеркальны.
Рис. 2. Необратимые процессы в термодинамике.Энтропия системы
Действие Второго Закона термодинамики объясняется его статистическим характером. Теплота тела характеризует среднюю энергию большого числа его молекул. Среди этих молекул могут быть и более энергичные, и менее энергичные.
Но, для того, чтобы одна часть тела стала теплее, а другая холоднее – необходимо чтобы все более энергичные молекулы оказались в одной части, а все менее энергичные – в другой. В связи с огромным числом молекул в веществе, вероятность такого события можно считать нулевой. Любое же направленное движение – это упорядоченное движение всех молекул тела. Без внешнего воздействия вероятность такого упорядоченного движения также нулевая.
Поэтому, хотя отдельные движения молекул могут быть любыми, макроскопическое состояние системы всегда переходит к более вероятному, более хаотичному. Мерой хаоса системы является специальное понятие – энтропия системы $S$.
Рис. 3. Мера беспорядка энтропия.Чем выше энтропия системы, тем более беспорядочно движутся ее составляющие. Все процессы в природе текут в сторону увеличения энтропии, поскольку это направление более вероятно.
Таким образом, если тело имеет температуру $T$, и ему передано количество тепла $ΔQ$, то формула второго закона термодинамики будет выражена соотношением:
$$ΔS \geq { ΔQ \over T}$$
Что мы узнали?
Второй Закон термодинамики гласит, что тепло более горячей системы переходит только в сторону более холодной. Это необратимый процесс, который идет всегда в сторону большего хаоса (в сторону увеличения энтропии). Чтобы тепло перешло от более холодной системы к более горячей, необходимо внешнее воздействие.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Николай Поликарпов
10/10
Кристина Иконникова
10/10
Лариса Еремия
10/10
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 307.
А какая ваша оценка?
Что такое первый закон термодинамики?
Горячий газ, заключенный в камере, оказывает давление на поршень, заставляя его двигаться вниз. Движение можно использовать для выполнения работы, равной общей силе, приложенной к верхней части поршня, умноженной на расстояние, на которое перемещается поршень. (Изображение предоставлено: GoodIll | Shutterstock)Похожие материалы
Первый закон термодинамики гласит, что теплота является формой энергии, поэтому термодинамические процессы подчиняются принципу сохранения энергии. Это означает, что тепловая энергия не может быть создана или уничтожена, согласно Britannica . Однако его можно перемещать из одного места в другое и преобразовывать в другие формы энергии и из них.
Термодинамика — это раздел физики, изучающий отношения между теплотой и другими формами энергии. В частности, он описывает, как тепловая энергия преобразуется в другие формы энергии и из них, и как это влияет на материю. Фундаментальные принципы термодинамики выражены в четырех законах.
«Первый закон гласит, что внутренняя энергия системы должна быть равна работе, совершаемой над системой, плюс или минус теплота, втекающая в систему или выходящая из нее, и любая другая работа, совершаемая над системы», — сказал Live Science Сайбал Митра, профессор физики Университета штата Миссури. «Итак, это новое заявление о сохранении энергии».
«Изменение внутренней энергии системы представляет собой сумму всех энергетических входов и выходов в систему и из нее, подобно тому, как все ваши депозиты и снятия определяют изменения в вашем банковском балансе», — сказал Митра.
Это выражается математически как: Δ U = Q — Вт , где Δ U — изменение внутренней энергии, Q — теплота, подведенная к системе, а Вт — работа, проделанная системой, согласно Britannica.
История первого закона термодинамики
Ученые в конце 18-го и начале 19-го веков придерживались теории теплоты, впервые предложенной Антуаном Лавуазье в 1783 году и получившей дальнейшее развитие в работах Сади Карно в 1824 году, согласно данным American Physical Общество (откроется в новой вкладке). Эта научная теория рассматривала тепло как своего рода жидкость, которая естественным образом перетекает из горячих областей в холодные, подобно тому, как вода течет из высоких мест в низкие. Когда эта теплотворная жидкость перетекала из горячей области в холодную, ее можно было преобразовать в кинетическую энергию и заставить выполнять работу так же, как падающая вода приводит в движение водяное колесо. По данным Университета Вирджинии, только когда Рудольф Клаузиус опубликовал «Механическую теорию тепла» в 1867 году, теория калорий была окончательно положена в конец, согласно Университету Вирджинии .
Термодинамические системы
Энергию можно разделить на две части, сказал Дэвид Макки, профессор физики Южного государственного университета Миссури. Одним из них является наш макроскопический вклад в человеческом масштабе, такой как поршень, движущийся и толкающий систему газа. Остальное состоит из вещей, которые происходят в очень маленьком масштабе, где мы не можем отследить вклад каждого отдельного человека.
Одним из них является наш макроскопический вклад в человеческом масштабе, такой как поршень, движущийся и толкающий систему газа. Остальное состоит из вещей, которые происходят в очень маленьком масштабе, где мы не можем отследить вклад каждого отдельного человека.
«Когда я ставлю два образца металла друг против друга, и атомы стучат на границе, и два атома отскакивают друг от друга, и один из них отрывается быстрее другого, я не могу уследить Это происходит в очень небольшом временном масштабе и на очень небольшом расстоянии, и это происходит много-много раз в секунду», — сказал Макки в интервью Live Science. «Итак, мы просто делим всю передачу энергии на две группы: то, что мы будем отслеживать, и то, что мы не будем отслеживать. Последнее из них мы называем теплом».
Термодинамические системы обычно рассматриваются как открытые, закрытые или изолированные. По данным Университета Калгари , открытая система свободно обменивается энергией и веществом с окружающей средой; замкнутая система обменивается с окружающей средой энергией, но не материей; и изолированная система не обменивается энергией или веществом с окружающей средой. Например, кастрюля с кипящим супом получает энергию от плиты, излучает тепло от кастрюли и выделяет вещество в виде пара, который также уносит тепловую энергию. Это будет открытая система. Если мы накроем кастрюлю плотно крышкой, она по-прежнему будет излучать тепловую энергию, но в идеале больше не будет выделять материю в виде пара. Это будет закрытая система. Однако, если бы мы налили суп в идеально изолированный термос и запечатали крышку, в систему не попало бы ни энергии, ни материи. Это будет изолированная система.
Например, кастрюля с кипящим супом получает энергию от плиты, излучает тепло от кастрюли и выделяет вещество в виде пара, который также уносит тепловую энергию. Это будет открытая система. Если мы накроем кастрюлю плотно крышкой, она по-прежнему будет излучать тепловую энергию, но в идеале больше не будет выделять материю в виде пара. Это будет закрытая система. Однако, если бы мы налили суп в идеально изолированный термос и запечатали крышку, в систему не попало бы ни энергии, ни материи. Это будет изолированная система.
Однако на практике идеально изолированные системы не могут существовать. Все системы передают энергию окружающей среде независимо от того, насколько хорошо они изолированы. Суп в термосе будет оставаться горячим всего несколько часов и на следующий день достигнет комнатной температуры. В другом примере белые карлики, горячие остатки сгоревших звезд, которые больше не производят энергию, могут быть изолированы световыми годами почти идеального вакуума в межзвездном пространстве, но в конечном итоге они остынут с нескольких десятков тысяч градусов. почти до абсолютного нуля из-за потерь энергии на излучение. Хотя этот процесс занимает больше времени, чем нынешний возраст Вселенной, остановить его невозможно.
почти до абсолютного нуля из-за потерь энергии на излучение. Хотя этот процесс занимает больше времени, чем нынешний возраст Вселенной, остановить его невозможно.
Тепловые двигатели
Наиболее распространенным практическим применением первого закона является тепловой двигатель. Тепловые двигатели преобразуют тепловую энергию в механическую и наоборот. Большинство тепловых двигателей относятся к категории открытых систем. По данным Университета штата Джорджия, основной принцип работы тепловой машины использует взаимосвязь между теплом, объемом и давлением рабочей жидкости (любого вещества, которое течет), обычно газа. Примеры рабочих жидкостей включают пар в паровой машине и гидрофторуглероды в холодильных системах.
При нагревании газ расширяется; однако, когда этот газ не расширяется, его давление увеличивается. Если нижняя стенка камеры удержания представляет собой верхнюю часть подвижного поршня, это давление оказывает силу на поверхность поршня, заставляя его двигаться вниз. Затем это движение можно использовать для выполнения работы, равной общей силе, приложенной к верхней части поршня, умноженной на расстояние, на которое перемещается поршень.
Затем это движение можно использовать для выполнения работы, равной общей силе, приложенной к верхней части поршня, умноженной на расстояние, на которое перемещается поршень.
Существует множество вариантов базовой тепловой машины. Например, паровые двигатели полагаются на внешнее сгорание для нагрева бака котла, содержащего рабочее тело, обычно воду. Вода преобразуется в пар, а затем давление используется для привода поршня, который преобразует тепловую энергию в механическую. Автомобильные двигатели, однако, используют внутреннее сгорание, при котором жидкое топливо испаряется, смешивается с воздухом и воспламеняется внутри цилиндра над подвижным поршнем, толкая его вниз, согласно Университету Оклахомы .
Холодильники, кондиционеры и тепловые насосы
Холодильники и тепловые насосы представляют собой тепловые двигатели, преобразующие механическую энергию в тепловую. Большинство из них относятся к категории закрытых систем. При сжатии рабочего тела или газа его температура повышается. Затем этот горячий газ может передавать тепло окружающей среде. Затем, когда сжатому газу дают возможность расшириться, его температура становится ниже, чем до сжатия, потому что часть его тепловой энергии была удалена во время горячего цикла. Затем этот холодный газ может поглощать тепловую энергию из окружающей среды. По данным Бостонского университета, это принцип работы кондиционера . Кондиционеры на самом деле не производят холод; они отводят тепло.
Затем этот горячий газ может передавать тепло окружающей среде. Затем, когда сжатому газу дают возможность расшириться, его температура становится ниже, чем до сжатия, потому что часть его тепловой энергии была удалена во время горячего цикла. Затем этот холодный газ может поглощать тепловую энергию из окружающей среды. По данным Бостонского университета, это принцип работы кондиционера . Кондиционеры на самом деле не производят холод; они отводят тепло.
Механический насос перекачивает рабочую жидкость наружу, где она нагревается за счет сжатия. Затем тепло передается во внешнюю среду, обычно через теплообменник с воздушным охлаждением, в котором часто используется электрический вентилятор для отвода тепла в окружающую среду. Затем рабочая жидкость возвращается в помещение, где ей дают возможность расшириться и охладиться, чтобы она могла поглощать тепло из воздуха в помещении через другой теплообменник.
Тепловой насос — это просто кондиционер, работающий в обратном направлении. Тепло от сжатого рабочего тела используется для обогрева здания. Затем он переносится наружу, где расширяется и становится холодным, что позволяет ему поглощать тепло из наружного воздуха, который даже зимой обычно теплее холодного рабочего тела. Рабочая жидкость обычно имеет достаточно низкую температуру замерзания, чтобы продолжать течь даже при очень низких температурах.
Тепло от сжатого рабочего тела используется для обогрева здания. Затем он переносится наружу, где расширяется и становится холодным, что позволяет ему поглощать тепло из наружного воздуха, который даже зимой обычно теплее холодного рабочего тела. Рабочая жидкость обычно имеет достаточно низкую температуру замерзания, чтобы продолжать течь даже при очень низких температурах.
Геотермальные или наземные системы кондиционирования воздуха и тепловые насосы используют длинные U-образные трубы в глубоких колодцах или массив горизонтальных труб, заглубленных на большой площади, по которым циркулирует рабочая жидкость, и тепло передается к земле или от нее , по данным Министерства энергетики США . Другие системы используют речную или океанскую воду для нагрева или охлаждения рабочей жидкости.
Участник Live Science Эшли Хамер обновила эту статью 28 января 2022 г.
Дополнительные ресурсы
Вот еще три объяснения первого закона термодинамики:
- Концептуальная академия (открывается в новой вкладке) на YouTube
- Профессор наук о Земле Университета Джорджа Мейсона Роберт М.
 Хейзен на The Great Courses Daily ( открывается в новой вкладке)
Хейзен на The Great Courses Daily ( открывается в новой вкладке) - Эта глава OpenStax College Physics (открывается в новой вкладке) из Университета Айовы
Библиография
Britannica, «Первый закон термодинамики», 1 июня 2021 г. https://www.britannica .com/science/thermodynamics/The-first-law-of-thermodynamics (открывается в новой вкладке)
Институт истории науки, «Антуан-Лоран Лавуазье», 11 декабря 2017 г. Николя Леонар Сади Карно», 10 апреля 2012 г., https://www.asme.org/topics-resources/content/nicolas-leonard-sadi-carnot (открывается в новой вкладке)
Рудольф Клаузиус, «Механическая теория тепла». .» Джон Ван Ворст, 1867 г.
Американское физическое общество, «История физики в этом месяце, декабрь 1840 г .: реферат Джоуля о преобразовании механической энергии в тепло», декабрь 2009 г.. https://www.aps.org/publications/apsnews/200912/physicshistory.cfm
University of Virginia, «Teaching Heat: the Rise and Fall of the Caloric Theory», июль 2003 г. http: //galileoandeinstein.physics.virginia.edu/more_stuff/TeachingHeat.htm (открывается в новой вкладке)
http: //galileoandeinstein.physics.virginia.edu/more_stuff/TeachingHeat.htm (открывается в новой вкладке)
Университет Калгари по энергетическому образованию, «Система и окружающая среда», 27 сентября 2021 г. https://energyeducation.ca/encyclopedia/ System_and_surrounding (открывается в новой вкладке)
Гиперфизический университет Джорджии, «Цикл теплового двигателя», http://hyperphysics.phy-astr.gsu.edu/hbase/thermo/heaeng.html (открывается в новой вкладке)
Университет Оклахомы ECCourses, «Термодинамика — Теория». http://www.ecourses.ou.edu/cgi-bin/ebook.cgi?topic=th&chap_sec=08.1&page=theory (открывается в новой вкладке)
Бостонский университет, «Тепловые двигатели и второй закон», 10 декабря. 1999 г. http://physics.bu.edu/~duffy/py105/Heatengines.html (открывается в новой вкладке)
Министерство энергетики США, «Геотермальные тепловые насосы». https://www.energy.gov/energysaver/geothermal-heat-pumps (открывается в новой вкладке)
Джим Лукас — автор статей для Live Science. Он охватывает физику, астрономию и инженерное дело. Джим окончил Университет штата Миссури, где получил степень бакалавра наук в области физики, а также астрономию и техническое письмо. После окончания университета он работал в Лос-Аламосской национальной лаборатории системным администратором, техническим писателем-редактором и специалистом по ядерной безопасности. Помимо написания статей, он редактирует статьи в научных журналах по различным тематическим направлениям.
Он охватывает физику, астрономию и инженерное дело. Джим окончил Университет штата Миссури, где получил степень бакалавра наук в области физики, а также астрономию и техническое письмо. После окончания университета он работал в Лос-Аламосской национальной лаборатории системным администратором, техническим писателем-редактором и специалистом по ядерной безопасности. Помимо написания статей, он редактирует статьи в научных журналах по различным тематическим направлениям.
При участии
- Эшли Хамер, автор Live Science
термодинамика | Законы, определения и уравнения
- Ключевые люди:
- Макс Планк Джеймс Клерк Максвелл Гилберт Н. Льюис Дж. Уиллард Гиббс Илья Пригожин
- Похожие темы:
- нагревать энергия классическая термодинамика Транспортное уравнение Больцмана система
Просмотреть весь связанный контент →
Популярные вопросы
Что такое термодинамика?
Термодинамика изучает отношения между теплом, работой, температурой и энергией. Законы термодинамики описывают, как изменяется энергия в системе и может ли система выполнять полезную работу над окружающей средой.
Законы термодинамики описывают, как изменяется энергия в системе и может ли система выполнять полезную работу над окружающей средой.
Является ли термодинамика физикой?
Да, термодинамика — это раздел физики, изучающий изменение энергии в системе. Ключевое понимание термодинамики заключается в том, что тепло — это форма энергии, соответствующая механической работе (то есть действующая на объект сила на расстоянии).
Сводка
Прочтите краткий обзор этой темы
термодинамика , наука о взаимосвязи между теплом, работой, температурой и энергией. В широком смысле термодинамика имеет дело с переносом энергии из одного места в другое и из одной формы в другую. Ключевое понятие состоит в том, что теплота — это форма энергии, соответствующая определенному количеству механической работы.
Тепло не было официально признано формой энергии примерно до 179 г.8, когда граф Румфорд (сэр Бенджамин Томпсон), британский военный инженер, заметил, что при сверлении пушечных стволов может выделяться неограниченное количество тепла и что количество выделяемого тепла пропорционально работе, выполняемой при повороте тупого сверлильного инструмента. . Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим пионером был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
. Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим пионером был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
Наиболее важные законы термодинамики:
Нулевой закон термодинамики. Когда две системы находятся в тепловом равновесии с третьей системой, первые две системы находятся в тепловом равновесии друг с другом. Это свойство делает целесообразным использование термометров в качестве «третьей системы» и для определения температурной шкалы.
Первый закон термодинамики или закон сохранения энергии. Изменение внутренней энергии системы равно разнице между теплом, переданным системе из окружающей среды, и работой, совершенной системой над окружающей средой.

Второй закон термодинамики. Теплота не перетекает самопроизвольно из более холодной области в более горячую, или, что то же самое, теплота при данной температуре не может быть полностью преобразована в работу. Следовательно, энтропия замкнутой системы, или тепловая энергия на единицу температуры, со временем увеличивается до некоторого максимального значения. Таким образом, все закрытые системы стремятся к равновесному состоянию, в котором энтропия максимальна и нет энергии для выполнения полезной работы.
Третий закон термодинамики. Энтропия идеального кристалла элемента в его наиболее стабильной форме стремится к нулю, когда температура приближается к абсолютному нулю. Это позволяет установить абсолютную шкалу энтропии, которая со статистической точки зрения определяет степень случайности или беспорядка в системе.
Хотя термодинамика быстро развивалась в 19 веке в связи с необходимостью оптимизации работы паровых двигателей, широкая общность законов термодинамики делает их применимыми ко всем физическим и биологическим системам. В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Эта статья посвящена классической термодинамике, которая не включает рассмотрение отдельных атомов или молекул. Такие проблемы находятся в центре внимания раздела термодинамики, известного как статистическая термодинамика или статистическая механика, которая выражает макроскопические термодинамические свойства с точки зрения поведения отдельных частиц и их взаимодействий. Он уходит своими корнями во вторую половину XIX в.ХХ века, когда стали общепринятыми атомарная и молекулярная теории материи.
Фундаментальные концепции
Термодинамические состояния
Применение термодинамических принципов начинается с определения системы, которая в некотором смысле отличается от своего окружения. Например, системой может быть образец газа внутри цилиндра с подвижным поршнем, целая паровая машина, марафонец, планета Земля, нейтронная звезда, черная дыра или даже вся Вселенная. В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
Например, системой может быть образец газа внутри цилиндра с подвижным поршнем, целая паровая машина, марафонец, планета Земля, нейтронная звезда, черная дыра или даже вся Вселенная. В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Состояние системы в любой момент времени называется ее термодинамическим состоянием. Для газа в цилиндре с подвижным поршнем состояние системы определяется по температуре, давлению и объему газа. Эти свойства являются характеристическими параметрами, которые имеют определенные значения в каждом состоянии и не зависят от того, каким образом система пришла в это состояние. Другими словами, любое изменение значения свойства зависит только от начального и конечного состояний системы, а не от пути, пройденного системой из одного состояния в другое. Такие свойства называются функциями состояния. Напротив, работа, совершаемая при движении поршня и расширении газа, и тепло, поглощаемое газом из окружающей среды, зависят от подробного способа, которым происходит расширение.
Напротив, работа, совершаемая при движении поршня и расширении газа, и тепло, поглощаемое газом из окружающей среды, зависят от подробного способа, которым происходит расширение.
Поведение сложной термодинамической системы, такой как атмосфера Земли, можно понять, сначала применив принципы состояний и свойств к ее составным частям — в данном случае к воде, водяному пару и различным газам, составляющим атмосферу. Изолируя образцы материала, состояния и свойства которых можно контролировать и манипулировать ими, можно изучать свойства и их взаимосвязи по мере изменения системы от состояния к состоянию.
Первый закон термодинамики: что это такое?
Во Вселенной существует ограниченное количество энергии, которую нельзя уничтожить или создать, а только преобразовать. (Изображение предоставлено PixaBay)Первый закон термодинамики говорит нам, что количество энергии во Вселенной постоянно и не может быть ни уничтожено, ни создано.
Таким образом, эволюция вселенной связана с постоянным преобразованием энергии из одной формы в другую. Но независимо от того, сколько звезд и планет создала вселенная, сколько цивилизаций возникло на этих планетах, всегда будет столько же энергии, сколько было в секунду после Большой взрыв .
Но независимо от того, сколько звезд и планет создала вселенная, сколько цивилизаций возникло на этих планетах, всегда будет столько же энергии, сколько было в секунду после Большой взрыв .
Преобразование энергии — вот что заставляет наш мир работать. Люди и животные преобразуют химическую энергию съеденной ими пищи в кинетическую энергию своего движения и действия и энергию химических процессов в своих клетках. Зеленые растения поглощают энергию солнца и превращают ее в химическую энергию в форме кислорода и сахаров, из которых строятся их ткани — в процессе, известном как фотосинтез . Солнечные электростанции используют тот же солнечный свет для производства электроэнергии. Солнце, благодаря которому мы все живы, сжигает водород в своем ядре для производства света и тепла, которые нам нужны, медленно и постепенно рассеивая свою энергию в окружающем пространстве.
Связанный: Фантомная энергия и темная гравитация: объяснение темной стороны вселенной
История первого закона термодинамики
Первый закон термодинамики, однако, не возник из изучения Вселенной, но благодаря усилиям ученых 17-го и 18-го веков понять природу тепла, по словам физика Стивена Вольфрама . Выдвигались различные идеи, в том числе о том, что тепло может быть текучим веществом или результатом микроскопических частиц, из которых состоит материя, которую мы видим. К началу 19ХХ века ученые остановились на понимании того, что тепло – это форма энергии.
Выдвигались различные идеи, в том числе о том, что тепло может быть текучим веществом или результатом микроскопических частиц, из которых состоит материя, которую мы видим. К началу 19ХХ века ученые остановились на понимании того, что тепло – это форма энергии.
В то время паровой двигатель представлял собой горячую новую технологию, основанную на тепле для преобразования воды в пар, который затем мог приводить в движение сложные механические приспособления, способные выполнять все виды задач, от приведения в движение локомотивы для питания заводского оборудования. Поэтому многие одаренные умы того времени занимались вопросом, как сделать эту теплозависимую технологию более эффективной.
Согласно Университету Сент-Эндрюс, первым человеком, заложившим фундамент того, что впоследствии станет первым законом термодинамики, был немецкий физик Рудольф Клаузиус. В 1850 году Клаузиус опубликовал статью, которая сделала его знаменитым. Название статьи звучит несколько многословно: « О движущей силе тепла и выводимых отсюда законах тепла».
В этой статье Клаузиус заявил, что «во всех случаях, когда работа производится с помощью теплоты, потребляется количество теплоты, пропорциональное выполненной работе, и, наоборот, при затрате равного количества совершая работу, выделяется равное количество теплоты».
Паровой двигатель и первый закон термодинамики
Но что именно означает утверждение Клаузиуса? Давайте посмотрим на старый добрый паровой двигатель.
Паровая машина состоит из камеры с подвижным поршнем. Камера может содержать воду или некоторое количество газа. Когда камера нагревается с помощью внешнего источника тепла, газ внутри расширяется (вода превращается в пар), увеличивающееся тепло вызывает большее расширение газа, что приводит к движению поршня. Затем поршень снаружи двигателя производит полезную работу (например, приводит в движение колеса локомотива).
Наоборот, прикладывая внешнюю силу к поршню, можно сжать газ внутри, что вызовет его нагрев. В обоих случаях количество тепла, использованного или произведенного, будет равно количеству приложенной или выполненной работы. Суммарная энергия двигателя и его окружения останется постоянной.
Суммарная энергия двигателя и его окружения останется постоянной.
Первый закон термодинамики можно выразить следующим уравнением: ΔU = Q — W , где ΔU — изменение внутренней энергии, Q — теплота, подведенная к системе, а W — работа, выполненная системой.
Полная энергия системы равна подведенному теплу за вычетом количества выполненной работы. Работа и теплота — это процессы, которые добавляют или убывают энергию.
Термодинамика и роль тепла
Дисциплина, возникшая из работ Клаузиуса и других физиков той эпохи, в том числе британца Уильяма Томсона (позже известного как первый барон Кельвин) и француза Сади Карно, стала известна как термодинамика. Тепло играет центральную роль в термодинамике, действуя как сила, которая преобразует энергию из ее сырой формы (вспомните, например, уголь) в реальную механическую работу (движение локомотива).
Термодинамика изучает не только взаимосвязь между теплом и механической работой, но и роль температуры, объема и давления в обмене энергией.
Термодинамическая система имеет энтальпию , которая представляет собой сумму внутренней энергии в сочетании с эффектами давления и объема, согласно НАСА (открывается в новой вкладке).
Энтропия — мера способности системы выполнять работу, основанная на ее упорядоченности. По существу, системы различаются по количеству работы, которую они могут выполнить на единицу тепловой энергии, в зависимости от того, насколько они организованы.
Так называемая свободная энергия Гельмгольца термодинамической системы описывает, сколько «полезной» работы может произвести замкнутая термодинамическая система при постоянной температуре и объеме.
Свободная энергия Гиббса , с другой стороны, описывает максимальную обратимую работу, которую может выполнить термодинамическая система при постоянной температуре и давлении.
Эти четыре качества плюс энергия используются для описания свойств всех термодинамических систем.
Термодинамические системы
В термодинамике существуют три типа систем. (Изображение предоставлено Getty images)В термодинамике есть три типа систем: закрытые, изолированные и открытые.
Изолированных систем практически не существует. Единственной действительно изолированной системой является сама Вселенная.
Истории по теме:
Закрытые системы стремятся быть как можно более изолированными от своего окружения и обмениваться со своим окружением только энергией, но не материей. Паровой двигатель был бы закрытой системой, но такой же была бы охлаждающая термос с чаем или белый карлик звезда постепенно теряет тепло в космическом вакууме.
Все живые организмы представляют собой открытые системы, обменивающиеся с окружающей средой как энергией (тепло), так и веществом (пища, пот, воздух).
Дополнительные ресурсы
Узнайте больше о первом законе термодинамики на родственном веб-сайте Live Science . Или посмотрите это забавное видео от Королевского института. Изучите все три закона термодинамики на образовательном веб-сайте Lumen Learning .
Изучите все три закона термодинамики на образовательном веб-сайте Lumen Learning .
Библиография
Смит, К.В., Уильям Томсон и создание термодинамики: 1840–1855 гг., History of Exact Sciences, Springer, 1977
https://www.jstor.org/stable/41133471
Hareesh, T. et и др., Первый закон термодинамики и возникновение космического пространства в неплоской Вселенной, Журнал космологии и физики астрофизики, декабрь 2019 г. https://iopscience.iop.org/article/10.1088/1475-7516/2019/12 /024
Зохури, Б., Первый закон термодинамики, Физическая химия, 2017 https://www.sciencedirect.com/topics/chemistry/first-law-of-thermodynamics
Britannica, Первый закон термодинамики https://www.britannica.com/science/thermodynamics/The-second- закон термодинамики
Следите за Терезой Пултаровой в Твиттере @TerezaPultarova . Следите за нами в Twitter @Spacedotcom и в Facebook .
Присоединяйтесь к нашим космическим форумам, чтобы продолжать обсуждать последние миссии, ночное небо и многое другое! А если у вас есть новость, исправление или комментарий, сообщите нам об этом по адресу: [email protected].
Тереза — лондонский журналист, работающий в области науки и техники, начинающий писатель-фантаст и гимнастка-любитель. Родом из Праги, Чешская Республика, она провела первые семь лет своей карьеры, работая репортером, сценаристом и ведущей различных телепрограмм Чешского общественного телевидения. Позже она взяла перерыв в карьере, чтобы продолжить образование, и добавила степень магистра наук Международного космического университета во Франции к степени бакалавра журналистики и магистра культурной антропологии Карлова университета в Праге. Она работала репортером в журнале Engineering and Technology, работала внештатным сотрудником в ряде изданий, включая Live Science, Space.com, Professional Engineering, Via Satellite and Space News, а также работала научным редактором в Европейском космическом агентстве.
Термодинамика | Физика для идиотов
Содержание
|
Есть 4 закона термодинамики, и они являются одними из самых важных законов во всей физике. Законы таковы:
- Нулевой закон термодинамики. Если две термодинамические системы находятся в тепловом равновесии с третьей, то они находятся в тепловом равновесии друг с другом.
- Первый закон термодинамики – Энергия не может быть ни создана, ни уничтожена. Он может только менять формы. В любом процессе полная энергия Вселенной остается неизменной. Для термодинамического цикла чистая теплота, подводимая к системе, равна чистой работе, совершаемой системой.

- Второй закон термодинамики. Энтропия изолированной системы, не находящейся в равновесии, со временем будет увеличиваться, приближаясь к максимальному значению в состоянии равновесия.
- Третий закон термодинамики. Когда температура приближается к абсолютному нулю, энтропия системы приближается к постоянному минимуму.
Прежде чем я расскажу об этих законах более подробно, будет проще, если я сначала расскажу об энтропии.
Энтропия — очень важная вещь в области термодинамики. Это основная идея второго и третьего законов, и она проявляется повсюду. По сути, энтропия является мерой беспорядка и случайности в системе. Вот 2 примера
- Допустим, у вас есть контейнер с молекулами газа. Если все молекулы находятся в одном углу, то это будет состояние с низкой энтропией (высокоорганизованное). По мере того, как частица вылетает и заполняет остальную часть контейнера, энтропия (беспорядок) увеличивается.
- Если у вас есть мяч, летящий по воздуху, то он стартует с организованной энергией, то есть с кинетической энергией движения.
 Однако при движении в воздухе часть кинетической энергии распределяется между частицами воздуха, поэтому общая энтропия системы увеличивается (однако общая энергия сохраняется благодаря первому закону)
Однако при движении в воздухе часть кинетической энергии распределяется между частицами воздуха, поэтому общая энтропия системы увеличивается (однако общая энергия сохраняется благодаря первому закону)
Чтобы получить более подробное представление об энтропии, нам нужно рассмотреть концепцию фазового пространства. Некоторые из концепций для этого могут быть немного запутанными, но потерпите меня, как только вы разберетесь с этим, это не так уж плохо.
Фазовое пространство похоже на график, но точка на этом графике представляет все состояние системы. Давайте рассмотрим пример. Представьте, что у меня есть коробка с 4 частицами газа внутри. Каждая точка фазового пространства для этой системы говорит вам, где находятся все 4 шара в коробке.
В нашем примере нас интересуют только положения 4-х частиц, поэтому каждая точка фазового пространства должна содержать координаты x, y и z для каждой частицы, поэтому наше фазовое пространство имеет размерность 3N, где N — число частиц в системе. Итак, в нашем случае фазовое пространство 12-мерное, для того, чтобы каждая точка могла описывать расположение 4-х тел.
Итак, в нашем случае фазовое пространство 12-мерное, для того, чтобы каждая точка могла описывать расположение 4-х тел.
На всех диаграммах я буду изображать фазовое пространство в виде 2D, чтобы было легче передать, что оно на самом деле представляет. Для наших целей нам не нужно будет учитывать размеры.
Если представить, что каждая из частиц разного цвета, то нам будет легче отслеживать их положение. Если мы представим случай, когда все частицы расположены в одном углу контейнера, то мы получим ситуацию
. С точки зрения системы существует множество других комбинаций 4 частиц, которые будут организованы так же, как показано выше. состояние
и так далее. Каждая из этих установок будет соответствовать разным позициям в фазовом пространстве, поскольку все они представляют собой разные схемы системы из 4-х частиц. Если мы добавим их в фазовое пространство вместе с исходным, мы получим что-то вроде
Эти 5 расположений 4 частиц вместе с 11 другими комбинациями составляют набор состояний, которые (кроме цветов) неразличимы. Таким образом, в фазовом пространстве мы могли бы поместить прямоугольник вокруг 16 состояний, определяющий все состояния внутри него как макроскопически неразличимые.
Таким образом, в фазовом пространстве мы могли бы поместить прямоугольник вокруг 16 состояний, определяющий все состояния внутри него как макроскопически неразличимые.
Полное фазовое пространство системы будет иметь множество областей разной формы и размера и может выглядеть следующим образом:
Но как все это абстрактное представление связано с энтропией. Энтропия, заданная в уравнениях как символ , определяется тогда как
Где постоянная Больцмана () и объем ящика в фазовом пространстве. Все точки в области фазового пространства имеют одинаковую энтропию, и значение энтропии связано с логарифмом объема (первоначально Больцман никогда не вводил константу в формулу, так как его не интересовали единицы измерения. Вставка из k, казалось, пришли сначала от Планка).
Энтропию также можно определить как изменение при передаче энергии при постоянной температуре
Где — изменение энтропии, — энергия или теплота, а T — постоянная температура.
Нулевой закон назван так потому, что он появился после трех других. Законы 1, 2 и 3 существовали некоторое время назад, прежде чем важность этого закона была полностью осознана. Оказалось, что этот закон настолько важен и фундаментален, что он должен был идти впереди трех других, и вместо того, чтобы переименовать уже известные три закона, они назвали новый закон Зеро и поставили его в начале списка.
Но что это на самом деле означает? В законе указано
«Если две термодинамические системы находятся в тепловом равновесии каждая с третьей, то они находятся в тепловом равновесии друг с другом».
В принципе, если A=B и C=B, то A=C. Это может показаться настолько очевидным, что не нуждается в утверждении, но без этого закона мы не могли бы определить температуру и построить термометры.
Первый закон термодинамики в основном утверждает, что энергия сохраняется; его нельзя ни создать, ни разрушить, а только изменить с одного на другое,
«Общее количество энергии в изолированной системе сохраняется».
Энергия в системе может быть преобразована в тепло, работу или другие вещи, но у вас всегда будет та же сумма, с которой вы начали.
В качестве аналогии подумайте об энергии как о неразрушимых блоках. Если у вас есть 30 блоков, то что бы вы ни делали с блоками, в конце всегда их будет 30. Вы не можете уничтожить их, только перемещаете их или делите, но их всегда будет 30. Иногда вы можете потерять одну или несколько, но их все равно нужно учитывать, потому что Энергия Сохраняется. 9(1)
Из приведенного выше определения энтропии мы можем заменить , и мы также можем сделать замену, что даст нам
(2)
Теперь, если у нас есть система частиц, которые отличаются друг от друга, мы можем получить химические реакции, поэтому нам нужно добавить еще один член, чтобы принять это во внимание
(3)
Возможно, это самый известный (по крайней мере, среди ученых) и важный закон всей науки. Здесь утверждается;
«Энтропия Вселенной стремится к максимуму».
Другими словами, энтропия либо остается неизменной, либо увеличивается, энтропия во Вселенной никогда не может уменьшиться.
Проблема в том, что это не всегда верно. Если вы возьмете наш пример с 4 атомами в ящике, то все они, находящиеся в одном углу, представляют собой высокоупорядоченную систему и поэтому будут иметь низкую энтропию, а затем со временем они будут перемещаться, становясь более неупорядоченными и увеличивая энтропию. Но ничто не мешает им всем беспорядочно двигаться обратно в угол. Это невероятно маловероятно, но на самом деле не невозможно.
Если вы посмотрите на проблему с точки зрения фазового пространства , вы увидите, что со временем вы, скорее всего, переместитесь в большую коробку, что означает более высокую энтропию, но нет реального барьера, мешающего вам вернуться в меньшую коробку.
Третий закон обеспечивает абсолютную точку отсчета для измерения энтропии, говоря, что
«Когда температура системы приближается к абсолютному нулю (-273,15°C, 0 K), значение энтропии приближается к минимуму».
Значение энтропии обычно равно 0 при 0K, однако в некоторых случаях в системе все еще остается небольшое количество остаточной энтропии.
Когда вы что-то нагреваете, в зависимости от того, из чего оно сделано, для нагрева требуется разное количество времени. Предполагая, что мощность, количество энергии, передаваемой в единицу времени, остается постоянной, это должно означать, что некоторым материалам требуется больше энергии для повышения их температуры на 1 К (на самом деле 1 К — это то же самое, что и 1°С, просто они начинаются в другом месте). , Для получения дополнительной информации нажмите здесь), чем другие. Если подумать, в этом есть смысл. Деревянная ложка нагревается намного дольше, чем металлическая. Мы говорим, что металл — хороший проводник тепла, а дерево — плохой проводник тепла. Энергия, необходимая для поднятия 1 кг вещества на 1 К, называется его удельной теплоемкостью. Формула, которую мы используем, чтобы найти, сколько энергии требуется, чтобы поднять 1 кг вещества на 1 К:
где = энергия, = масса, = удельная теплоемкость и = изменение температуры.
1а. Лора готовит завтрак перед работой воскресным утром (пожалуйста, присылайте сообщения с сочувствием, что мне пришлось работать здесь в воскресенье). Она не хочет больше мыть посуду, что абсолютно необходимо, поэтому решает размешать спагетти, которые готовит, вилкой, вместо того, чтобы мыть деревянную ложку. Она оставляет вилку на сковороде, пока намазывает тосты маргарином и натирает сыр. Плита отдает 1000 Дж энергии вилке за то время, пока она оставляет ее без присмотра. Каково будет повышение температуры вилки, если предположить, что половина выделенной энергии будет потеряна в окружающую среду, а начальная температура вилки была 20°C, а масса вилки 50 г и она изготовлена из материала с определенной теплоемкость 460 Джкг-1К-1
Хотя я почти уверен, что где-то читал, что попытка определить изменения энергии в вилках первым делом с утра была признаком безумия, я ловлю себя на том, что время от времени делаю это. Для этого вопроса нам понадобится уравнение Q=mcΔT. Это уравнение вам, вероятно, понадобится очень часто, так что стоит попытаться его запомнить. Он также возникает в химии тоже. Перво-наперво, нам нужно изменить уравнение, чтобы сделать ΔT субъектом. Как только вы переставите этот вопрос, вы должны получить ΔT=Q/(mc). Подставив значения, данные нам в вопросе, вы получите:
Это уравнение вам, вероятно, понадобится очень часто, так что стоит попытаться его запомнить. Он также возникает в химии тоже. Перво-наперво, нам нужно изменить уравнение, чтобы сделать ΔT субъектом. Как только вы переставите этот вопрос, вы должны получить ΔT=Q/(mc). Подставив значения, данные нам в вопросе, вы получите:
ΔT= 1000/(50 x 10-3 x 460)
ΔT= 43K
Таким образом, поскольку начальная температура вилки была 20°C, конечная температура вилки будет 63°C.
- Внутренняя энергия:
- Свободная энергия Гельмгольца:
- Энтальпия:
- Свободная энергия Гиббса:
Соотношения Максвелла
(4)
(5)
(6)
(7)
15.1: Первый закон термодинамики
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1594
- OpenStax
- OpenStax
Цели обучения
К концу этого раздела вы сможете:
- Дать определение первому закону термодинамики.

- Опишите, как сохранение энергии связано с первым законом термодинамики.
- Определить случаи применения первого закона термодинамики в повседневных ситуациях, включая биологический метаболизм.
- Рассчитайте изменения внутренней энергии системы после учета теплопередачи и выполненной работы.
Если нас интересует, как теплопередача преобразуется в работу, то важен принцип сохранения энергии. первый закон термодинамики применяет принцип сохранения энергии к системам, в которых передача тепла и выполнение работы являются методами передачи энергии в систему и из нее.
Рисунок \(\PageIndex{1}\): Этот кипящий чайник представляет энергию в движении. Вода в чайнике превращается в водяной пар, потому что тепло передается от плиты к чайнику. По мере того, как вся система нагревается, совершается работа — от испарения воды до свиста чайника. (кредит: Джина Гамильтон) Первый закон термодинамики гласит, что изменение внутренней энергии системы равно чистому переносу тепла в системы за вычетом чистой работы, выполненной системой. В форме уравнения первый закон термодинамики равен
В форме уравнения первый закон термодинамики равен
\[\Delta U = Q — W. \label{first}\]
Здесь \(\Delta U\) есть изменение внутренней энергии \(U\) системы. \(Q\) — это чистого тепла, переданного в систему — то есть \(Q\) представляет собой сумму всего теплопереноса в систему и из нее. \(W\) есть чистая работа, проделанная системой , то есть \(W\) есть сумма всей работы, проделанной системой или над ней. Мы используем следующие соглашения о знаках: если \(Q\) положительна, то в систему имеет место чистый теплообмен; если \(W\) положительно, то система совершает чистую работу. Таким образом, положительный \(Q\) добавляет энергию системе, а положительный \(W\) забирает энергию у системы. Таким образом, \(\Delta U = Q — W\). Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу (рис.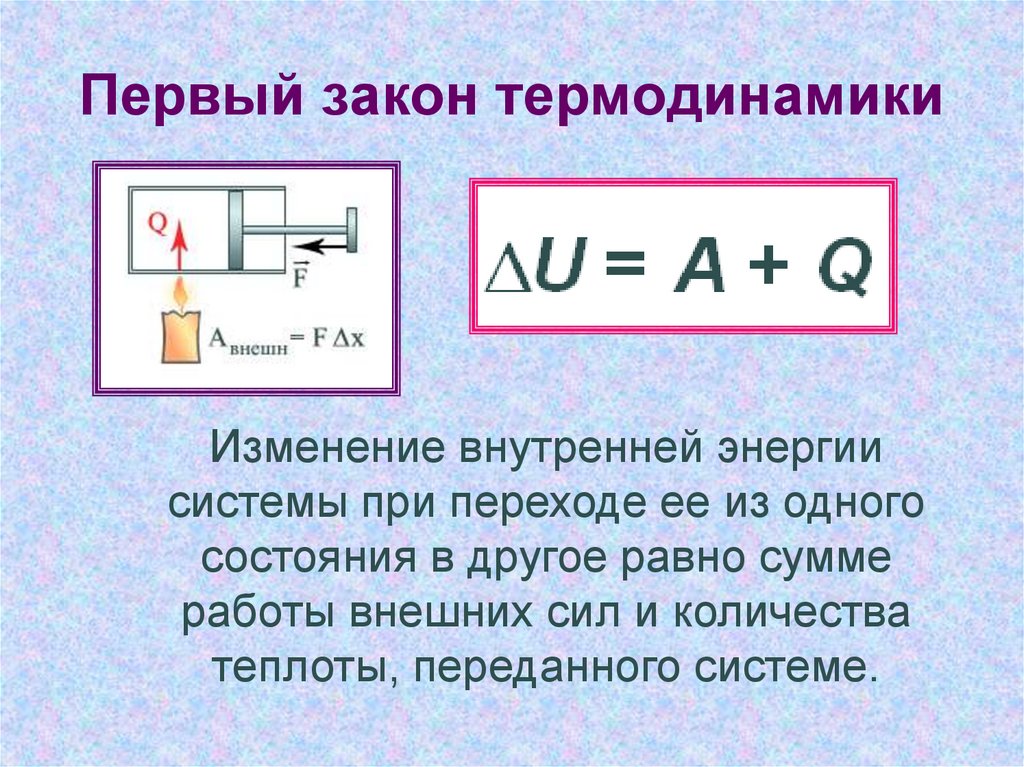 \(\PageIndex{2}\)). Теперь мы рассмотрим \(Q, \, W\) и \(\Delta U\) дальше.
\(\PageIndex{2}\)). Теперь мы рассмотрим \(Q, \, W\) и \(\Delta U\) дальше.
ЗАКОН ТЕРМОДИНАМИКИ И ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
Первый закон термодинамики на самом деле является законом сохранения энергии, сформулированным в форме, наиболее полезной в термодинамике. Первый закон устанавливает связь между теплопередачей, выполненной работой и изменением внутренней энергии системы.
Теплота
Q и Работа Вт Теплопередача \(Q\) и выполнение работы \(Вт\) — это два повседневных способа подачи энергии в систему или отвода энергии из нее. Процессы совсем другие. Теплопередача, менее организованный процесс, обусловлена разницей температур. Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Внутренняя энергия
U Мы можем думать о внутренней энергии системы двумя разными, но непротиворечивыми способами. Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия \(U\) системы есть сумма кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Макроскопически мы определяем изменение внутренней энергии \(\Delta U\) как соответствующее первому закону термодинамики (уравнение \ref{first}): \[\Delta U = Q — W \nonumber\]
Многие детальные эксперименты подтвердили, что \(\Delta U = Q — W\), где \(\Delta U\) — изменение полной кинетической и потенциальной энергии всех атомов и молекул в системе. Экспериментально установлено также, что внутренняя энергия \(U\) системы зависит только от состояния системы и не как дошло до этого состояния . В частности, установлено, что \(U\) является функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем вычислить изменения ее внутренней энергии \(U\) по нескольким макроскопическим переменным.
МАКРОСКОПИЧЕСКОЕ и МИКРОСКОПИЧЕСКОЕ
В термодинамике мы часто используем макроскопическую картину при расчетах поведения системы, в то время как атомарная и молекулярная картина дает основные объяснения в терминах средних значений и распределений.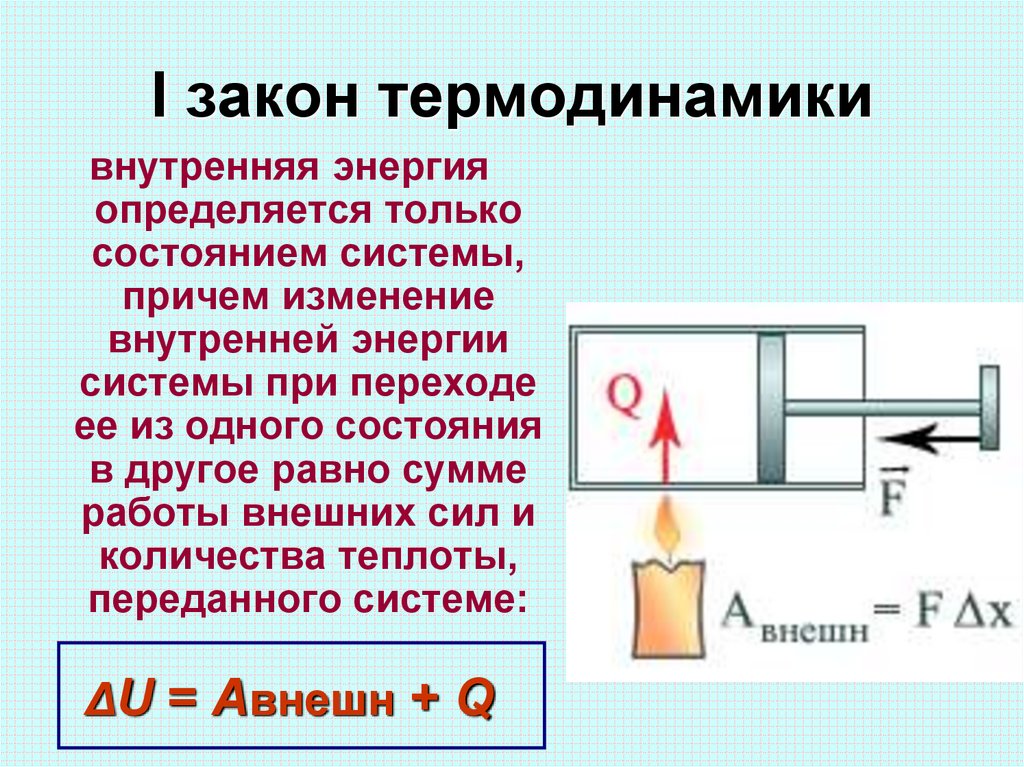 Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Чтобы получить лучшее представление о внутренней энергии системы, давайте рассмотрим систему, переходящую из состояния 1 в состояние 2. Система имеет внутреннюю энергию \(U_1\) в состоянии 1, и у нее есть внутренняя энергия энергия \(U_2\) в состоянии 2, независимо от того, как она попала в любое состояние. Таким образом, изменение внутренней энергии
\[\Delta U = U_2 — U_1\]
не зависит от того, что вызвало это изменение. Другими словами, \(\delta U\) не зависит от пути . Под путем мы подразумеваем способ добраться из начальной точки в конечную. Почему важна эта независимость? И \(Q\), и \(W\) зависит от пути , но \(\Delta U\) не зависит (уравнение \ref{first}). Эта независимость от пути означает, что внутреннюю энергию \(U\) легче учитывать, чем теплопередачу или выполненную работу.
Пример \(\PageIndex{1}\): расчет изменения внутренней энергии — одно и то же изменение \(U\) вызывается двумя различными процессами
- система совершает работу 10,00 Дж. Затем из системы передается 25,00 Дж тепла, а над системой совершается работа 4,00 Дж. Каково чистое изменение внутренней энергии системы?
- Как изменится внутренняя энергия системы, если из системы будет передано 150,00 Дж теплоты и над системой будет совершено 159,00 Дж работы (рис. \(\PageIndex{3}\)) ?

Стратегия
В части (a) мы должны сначала найти чистую теплопередачу и чистую работу, выполненную на основе данной информации. Затем первый закон термодинамики (уравнение \ref{first}).
можно использовать для определения изменения внутренней энергии. В части (b) даны чистая теплопередача и проделанная работа, поэтому уравнение можно использовать напрямую.
Решение для (a)
Чистая теплопередача – это теплопередача в систему за вычетом теплопередачи из системы, или
\[ \begin{align*} Q &= 40.00 \, J — 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
Аналогично, общая работа равна работе, выполненной системой, за вычетом работы, выполненной системой, или
\[ \begin{align*} W &= 10.00 \, J — 4.00 \, J \\[5pt] &= 6.00 \, J. \end{align*}\]
Обсуждение (a)
Независимо от того, смотрите ли вы на процесс в целом или разбиваете его на этапы, изменение внутренней энергии одинаково.
Решение для (b)
Здесь чистая теплопередача и полная работа непосредственно равны \(Q = -150,00 \, Дж\) и \(W = -159,00 \, Дж\), так что
\[ \begin{align*} \Delta U &= Q — W = -150.00 — (-159.00) \\[5pt] &= 9.00 \, J. \end{align*}\]
Обсуждение на (b)
Совершенно другой процесс в части (b) дает те же 9Изменение внутренней энергии на 0,00 Дж, как в части (а). Обратите внимание, что изменение в системе в обеих частях связано с \(\Дельта U\), а не с отдельными задействованными \(Q\) или \(W\). Система оказывается в том же состоянии как в (a), так и в (b). Части (а) и (б) представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково — оно не зависит от пути.
Метаболизм человека и первый закон термодинамики
Метаболизм человека – это преобразование пищи в теплопередачу, работу и накопление жира. Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q — W\) отрицательна.
Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q — W\) отрицательна.
Теперь рассмотрим последствия еды. Прием пищи увеличивает внутреннюю энергию тела за счет добавления химической потенциальной энергии (это неромантичный взгляд на хороший стейк). Тело усваивает всю пищу, которую мы потребляем. По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
В химии и биохимии одна калория ( в нижнем регистре пишется как с) определяется как энергия (или теплопередача), необходимая для повышения температуры одного грамма чистой воды на один градус Цельсия. Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями (пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограмма воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Снова рассмотрим внутреннюю энергию, потерянную телом.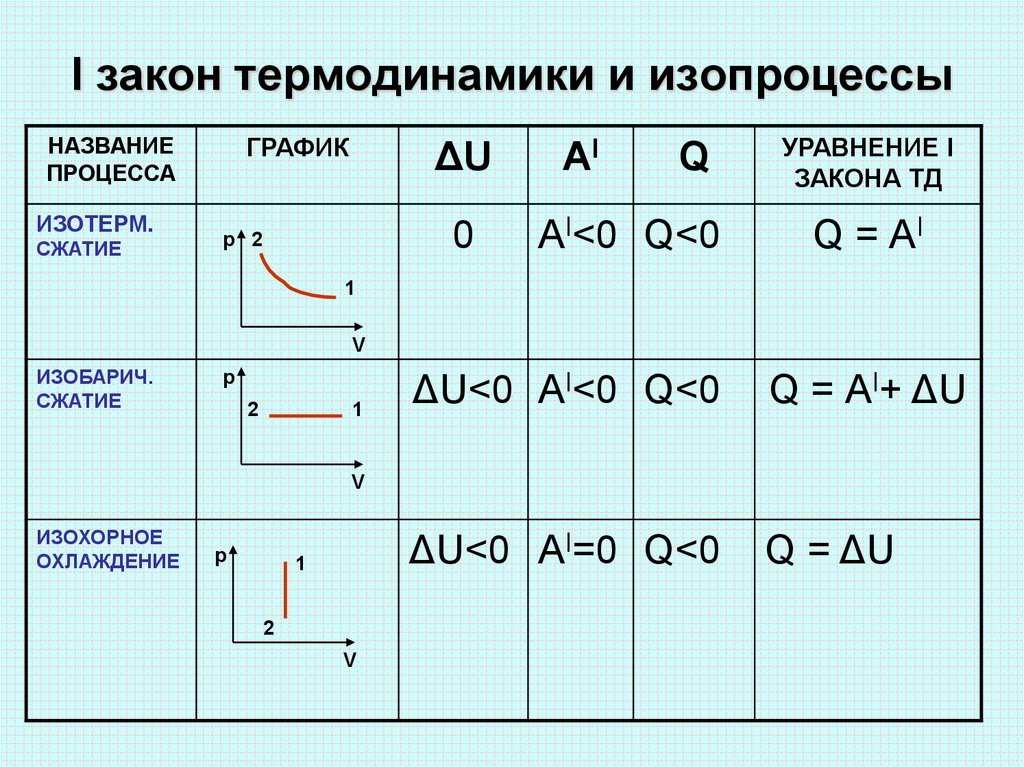 Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе \(\Delta U = 0\). Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе \(\Delta U = 0\). Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Жизнь не всегда так проста, как знает любой сидящий на диете. Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа.
Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело дает нам отличный показатель того, что многие термодинамические процессы являются необратимыми . Необратимый процесс может идти в одном направлении, но не в обратном, при заданном наборе условий. Например, хотя жировые отложения могут быть преобразованы для выполнения работы и передачи тепла, работа, совершаемая над телом, и перенос тепла в него не могут быть преобразованы в жировые отложения. В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рисунке \(\PageIndex{4}\). Одним из больших преимуществ законов сохранения, таких как первый закон термодинамики, является то, что они точно описывают начальную и конечную точки сложных процессов, таких как метаболизм и фотосинтез, без учета промежуточных осложнений.
Резюме
В таблице представлены термины, относящиеся к первому закону термодинамики.
| Срок | Определение |
|---|---|
| \(У\) | Внутренняя энергия — сумма кинетической и потенциальной энергий атомов и молекул системы. Можно разделить на множество подкатегорий, таких как тепловая и химическая энергия. Зависит только от состояния системы (например, от ее \(P\), \(V\) и \(T\), а не от того, как энергия поступила в систему. Изменение внутренней энергии не зависит от пути9.0355 Изменение внутренней энергии не зависит от пути9.0355 |
| \(Q\) | Тепло — энергия, передаваемая из-за разницы температур. Характеризуется беспорядочным движением молекул. Сильно зависит от пути. Вход \(Q\) в систему положителен. |
| \(Вт\) | Работа — энергия, переданная силой, движущейся на расстояние. Организованный, упорядоченный процесс. Зависит от пути. \(W\), совершаемая системой (либо против внешней силы, либо для увеличения объема системы), положительна. |
- Первый закон термодинамики записывается как \(\Delta U = Q — W\), где \(\Delta U\) — изменение внутренней энергии системы, \(Q\) — чистая теплопередача (сумма всей теплопередачи в систему и из системы), а \(W\) — чистая выполненная работа (сумма всей работы, выполненной системой или системой).
- И \(Q\), и \(W\) представляют собой транзитную энергию; только \(\Delta U\) представляет собой независимую величину, которую можно сохранить.
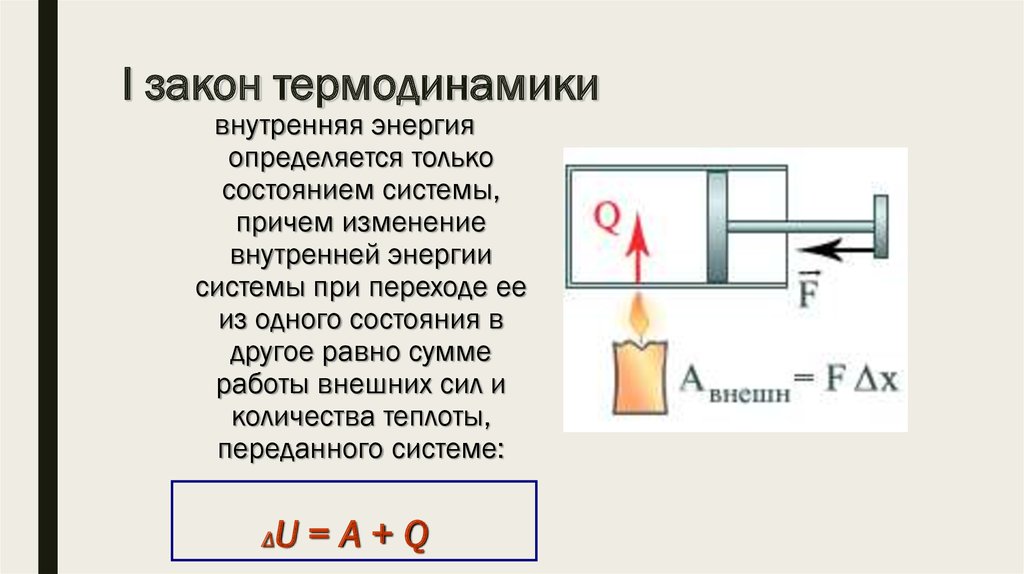
- Внутренняя энергия \(U\) системы зависит только от состояния системы, а не от того, как она достигла этого состояния.
- Обмен веществ живых организмов и фотосинтез растений являются специализированными видами теплообмена, совершения работы и внутренней энергии систем.
Глоссарий
- первый закон термодинамики
- утверждает, что изменение внутренней энергии системы равно чистому переносу тепла в система минус чистая работа, выполненная система
- внутренняя энергия
- сумма кинетической и потенциальной энергий атомов и молекул системы
- метаболизм человека
- преобразование пищи в теплопередачу, работу и накопленный жир
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Метки
- первый закон термодинамики
- метаболизм человека
- внутренняя энергия
Первый закон термодинамики: определение и пример
Законы термодинамики являются одними из самых важных законов во всей физике, и понимание того, как применять каждый из них, является важным навыком для любого студента-физика.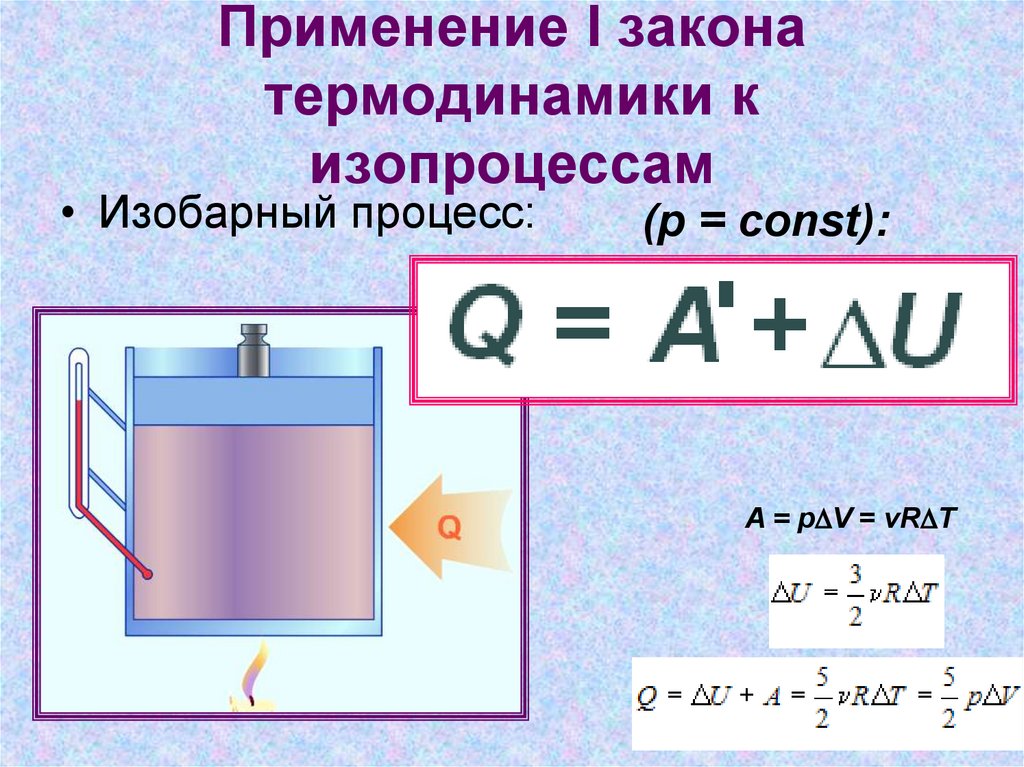
Первый закон термодинамики, по сути, представляет собой утверждение о сохранении энергии, но у этой конкретной формулировки есть множество применений, которые вам нужно понять, если вы хотите решать проблемы, связанные с такими вещами, как тепловые двигатели.
Изучение того, что такое адиабатические, изобарические, изохорные и изотермические процессы и как применять первый закон термодинамики в этих ситуациях, поможет вам математически описать поведение термодинамической системы по мере ее эволюции во времени.
Внутренняя энергия, работа и теплота
Первый закон термодинамики, как и другие законы термодинамики, требует понимания некоторых ключевых терминов. Внутренняя энергия системы является мерой полной кинетической энергии и потенциальной энергии изолированной системы молекул; интуитивно это просто количественно определяет количество энергии, содержащейся в системе.
Термодинамическая работа – это количество работы, которую система совершает над окружающей средой, например, за счет теплового расширения газа, толкающего наружу поршень. Это пример того, как тепловая энергия в термодинамическом процессе может быть преобразована в механическую энергию, и это основной принцип работы многих двигателей.
Это пример того, как тепловая энергия в термодинамическом процессе может быть преобразована в механическую энергию, и это основной принцип работы многих двигателей.
В свою очередь, тепло или тепловая энергия представляет собой термодинамический перенос энергии между двумя системами. Когда две термодинамические системы находятся в контакте (не разделены изолятором) и имеют разные температуры, то передача тепла происходит таким образом, от более горячего тела к более холодному. Все эти три величины являются формами энергии и поэтому измеряются в джоулях.
Первый закон термодинамики
Первый закон термодинамики гласит, что тепло, сообщаемое системе, увеличивает ее внутреннюю энергию, а работа, совершаемая системой, уменьшает внутреннюю энергию. В символах вы используете ∆U для обозначения изменения внутренней энергии, Q для обозначения теплопередачи и W для работы, совершаемой системой, поэтому первый закон термодинамики:
∆U = Q — W
Таким образом, первый закон термодинамики связывает внутреннюю энергию системы с двумя возможными формами передачи энергии, и поэтому его лучше всего рассматривать как формулировку закона сохранения энергии.
Любые изменения внутренней энергии системы происходят либо за счет теплопередачи, либо за счет выполненной работы с теплопередачей до система и работа на система увеличивает внутреннюю энергию, и теплопередача от система и работа на уменьшает внутреннюю энергию. Само по себе выражение простое в использовании и понятном, но поиск правильных выражений для теплопередачи и выполненной работы для использования в уравнении может быть сложным в некоторых случаях.
Пример первого закона термодинамики
Тепловые двигатели — это распространенный тип термодинамической системы, который можно использовать для понимания основ первого закона термодинамики. Тепловые двигатели, по сути, преобразуют теплопередачу в полезную работу посредством четырехэтапного процесса, который включает добавление тепла к резервуару с газом для увеличения его давления, в результате чего он увеличивается в объеме, давление снижается по мере извлечения тепла из газа и, наконец, газ сжимается (то есть уменьшается в объеме) по мере того, как над ним совершается работа, чтобы вернуть его в исходное состояние системы и начать процесс заново.
Эту же систему часто идеализируют как цикл Карно , в котором все процессы обратимы и не связаны с изменением энтропии, со стадией изотермического (т. е. при той же температуре) расширения, стадией адиабатического расширения (без теплопередачи), стадии изотермического сжатия и стадии адиабатического сжатия для возврата в исходное состояние.
Оба этих процесса (идеализированный цикл Карно и цикл тепловой машины) обычно наносятся на график PV диаграмма (также называемая графиком давление-объем), и эти две величины связаны законом идеального газа, который гласит: = объем, n = количество молей газа, R = универсальная газовая постоянная = 8,314 Дж моль −1 K −1 и T = температура. В сочетании с первым законом термодинамики этот закон можно использовать для описания стадий цикла теплового двигателя. Другое полезное выражение дает внутреннюю энергию U для идеального газа:
U = \frac{3}{2}nRT
Цикл тепловой машины
Простой подход к анализу цикла тепловой машины состоит в том, чтобы представить процесс, происходящий на прямоугольник с прямыми сторонами на графике PV , где каждая стадия происходит либо при постоянном давлении (изобарический процесс), либо при постоянном объеме (изохорный процесс).
Сначала, начиная с V 1 , добавляется тепло и повышается давление с P 1 до P 2 , а поскольку объем остается постоянным, вы знаете, что проделанная работа равна нулю. Чтобы решить эту стадию задачи, вы делаете две версии закона идеального газа для первого и второго состояния (помня, что V и n являются постоянными): P 1 V 1 = nRT 1 и P 2 V = 1 0013 nRT 2 , а затем из второго вычесть первое, чтобы получить:
V_1 (P_2-P_1) = nR (T_2 -T_1)
Решение для изменения температуры дает:
(T_2 — T_1 ) = \frac{ V_1 (P_2 — P_1)}{nR}
Если вы ищете изменение внутренней энергии, вы можете подставить его в выражение для внутренней энергии U , чтобы получить:
\begin {выровнено} ∆U &= \frac{3}{2}nR∆T \\ \\ &=\frac{3}{2} nR \bigg(\frac{ V_1 (P_2 — P_1)}{nR}\ bigg) \\ \\ &=\frac{3}{2} V_1 (P_2 -P_1) \end{align}
На втором этапе цикла объем газа увеличивается (поэтому газ работает) и в процессе добавляется больше тепла (для поддержания постоянной температуры). В этом случае работа Вт , совершаемая газом, представляет собой просто изменение объема, умноженное на давление P 2 , что дает:
В этом случае работа Вт , совершаемая газом, представляет собой просто изменение объема, умноженное на давление P 2 , что дает:
Вт = P_2 (V_2 -V_1)
И изменение температуры находится по закону идеального газа, как и прежде (за исключением сохранения P 2 как константу и помня, что объем изменяется), будет:
T_2 — T_1 = \frac{ P_2 (V_2 — V_1)}{nR}
Если вы хотите узнать точное количество добавленного тепла, вы можно использовать уравнение удельной теплоемкости при постоянном давлении, чтобы найти его. Однако вы можете напрямую рассчитать внутреннюю энергию системы в этой точке, как и раньше:
\begin{aligned} ∆U &= \frac{3}{2}nR∆T \\ \\ &=\frac{3 }{2}nR\bigg(\frac{ P_2 (V_2 – V_1)}{nR}\bigg) \\ \\ &=\frac{3}{2} P_2 (V_2 – V_1) \end{align}
Третья стадия, по существу, обратна первой стадии, поэтому давление уменьшается при постоянном объеме (на этот раз V 2 ) и из газа извлекается тепло. Вы можете выполнить тот же процесс на основе закона идеального газа и уравнения для внутренней энергии системы, чтобы получить:
Вы можете выполнить тот же процесс на основе закона идеального газа и уравнения для внутренней энергии системы, чтобы получить:
∆U = -\frac{3}{2} V_2 (P_2 — P_1)
Обратите внимание на на этот раз со знаком минус, потому что температура (и, следовательно, энергия) уменьшилась.
Наконец, на последнем этапе объем уменьшается по мере выполнения работы над газом и теплом, извлеченным в изобарическом процессе, что дает выражение, очень похожее на прошлый раз для работы, за исключением ведущего знака минус:
Вт = -P_1 (V_2 -V_1)
Тот же расчет дает изменение внутренней энергии как:
∆U = -\frac{3}{2} P_1 (V_2 — V_1)
Другие законы термодинамики
Первый Закон термодинамики, пожалуй, наиболее практичен для физика, но другие три основных закона также заслуживают краткого упоминания (хотя они более подробно рассматриваются в других статьях). Нулевой закон термодинамики гласит, что если система A находится в тепловом равновесии с системой B, а система B находится в равновесии с системой C, то система A находится в равновесии с системой C.