Перемешивается ли электролит в аккумуляторе при движении автомобиля? / Хабр
Привет, Хабр! Серная кислота почти вдвое тяжелее воды, и её водные растворы, в том числе аккумуляторный электролит, склонны к расслоению: тяжёлая кислота вытесняет лёгкую воду вверх и опускается вниз. Как это влияет на работу аккумуляторной батареи, и насколько эффективно перемешивает электролит тряска при движении транспортного средства? Проведём эксперимент с видео и показаниями приборов.
▍Перед началом опыта, вспомним известные факты о расслоении электролита:
❒ Основная токообразующая реакция в свинцовом аккумуляторе, — двойная сульфатация по Гладстону-Трайбу, — требует для заряда воды, которая расходуется из электролита с выделением кислоты, а при разряде наоборот, расходуется кислота и выделяется вода.
❒ Обязательными условиями заряда участка активной массы являются наличие в этом участке воды, а также электрический потенциал не ниже необходимого для преодоления термодинамической электродвижущей силы — ЭДС — на этом участке.
❒ Следовательно, повышенная концентрация электролита в нижней части банок и глубине намазок пластин АКБ — аккумуляторной батареи — ведёт к тому, что для преодоления термодинамической ЭДС требуется более высокое напряжение на клеммах. При недостаточном напряжении заряд участка активной массы (АМ) с повышенной концентрацией кислоты не произойдёт никогда. Также препятствует заряду и недостаток воды в данном участке АМ.
❒ И заряд, и разряд активных масс ведут к расслоению электролита, так как выделяющаяся при заряде кислота стремится вниз, а образующаяся при разряде вода — вверх. Таким образом, если не предпринять специальных мер, при любой глубине циклирования или просто саморазряде АКБ расслоение электролита прогрессирует.
❒ Современные типы АКБ характеризуются плотными сепараторами, препятствующими оплыванию активных масс и короткому замыканию. Они повышают надёжность, виброустойчивость и срок службы АКБ, но и препятствуют перемешиванию электролита, усугубляя тенденцию к расслоению.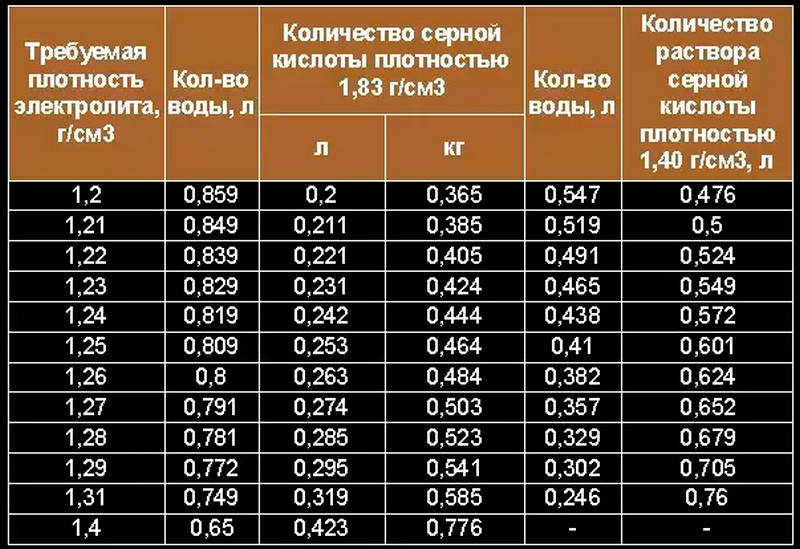
❒ Чем более прогрессирует расслоение электролита, тем большая доля активных масс при штатном зарядном напряжении не заряжается, то есть, остаётся в виде сульфата свинца, склонного переходить в труднорастворимую форму. Это явление называется сульфатацией. Не следует путать с двойной сульфатацией п. 1 — нормальной токообразующей реакцией. Сульфаты имеют меньшую плотность, чем заряженные АМ — губчатый свинец отрицательных пластин и оксид свинца положительных, потому сульфатированные намазки увеличиваются в объеме, что ведёт к разрушению конструкции аккумулятора и коротким замыканиям. П. 5 этому препятствует, но при отсутствии периодического выравнивающего заряда АКБ с расслоением и сульфатацией теряет ёмкость, токоотдачу и концентрацию кислоты в верхних слоях электролита.
❒ Электролит с низкой концентрацией кислоты замерзает при более высокой («менее минусовой») температуре, потому расслоение электролита ведёт к выходу аккумулятора из строя в зимнее время.
По просторам Всемирной Паутины с давних времён гуляет множество мифов
о губительности «кипячения», — заряда с перенапряжением и выделением водорода и кислорода, пузырьки которых перемешивают электролит, для автомобильных АКБ. Многие руководствуются этими мифами при заряде АКБ и выборе для этого зарядных устройств — ЗУ.
Многие руководствуются этими мифами при заряде АКБ и выборе для этого зарядных устройств — ЗУ.
Отчасти поэтому, во многих моделях ЗУ производители ограничивают напряжение на уровне, не допускающем «кипения» электролита, в других моделях предоставляют пользователю выбор максимальных напряжений заряда путём ступенчатого переключения или плавной регулировки, даже если ЗУ представляет собой не просто источник питания со стабилизацией тока и напряжения (СС/CV), а имеет алгоритмы автоматического управления напряжением и током согласно табличным значениям профиля или на основании измерения характеристик АКБ.
Водород, аэрозоль серной кислоты и сероводород, могущие выделяться при заряде аккумулятора, действительно опасны, потому заряжать следует в проветриваемом помещении, адекватно управлять током, напряжением и временем заряда, изучить и соблюдать технику безопасности.
В сегодняшнем эксперименте посмотрим, насколько перемешают электролит пара современных отечественных ЗУ, и насколько это требуется от ЗУ вообще, применительно к стартерной аккумуляторной батарее. Ведь она монтируется на автомобиле (мотоцикле, снегоходе, катере…), а тот испытывает ускорения и вибрации при движении. Некоторые авторы считают, что поездки перемешают электролит, потому в функции зарядного устройства это не входит. Давайте попробуем, и узнаем.
Ведь она монтируется на автомобиле (мотоцикле, снегоходе, катере…), а тот испытывает ускорения и вибрации при движении. Некоторые авторы считают, что поездки перемешают электролит, потому в функции зарядного устройства это не входит. Давайте попробуем, и узнаем.
Подопытным будет аккумулятор
АКОМ +EFB 6СТ-60VL. Со времени предыдущего стационарного обслуживания он использовался на автомобиле 4 месяца. График работы владельца автомобиля — сутки через трое, каждая поездка занимала 20 минут. Стартер и сигнализация за трое суток простоя в каждом таком цикле расходовали примерно 3 ампер*часа.
Начнём с измерения параметров текущего состояния. И как всегда, в первую очередь вымоем корпус и зачистим клеммы.
Напряжение разомкнутой цепи — НРЦ, оно же ЭДС без нагрузки, по показаниям трёх приборов 12.48, 12.50, 12.52 В.
Плотность электролита по банкам колеблется от 1.22 до 1.23. В крайних банках плотность ниже, в средних выше. Это тенденция, обычная для свинцовых батарей.
Итак, наблюдаем расхождение:
НРЦ соответствует уровню заряженности выше 80%, плотность электролита при котором должна быть 1.24, а по плотности уровень заряженности получается 75%, НРЦ должно быть 12.4 В. Причиной такого несоответствия как раз является расслоение электролита за 4 месяца эксплуатации под капотом. Повышенная концентрация кислоты в нижней части банок создаёт завышенное НРЦ. АКБ в таком состоянии необходим стационарный заряд.
Напряжение под нагрузочной вилкой не падает ниже 10 вольт, аккумулятор способен крутить стартер. Но если почитать инструкцию от производителя, то там чётко и ясно написано: если плотность ниже 1.25, аккумулятор требуется зарядить до плотности 1.28. Также в инструкции сказано, что можно оценить степень заряда по напряжению, и рекомендуется производить стационарный заряд при НРЦ ниже 12.5, но если имеется доступ к электролиту, то лучше проверить его плотность.
Приступаем к заряду зарядным устройством BL1204 на программе 2.
Заряд длился 9 часов. Плотность по банкам составила от 1.23 до 1.24.
По графику напряжения на клеммах, видно, что ЗУ производит основной заряд с подачами и паузами разной продолжительности, а затем три этапа непрерывного дозаряда, после чего последовали тест АКБ и буферный режим 13.65 В. Однако для кальциевой АКБ до 14.8 вольт происходит лишь основной заряд, потому продолжим заряд на программе 4.
Время заряда составило 1 час 16 минут плюс 20 часов в режиме буферного хранения. Плотность поднялась ещё на одну сотую и составила от 1.24 до 1.25. Сделаем ещё один проход на 4-й программе.
Время заряда снова 1 час 16 минут. Плотность поднялась всего на 0.005. Перезапустим программу 4 в третий раз.
Третий проход длился те же 1 час 16 минут. Плотность снова поднялась на 0.005. Отключаем ЗУ от АКБ. После отстоя продолжительностью 18 часов 20 минут НРЦ 13.20 В. При плотности 1.25 это говорит об очень сильном расслоении электролита. Запустим программу 4 ещё раз.
Заряд длился на этот раз около 50 минут. Плотность электролита не поднялась. Попробуем воспользоваться другим ЗУ.
Возьмём Бережок-V, установим 15.9 В — то же максимальное напряжение, что у BL1204.
Ток изменяется от -0.2 до 4.5 ампер. Отрицательное значение тока — не ошибка токовых клещей, а разрядные импульсы в асимметричном (реверсивном) заряде.
Заряд длился 4 часа, за которые ЗУ сделало две длительные паузы, и затем перешло в режим хранения — не поддержание буферного напряжения, как BL1204, а периодический подзаряд.
В пиках напряжение достигает тех же 15.9.
Плотность в 5 банках составила 1.26 или чуть выше, и в одной 1.255. Оставим АКБ на ночь дозаряжаться в режиме хранения.
По прошествии 15 часов, импульсы тока доходят до 5 А, снижаясь менее чем за секунду до 1 А.
Для отбора проб электролита из глубины банок воспользуемся удлинённой пипеткой, гибкий наконечник которой может пройти сбоку от пластин. Короткой пипеткой произведём отбор, как обычно, из верхнего слоя.
Плотность верхнего слоя составила 1.26, нижнего почти 1.31. Это весьма значительное расслоение, обуславливающее высокое напряжение разомкнутой цепи при недозаряженных и сульфатирующихся нижних частях пластин. Ни одно из применённых ЗУ при заряде нашего аккумулятора до 15.9В с расслоением не справилось.
Устранят ли поездки такое расслоение?
Для непосредственной проверки установим АКБ под капот, для чего пришлось удлинить провод массы.
Для лучшего перемешивания прибавим напряжение бортовой сети с 14.3 до 14.8 В, так как это позволяет сделать трёхуровневый регулятор напряжения.
Приборная панель Gamma GF-618 позволяет регистрировать данные поездок, что тоже очень пригодится в нашем эксперименте.
Пробег за трое суток в городском режиме составил 143.7 километра. Большое количество разгонов и торможений должно способствовать перемешиванию электролита.
Израсходовано 12.8 литров бензина.
После таких поездок плотность на глубине составила 1. 29.
29.
Плотность сверху 1.27. Предписываемого инструкцией значения 1.28 так и не достигли. Расслоение до сих пор присутствует. Покатаемся ещё трое суток, на этот раз, не только по городу, но и по трассе.
Итого за 6 суток автомобиль двигался восемь с половиной часов.
Общий пробег за это время 377.8 км.
Бензина затрачено 28.8 литра.
Плотность электролита наверху и внизу, наконец, уравнялась, и составила чуть ниже 1.27.
Итак, чтобы устранить расслоение в Ca/Ca EFB аккумуляторе после нескольких перезапусков стационарного заряда до 15.9 вольт, понадобилось почти 378 километров пробега и 29 литров бензина при напряжении бортсети 14.8 В. Сделаем выводы:
Q: Перемешивается ли электролит в современном кальциевом аккумуляторе с высокой плотностью сепараторов и упаковки пластин при движении транспортного средства?
—
Да, действительно перемешивается.
Q: Насколько такое перемешивание эффективно?
— Мягко говоря,
не очень.
При более низком напряжении бортовой сети и более коротких поездках расслоение электролита продолжило бы прогрессировать
Q: Остались ли после всех стараний в испытуемом аккумуляторе недозаряд и сульфатация?
—
Да, остались.Чтобы считать данную АКБ заряженной, мы должны получить плотность верхних слоёв не менее 1.28.
Q: Проявляют ли EFB аккумуляторы, вместе со склонностью к расслоению электролита, заявленную стойкость к длительному недозаряду (PSoC, partial state of charge, состояние частичной заряженности) и циклированию с глубокими разрядами?
—
Да,как показывают другие наши исследования, которые продолжаются, уже выложено несколько видео, и готовятся следующие видео и статьи.
Q: Тем не менее, будут ли ёмкость, токоотдача и устойчивость к замерзанию электролита деградировать если не предпринимать периодических регламентных процедур по полному стационарному заряду?
—
Будут,у любого свинцово-кислотного аккумулятора, потому что препятствует замерзанию концентрация кислоты в растворе, полезная ёмкость обеспечивается количеством заряженных (десульфатированных) активных масс, а способность отдавать ток полезной нагрузке и оперативно восполнять затраченную энергию от генератора автомобиля или иного зарядного устройства — действующей площадью активных масс. На ёмкость и токоотдачу влияет доступность воды для заряда и кислоты для разряда, т.е. расслоение электролита напрямую вредит этим ключевым для химического источника тока параметрам.
На ёмкость и токоотдачу влияет доступность воды для заряда и кислоты для разряда, т.е. расслоение электролита напрямую вредит этим ключевым для химического источника тока параметрам.
Теперь давайте всё-таки продолжим заряд данной аккумуляторной батареи. На этот раз начнёт Бережок-V, при том же напряжении окончания заряда 15.9 В.
Заряд продолжался около 4 часов, плюс 4 часа в хранении.
Плотность поднялась с чуть ниже 1.27 до 1.275. Передаём эстафетную палочку BL1204.
Заряд длился около часа, и далее 14 часов в режиме хранения.
Плотность осталась 1.275.
Установим на Бережке-V ограничение напряжения 16.7 вольт и запустим заряд.
По прошествии 4 часов ЗУ автоматически перешло в режим хранения. Плотность и над пластинами, и на глубине чуть выше 1.28. Электролит перемешан, расслоение устранено.
Адекватный стационарный заряд не только перемешивает электролит эффективнее, чем ускорения и вибрации при движении транспортного средства, но и позволяет более полно зарядить аккумуляторную батарею, устранить сульфатацию, поднять эксплуатационные характеристики.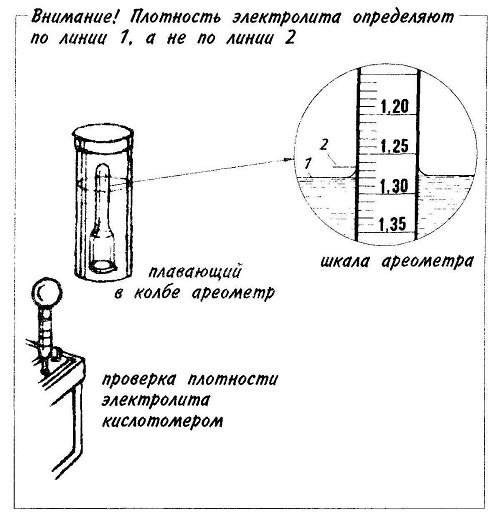
Спустя сутки, имеем следующие показания тестера:
Здоровье
100%, внутреннее сопротивление
4.81 мОм, ток холодной прокрутки
574 из 560 Апо стандарту EN. НРЦ 12.80 В соответствует плотности
1.28. Расслоения нет, АКБ в
полном порядке, можно ставить под капот.
Статья составлена в сотрудничестве с аккумуляторщиком Виктором VECTOR, осуществившим описанные опыты.
Как проверить плотность электролита аккумулятора?
При эксплуатации автомобиля его владелец неизменно сталкивается с необходимостью обслуживания и замены аккумулятора. На такую батарею приходится повышенная нагрузка, поэтому со временем аккумулятор начинает хуже держать заряд, требуя соответствующей замены. На эффективность работы такого автомобильного аккумулятора напрямую оказывает влияние показатель плотности электролита. Необходимо на регулярной основе проверять показатели плотности у электролита, что и позволит гарантировать беспроблемный пуск двигателя, а сам аккумулятор прослужит максимально долго, не доставляя каких-либо хлопот. В этой статье мы расскажем вам как проверить плотность аккумулятора.
В этой статье мы расскажем вам как проверить плотность аккумулятора.
Устройство аккумулятора
Перед тем как рассказывать непосредственно о том, как проверить плотность электролита в аккумуляторе, поговорим об устройстве стандартных автомобильных батарей. Такая АКБ состоит из:
Корпуса, состоящего из шести банок.
Плюсовых и минусовых свинцовых пластин, расположенных внутри каждой банки.
Плюсовой и минусовой шины, которые соединяют каждый герметичный отсек.
Последовательного соединения, что позволяет получать на выходе необходимую мощность заряда.
Своей способностью отдавать и накапливать электрический заряд аккумулятор обязан именно электрохимическим показателям электролита. Такой электролит залит в каждую из герметичных банок и имеет определенные показатели плотности. В процессе эксплуатации машины показатель плотности может изменяться, поэтому автовладельцу необходимо знать, как проверить плотность аккумулятора в домашних условиях и при необходимости увеличить или уменьшить этот показатель.
Как правильно обслуживать аккумулятор
Беспроблемность эксплуатации такой АКБ автомобиля зависит от своевременности и правильности обслуживания батареи. Такие работы включают:
Визуальный осмотр.
Анализ уровня электролита.
Проверка плотности батареи.
Измерение уровня напряжения.
Проверка аккумулятора нагрузочной вилкой.
Такую проверку аккумулятора необходимо выполнять дважды в год — весной и осенью. Это и позволит обеспечить качественную работу батареи как летом, так и в мороз зимой. Обслуживание и правильный уход за аккумулятором не представляет особой сложности. Если плотность электролита выше нормы, необходимо доливать дистиллированную воду. Если же отмечается низкая плотность, то следует просто зарядить аккумулятор.
Принцип работы аккумулятора
Батарея в автомобиле работает циклично, то есть сначала аккумулятор накапливает заряд, после чего отдаёт его, когда требуется завести двигатель. Во время таких циклов внутри АКБ происходит химическая реакция, когда из серной кислоты выпадают различные соли, которые оседают на пластинах из свинца, а в банках из электролита выделяется вода. Со временем концентрация и плотность электролита изменяется, что приводит к неправильной работе АКБ. Периодический замер плотности, позволит избежать разряжения батареи, которая будет служить максимально надолго. Поговорим поподробнее о том, как проверить плотность аккумулятора ареометром.
Со временем концентрация и плотность электролита изменяется, что приводит к неправильной работе АКБ. Периодический замер плотности, позволит избежать разряжения батареи, которая будет служить максимально надолго. Поговорим поподробнее о том, как проверить плотность аккумулятора ареометром.
Внимание. Если показатель плотности оказался ниже нормы, то доливать в аккумулятор электролит не следует. Необходимо провести подзарядку батареи, что и позволит обеспечить необходимый показатель плотности.
Как и зачем измеряют плотность электролита?
Многие автовладельцы попросту не знает для чего следует измерять плотность электролита в аккумуляторе. Как известно, электролит состоит на 35% из серной кислоты и на 65% из дистиллята. Такое соотношение позволяет с легкостью накапливать заряд, при этом не причиняется какой-либо вред свинцовым пластинам. В процессе эксплуатации показатели плотности электролита могут изменяться, что объясняется испарением дистиллированной воды и химическими реакциями при работе АКБ. В результате повышается содержание серной кислоты, что в свою очередь ухудшает заряд и может нанести вред свинцовым пластинам, вплоть до полного прихода в негодность аккумулятора.
В результате повышается содержание серной кислоты, что в свою очередь ухудшает заряд и может нанести вред свинцовым пластинам, вплоть до полного прихода в негодность аккумулятора.
Что плохого в высокой и низкой плотности?
Низкая плотность приводит к разряду батареи, что не позволяет использовать автомобиль. Высокая плотность, то есть повышенное содержание серной кислоты, разъедает пластины, которые быстро приходят в негодность.
Проверяем уровень электролита
Перед тем как проверить плотность аккумулятора без ареометра необходимо установить его уровень. В том случае, если сам аккумулятор выполнен из полупрозрачного пластика, то проверка уровня электролита не представляет сложности. Если же аккумулятор выполнен из непрозрачного темного пластика, то для проверки уровня электролита потребуется специальная стеклянная трубка, имеющая диаметр около 5 миллиметров. Такая трубка опускается в банку до упора, после чего ее верхнее отверстие закрывают пальцем. Трубку аккуратно достают из аккумулятора. В ней останется электролит, который сливают в колбу и проверяют уровень. Считается, что норма жидкости в колбе составит 10-15 миллиметров. В том случае, если уровень больше или меньше необходимо его выровнять, после чего измерять плотность электролита.
В ней останется электролит, который сливают в колбу и проверяют уровень. Считается, что норма жидкости в колбе составит 10-15 миллиметров. В том случае, если уровень больше или меньше необходимо его выровнять, после чего измерять плотность электролита.
Как выполнять замер плотности электролита
Если вы задаетесь вопросом, как правильно проверить плотность аккумулятора, то можем сказать, что такая работа не представляет особой сложности. Помните лишь о том, что банки внутри батареи не соединяются между собой, поэтому следует проверять плотность в каждой из емкостей. Переворачивать аккумулятор и смешивать между собой электролит для выравнивания плотности запрещается. Крышка и пробки аккумулятора должны быть чистыми и не иметь каких-либо загрязнений. Проверку плотности выполняют исключительно на заряженной батарее, в противном случае показатели такого измерения будут некорректными.
Перед тем как проверить плотность необслуживаемого аккумулятора его необходимо снять с машины и выдержать в течение нескольких часов при комнатной температуре. Оптимальным диапазоном температуры при измерении плотности является показатель 20-30 градусов.
Оптимальным диапазоном температуры при измерении плотности является показатель 20-30 градусов.
Для измерения плотности потребуется использовать ареометр, который еще называют денсиметром. В продаже можно найти разнообразные ареометры, которые имеют схожую конструкцию, но при этом отличаются своей стоимостью. При выборе такого устройства для измерения его необходимо проверить на калибровочной жидкости, что позволит быть полностью уверенным в точности таких измерений.
Большинство ареометров имеют одинаковую конструкцию и обеспечивают необходимую точность показателей. И всё же приобретать самые дешевые китайские образцы не следует, так как их качество и точность измерений будет соответствовать стоимости.
Измерение плотности электролита при использовании ареометра не представляет сложности. Необходимо выполнить следующие:
Наконечник ареометра протирается.
Его опускают в колбу для измерения.
Грушей набирают электролит и заполняют им колбу.
Ожидают несколько минут, после чего проверяют показания.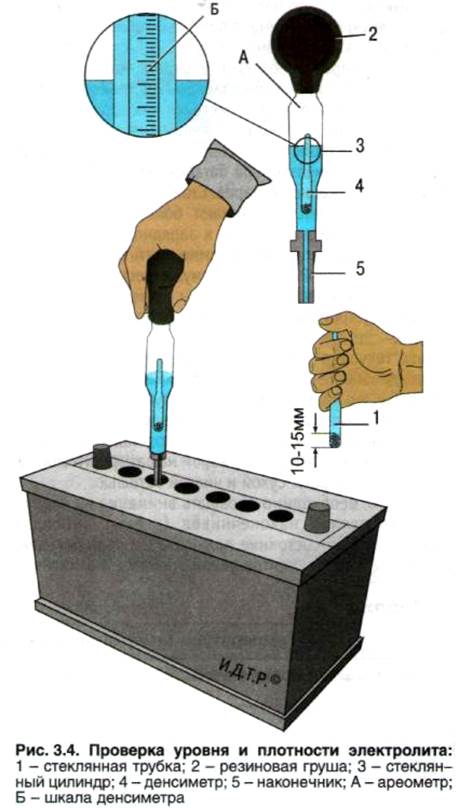
Сливают электролит обратно.
Аналогичная работа проводится с каждой из банок в аккумуляторе.
Оптимальные показатели плотности электролита
При эксплуатации аккумулятора и замере плотности электролита следует помнить о том, что показатели могут колебаться в зависимости от климата в регионе.
Для юга России оптимальный показатель плотности составляет 1,25.
Для средней полосы — 1,27.
Для севера — 1,29.
При изготовлении аккумуляторов в батарею заливают стандартный электролит, который замерзает при температурах ниже 60 градусов и имеет плотность порядка 1,26-1,27 грамм на сантиметр кубический.
Если проведённый замер показал повышенную плотность электролита, в аккумулятор необходимо долить дистиллированную воду. Приобрести такой дистиллят можно на автомобильных заправках или в специализированных магазинах. Использовать обычную воду из-под крана запрещается. Доливают дистиллят на глаз, после чего вновь проверяют плотность электролита.
Важно. Свинцовые пластины аккумулятора должны быть погружены в жидкость полностью. Исходя из этого и следует доливать дистиллят или же проводить дополнительную зарядку аккумулятора.
Изменение плотности электролита внутри аккумулятора происходит по естественным причинам. Однако если вы замечаете, что батарея быстро теряет заряд, а показатели плотности изменяются буквально спустя неделю после их выравнивания и доливки дистиллята, это свидетельствует о серьезных проблемах с аккумулятором, который в скором времени потребует замены.
Как измерить плотность в необслуживаемых аккумуляторах?
Если проверка плотности и уровня электролита в обслуживаемых батареях не вызывает сложности, то как проверить плотность электролита в необслуживаемом аккумуляторе. Такие батареи имеют в верхней крышке небольшой глазок, который можно выкрутить и через появившееся отверстие проверить плотность аккумулятора автомобиля. Помните лишь о том, что в необслуживаемых аккумуляторах можно будет провести замер плотности электролита в одной банке, поэтому вы получите усредненный показатель. Выполнить точные замеры по каждой из банок у вас не получится.
Выполнить точные замеры по каждой из банок у вас не получится.
В этой статье мы рассказали вам как правильно проверить плотность электролита в аккумуляторе. Такое обслуживание батареи автомобиля должно выполняться на регулярной основе. Поддерживая оптимальные показатели плотности и уровень электролита, вы сможете обеспечить качественный запуск двигателя автомобиля при любых температурах, а сам аккумулятор прослужит вам максимально долго. Если у вас появились какие-либо сложности с выполнением данной работы, то в сети интернет вы можете найти многочисленные тематические видео, где наглядно показывается как проверить плотность электролита в аккумуляторе ареометром.
Как самостоятельно поднять плотность электролита АКБ? — Иксора
Вне зависимости от сезона и погодных условий можно столкнуться с проблемой в работе аккумуляторной батареи автомобиля. При потере аккумулятором заряда, многие водители используют термин «плотность аккумулятора», подразумевая под ним плотность электролита, залитого в сам источник питания. Это показателя плотности электролита зависит работа самого АКБ, его возможность к подзарядке и сохранению энергии.
Это показателя плотности электролита зависит работа самого АКБ, его возможность к подзарядке и сохранению энергии.
АКБ может разрядиться по многим причинам. Чаще всего это происходит по невнимательности водителя, оставившего фары или аудиосистему работающими при выключенном зажигании.
Полностью разрядившуюся аккумуляторную батарею часто невозможно зарядить, если проблема является следствием снижения плотности залитого в устройство электролита.
Почему снижается плотность электролита?
Электролит АКБ представляет собой смесь дистиллированной воды, объем которой составляет около 65% от общего объема раствора, и серной кислоты (объем составляет около 35%). Рабочая жидкость является катализатором электрохимического процесса и заставляет работать АКБ. Электролит также обладает определенной плотностью, которая в зависимости от объема заряда батареи может повышаться или снижаться.
Многие автовладельцы для поддержания объема электролита на оптимальном уровне доливают внутрь батареи дистиллированную воду. Подобные действия приводят к изменению плотности раствора. Дело в том, что при заливе дистиллированной воды и последующей подзарядке батареи электролит выкипает, и плотность раствора снижается. Если показатель плотности падает до критического значения, автомобиль уже не получится завести. Для решения проблемы необходимо повысить плотность раствора электролита в аккумуляторной батарее.
Подобные действия приводят к изменению плотности раствора. Дело в том, что при заливе дистиллированной воды и последующей подзарядке батареи электролит выкипает, и плотность раствора снижается. Если показатель плотности падает до критического значения, автомобиль уже не получится завести. Для решения проблемы необходимо повысить плотность раствора электролита в аккумуляторной батарее.
Как повысить плотность электролита в АКБ?
Плотность раствора электролита в АКБ возможно повысить своими силами, без обращения в автосервис. Перед началом работ следует провести предварительную подготовку:
- подготовьте емкости для слива части электролита из АКБ;
- также нужны перчатки, защитные очки и одежда, которые защитят от попадания на кожу серной кислоты;
- подготовьте инструменты, которые понадобятся в работе: ареометр, клизма-груша, мерный стакан, воронка;
- дополнительно потребуются расходные материалы: дистиллированная вода, аккумуляторная кислота или уже готовый электролит.
Для того, чтобы поднять плотность электролита в АКБ, потребуется полностью заменить раствор. Для выполнения процедуры, следуйте нашим инструкциям. Обратите внимание на то, что заменить электролит возможно только в аккумуляторах разборного типа.
- Снимите АКБ с автомобиля.
- Снимите защиту аккумулятора, открутите пробки с банок.
- С помощью клизмы выкачайте старый электролит из аккумулятора через отверстие одной из банок.
- Прочистите пластины аккумулятора от остатков электролита с помощью дистиллированной воды. Для этого залейте воду в каждую банку АКБ, протрясите батарею с водой внутри и слейте раствор.
- Приступайте к заливу нового электролита. Процедура значительно проще, если вы приобрели уже готовый раствор, его достаточно залить с помощью воронки до отмеченных границ в каждую банку. Если вы покупали отдельно дистиллированную воду и аккумуляторную кислоту, необходимо предварительно подготовить раствор с плотностью 1,27-1,28 гр/см.
 куб.
куб. - Закройте банки и приступите к подзарядке батареи по циклу «зарядка-разрядка» при силе тока не более 0,1 Ампер до момента пока плотность электролита не достигнет рабочих значений. АКБ можно начинать использовать после того, как на концах клемм появится значение в 14 Вольт.
Необходимо с осторожностью подходить к процессу самостоятельной замены электролита в АКБ и соблюдать все меры предосторожности. Раствор электролита вреден не только при попадании на кожу, но и при попадании в дыхательные пути, поэтому проводите процедуру только в хорошо проветриваемых помещениях.
В магазине IXORA вы можете найти АКБ, который подходит именно вашему автомобилю. Квалифицированные менеджеры обязательно помогут сделать правильный выбор, ответят на все ваши вопросы. Обращайтесь, это выгодно и удобно.
Полезная информация:
Получить профессиональную консультацию при подборе товара можно, позвонив по телефону 8 800 555-43-85 (звонок по России бесплатный).
Почему замерзают аккумуляторы? | АКБ-сервис
Почему замерзают аккумуляторы?
Никто из автолюбителей не застрахован от того, что одним морозным утром он обнаружит тот факт, что в аккумуляторе замерз электролит. Визуально это можно определить по вздувшимся стенкам АКБ, а также по отказу работы абсолютно всех электро систем автомобиля. Так почему же замерзает аккумулятор, эксплуатирующийся сравнительно недолгое время, а подчас даже и совсем новый? Давайте разберемся с физико-химическими процессами, которые протекают внутри аккумулятора.
При разряде аккумулятора в процессе электролитической диссоциации серная кислота воздействует на свинец в пластинах и в результате этого активно образуются углекислый газ, сульфат аммония и вода. Замерзанию как раз таки подвержена вода в аккумуляторе и чем ниже будет плотность электролита, тем выше температура замерзания. Следовательно, делаем вывод, что если ваш аккумулятор замерз, то он был разряжен, либо электролит имел малую плотность по другим причинам.
Иногда такие простые, казалось бы, причины, как ослабление или окисление контактов соединения с электропроводкой, приводят к снижению эффективности зарядки от генератора из-за падения напряжения на клеммах аккумулятора, при этом сам аккумулятор абсолютно исправен, но систематически недозаряжается. Прибавьте к этому низкую температуры за бортом автомобиля и получите результат – аккумулятор не принимает заряд.
Этому явлению есть довольно простое объяснение. При низких температурах в аккумуляторах повышается вязкость электролита, скорость протекания электрохимических реакций замедляется, и в итоге снижается способность аккумулятора быстро заряжаться.
В таких случаях автомобилисты вынуждены эксплуатировать свои аккумуляторы в состоянии неполного заряда и, естественно, с более низкой ёмкостью. При каждом последующем пуске аккумулятор, как правило, недопустимо глубоко разряжается, а зарядиться быстро до требуемой ёмкости и напряжения уже не может.
Конечно, электролит замерзнуть не может, а вот когда весь ресурс аккумулятора исчерпан и вся серная кислота израсходована на процессы разрядки, то в электролите остается практически одна вода, температура которой составляет 0 С.
Еще очень часто распространено такое явление, как утечка тока в цепи — обычно это может быть магнитола, сигнализация или другое не штатное оборудование, подключенное не правильно. Даже видеорегистратор если хотите. Он буквально за сутки разрядит АКБ и тот даже при малых морозах – замерзнет! Драгоценные амперы могут также расходоваться из-за попадания влаги, или перетертой проводки- иногда причину бывает сложно найти. Или же внезапная неисправность в генераторе — вышедший из строя регулятор напряжения или диодный мост, также могут быть причиной быстрой разрядки аккумулятора, и следовательно замерзания электролита в мороз.
Ниже приведены температуры замерзания электролита в аккумуляторе при разряде:
Вода при замерзании увеличивается в объеме и выдавливает активную массу из ячеек решетки, в результате мы имеем снижение по токотдаче и сроку службы. Такой аккумулятор теряет свой ресурс и, как правило, преждевременно выходит из строя. Именно поэтому величина тока холодной прокрутки и запас ёмкости в аккумуляторе в холодное время года имеет такое большое значение для беспроблемной эксплуатации.
Что делать с замерзшим АКБ? Как правильно разморозить и зарядить замерзший аккумулятор?
Первым делом нужно убедиться в дальнейшей пригодности батареи путем осмотра корпуса на предмет трещин и разломов (очень часто лед внутри разрывает тонкие пластиковые стенки корпуса). После осмотра аккумуляторную батарею следует снять с автомобиля и поставить в теплое помещение.
Самое главное не заряжать аккумулятор пока в нем находиться лед, чтобы избежать замыкания.
Батарея должна оттаять полностью и температура электролита должна приблизиться к комнатной. После размораживания мы еще раз осматриваем нет ли течей по корпусу (вздувшиеся стенки должны принять исходный вид). Если на корпусе аккумулятора вы наблюдаете какую-то жидкость, то следует определить ее происхождения с помощью лакмусового индикатора. Если бумага приобретет красный цвет, то вы имеете дело с кислотой, которая является основной составляющей электролита и может вытечь через трещины в корпусе АКБ. Интуитивно вы должны осознавать тот факт, что кислотой можно обжечься.
Иногда случается так, что мелкие трещины на корпусе аккумулятора оставляют без внимания, принимая слегка влажные стенки за водный конденсат. В итоге после того как АКБ будет разморожен, заряжен и готов к эксплуатации, он будет медленно, но уверено течь. Есть конечно вариант запайки корпуса аккумулятора ( для этого сливаем все содержимое и берем паяльник в руки ), но вероятность положительного исхода этой операции примерно один к десяти. Потому что запаять получиться только трещину, которая размещена с боку ( не снизу или на углу) и которая распространяется лишь на одну банку.
Далее приступаем к зарядке, помня о том, что ток заряда определяем как десять процентов от номинальной емкости аккумулятора в ампер/часах. В таком случае процесс зарядки длиться около десяти часов. Но, это «кустарный метод». В идеале зарядка батареи производиться разным током, изначально нужно пробить сульфатацию на пластинах АКБ импульсным высоким током, потом постоянным пониженным дать основную зарядку и доводить батарею на прерывающемся низком току для полного восстановления пластин. Главное – мы должны зарядить батарею полностью (желательно автоматическим зарядным устройством), после этого обязательно проверяем прозрачность и плотность электролита. Мутный электролит свидетельствует о том, что пластины осыпались. Если все в порядке, то можно спокойно ставить АКБ и ездить дальше.
Как не допустить того чтобы в аккумуляторе замер электролит?
Основная задача, которая стоит перед водителем, по уходу за АКБ – это не допускать его разряда или перезаряда.
Это же касается и вопроса замерзания батареи. В большинстве случаев замерзает разряженный аккумулятор. Так же важно постоянно следить за плотностью электролита, проверку плотности производим в каждой отдельной банке. Нужно учитывать, что зимой на аккумулятор идет дополнительная нагрузка (постоянно работающая печка, утрудненный запуск двигателя в морозы, световой день меньше – включены фары и т.д.), потому чаще проверяйте уровень зарядки, выдаваемый генератором, и при необходимости вовремя заряжайте батарею. При низких температурах саморазряд аккумулятора повышается, потому не ленитесь заносить снятую АКБ в теплое помещение на ночь или как минимум отключайте массу.
Краткий вывод: замерзание батареи – это еще не ее конец. С аккумулятором нужно быть особо внимательным в зимнюю пору. Заряженная батарея с нормальной плотностью электролита – не замерзает!
Кислотная стратификация
- Категория: Поддержка по аккумуляторным батареям
- Опубликовано 29.06.2016 09:33
- Автор: Abramova Olesya
Кислотная стратификация
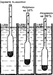
Кислота в электролите стратифицированного аккумулятора концентрируется в его нижней части, не взаимодействуя с верхними частями пластин. Кислотная стратификация развивается в ситуации, когда аккумулятор постоянно эксплуатируется при низком уровне заряда (ниже 80%), никогда полностью не заряжается и подвергается неглубоким разрядкам. К примеру, вождение автомобиля на небольшие дистанции с включенным электрооборудованием приведет к тому, что генератор не всегда сможет применять зарядку насыщения и это может стать причиной стратификации. Соответственно, автомобили представительского класса с расширенными дополнительными возможностями, которые весьма энергозатратны, более склонны к возникновению рассматриваемого явления. На рисунке 1 показан нормальный аккумулятор, в котором кислота равномерно распределена от верха к низу.
Рисунок 1: Нормальная аккумуляторная батарея. Кислота равномерно распределена от верхней части батарей к нижней, что обеспечивает хорошую общую производительность.
На рисунке 2 показан стратифицированный аккумулятор, в котором концентрация кислоты в верхней части меньше, а в нижней больше. Малая плотность электролита в верхней части ограничивает взаимодействие с активным веществом, снижает производительность и приводит к коррозии. В это же время высокая концентрация в нижней части приводит к усилению электрохимических реакций и напряжение холостого хода искусственно завышается. Такой неравномерный заряд пластин аккумулятора уменьшает пусковой ток, что чревато проблемами с запуском двигателя автомобиля.
Рисунок 2: Стратифицированная аккумуляторная батарея. Концентрация кислоты низкая в верхней части и более высокая в нижней. Это приводит к возрастанию напряжения холостого хода и аккумулятор ошибочно кажется полностью заряженным. Излишняя концентрация кислоты в нижней части аккумулятора вызывает сульфатацию погруженных в нее пластин.
При стратификации можно дать аккумулятору отстояться несколько дней, также поможет переворачивание со стороны в сторону или встряхивание для перемешивания электролита. Можно воздействовать и специальным “уравнительным” режимом зарядки, который заключается в повышении напряжения 12-вольтового аккумулятора до 16 В в течение 1-2 часов, что вызывает необходимое нам смешивание электролита, но уже путем электролиза. Следует избегать превышения рекомендованного времени такой зарядки.
Кислотной стратификации не всегда удается избежать. В холодное время года емкость стартерных автомобильных аккумуляторов, как правило, ограничена 75%, двигатель на холостом ходу или при движении на малой скорости не всегда способен обеспечить достаточную зарядку, поэтому иногда стоит использовать внешнее зарядное устройство. Если же по какой-либо причине это не практично для вас, то следует обратить внимание на технологию AGM. В аккумуляторах этой технологии кислотная стратификация просто не возникает, а сульфатация из-за недозарядки встречается гораздо реже. AGM аккумуляторы немного дороже в сравнении с обычными затопленными, но и срок их службы тоже больше.
Поверхностный зарядСвинцово-кислотные аккумуляторы являются “медленными”, под этим подразумевается скорость электрохимической реакции преобразования сульфата свинца обратно в свинец и диоксид свинца во время зарядки. Из-за небольшой скорости процесса зарядки большая часть реакций происходит на поверхностях пластин, что приводит к повышенному уровню заряда их внешней стороны.
Аккумулятор с поверхностным зарядом имеет слегка повышенное напряжение, и определение степени заряда исходя из него будет ложным. Для того чтобы нормализовать состояние, подключите к аккумулятору нагрузку и разрядите примерно на 1% емкости; также можно просто дать ему отстояться в течение нескольких часов. В случае, если это автомобильный аккумулятор, то можно просто включить фары на несколько минут. Поверхностный заряд не является дефектом батареи, это обратимое состояние.
Простые рекомендации по продлению срока службы свинцово-кислотной аккумуляторной батареи-
Используйте полную зарядку насыщения, которая длится 14-16 часов. Проводите зарядку в хорошо вентилируемом помещении.
-
Всегда храните свинцово-кислотный аккумулятор заряженным. Избегайте хранения с напряжением элементов ниже 2,07 В или удельной плотностью ниже 1,190.
-
Избегайте глубоких разрядов. Чем глубже разряд, тем разрушительнее это влияет на аккумулятор. Короткая подзарядка в течение 1-2 часов во время интенсивной эксплуатации благотворно скажется на сроке службы аккумулятора.
-
Не допускайте падения уровня электролита ниже верхней части пластин. Оголенные части пластин сульфатируются и становятся неактивными. При низком уровне электролита перед зарядкой добавьте воды так, чтобы только покрыть пластины. Уже после зарядки приведите уровень электролита к рекомендованной высоте.
-
Никогда не добавляйте кислоту. Это приведет к чрезмерному увеличению удельной плотности, что чревато коррозионными явлениями.
-
Используйте только дистиллированную или ионизированную воду.
-
Новые аккумуляторы, оптимизированные под глубокие разряды, имеют начальную емкость на уровне 70% от номинальной. Уже во время эксплуатации будет завершен процесс формирования, во время которого его производительность будет постепенно возрастать. В течение первых 5 циклов не подвергайте аккумулятор сильным разрядным нагрузкам, чтобы не навредить процессу формирования.
-
Как показывает практика, новые аккумуляторы с заниженной емкостью и в дальнейшем не будут показывать ожидаемой производительности. Рекомендуется проверять емкость перед покупкой во избежание дальнейших проблем.
-
Аккумуляторы, поддерживающие технологию “старт-стоп”, имеют в своем составе на 25% больше свинца в сравнении с обычными стартерными для обеспечения большего количества циклов. Этот факт влияет на стоимость.
Последнее обновление 2016-03-07
Разрешение в датчиках QCM для вязкости и плотности жидкостей: применение для свинцово-кислотных аккумуляторов
DOI: 10,3390 / s120810604. Epub 2012 3 августа.Принадлежности Расширять
Принадлежность
- 1 Департамент электронных технологий, Университет Виго, кампус Лагоас Маркосенде, Виго 36310, Испания[email protected]
Элемент в буфере обмена
Ана Мария Као-Пас и др. Датчики (Базель). 2012 г.
Бесплатная статья PMC Показать детали Показать вариантыПоказать варианты
Формат АннотацияPubMedPMID
DOI: 10.3390 / с120810604. Epub 2012 3 августа.Принадлежность
- 1 Департамент электронных технологий, Университет Виго, кампус Лагоас Маркосенде, Виго 36310, Испания. [email protected]
Элемент в буфере обмена
Полнотекстовые ссылки Опции CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
В аккумуляторных приложениях, особенно в автомобилях, подводных лодках и в системах удаленной связи, состояние заряда (SoC) необходимо для эффективного управления аккумуляторами.Наиболее широко используемый физический параметр для этого — плотность электролита. Однако существует большая зависимость между вязкостью электролита и SoC, чем наблюдаемая для плотности и SoC. В данной статье представлен датчик микровесов на кристаллах кварца (QCM) для измерения плотности электролита и вязкости продукта в свинцово-кислотных аккумуляторах. Датчик калибруется в растворах H (2) SO (4) в диапазоне электролита аккумулятора для получения чувствительности, шума и разрешения. Кроме того, в режиме реального времени проводятся испытания заряда и разряда, при этом кристалл кварца помещается внутрь батареи.В то же время определяется существующий теоретический «предел разрешающей способности» для измерения квадратного корня из произведения плотность-вязкость [Формула: см. Текст] жидкой среды или наилучшего разрешения, достижимого с помощью генератора QCM. Результаты показывают, что предел разрешения зависит только от характеристик исследуемой жидкости, а не от частоты. Предел разрешения QCM для измерений [Формула: см. Текст] ухудшается при увеличении произведения плотности и вязкости жидкости, но это не может быть улучшено путем увеличения рабочей частоты.
Ключевые слова: измерение плотности-вязкости продукта; частотный шум; свинцово-кислотные батареи; кварцевые микровесы; разрешающая способность; чувствительность; состояние заряда.
Цифры
Рисунок 1.
Электромеханическая модель пьезоэлектрика…
Рисунок 1.
Электромеханическая модель пьезоэлектрического резонатора для микрогравиметрических исследований в жидкости; Сечение…
Рисунок 1.Электромеханическая модель пьезоэлектрического резонатора для микрогравиметрических исследований в жидкости; Поперечное сечение нагруженного резонатора и эквивалентная схема BVD, модифицированная Мартином и Гранстаффом.
Рисунок 2.
Экспериментальная установка для калибровки…
Рисунок 2.
Экспериментальная установка для калибровки датчика ( a ) Схема подключения,…
Фигура 2.Экспериментальная установка для калибровки датчика ( a ) Схема подключения, ( b ) Экспериментальный испытательный стенд, ( c ) Кристалл кварца во время калибровки растворами серной кислоты.
Рисунок 3.
Изменение частоты колебаний…
Рисунок 3.
Изменение частоты колебаний в зависимости от температуры полностью заряженной батареи (40%…
Рисунок 3.Изменение частоты колебаний в зависимости от температуры в полностью заряженной батарее (40% серная кислота), Δ f QCM , и компенсация изменения квадратного корня из произведения вязкость-плотность в зависимости от температуры, Δf (T) = Δ f QCM −Δ f ρη (T).
Рисунок 4.
Держатель кварцевого кристалла для…
Рисунок 4.
Держатель кварцевого кристалла, предназначенный для измерения заряда батареи в реальном времени. ( a ) Внешний вид…
Рисунок 4.Держатель кварцевого кристалла, предназначенный для измерения заряда батареи в реальном времени. ( a ) Внешний вид кристалла в сборе на держателе; ( b ) Деталь области кристалла; ( c ) Воздушная камера для колебаний кристалла.
Рисунок 5.
Датчик QCM, расположенный внутри…
Рисунок 5.
ДатчикQCM помещается внутри батареи во время измерений в реальном времени.
Рисунок 5. ДатчикQCM помещается внутри батареи во время измерений в реальном времени.
Рисунок 6.
Датчик частоты и жидкости QCM…
Рисунок 6.
Частота датчика QCM и температура жидкости во время испытания растворов.
Рисунок 6.Частота датчика QCM и температура жидкости во время испытания растворов.
Рисунок 7.
Градуировочный график QCM…
Рисунок 7.
Градуировочный график датчика QCM.
Рисунок 7.Градуировочный график датчика QCM.
Рисунок 8.
Соотношение добротности и…
Рисунок 8.
Связь между добротностью и ρ η.
Рисунок 8.Соотношение между добротностью и рп.
Рисунок 9.
Связь между отклонением Аллана и…
Рисунок 9.
Связь между девиацией Аллана и ρ η.
Рисунок 9.Связь между девиацией Аллана и рп.
Рисунок 10.
Частота колебаний за четыре дня…
Рисунок 10.
Частота колебаний за четыре дня при погружении резонатора в аккумуляторную батарею…
Рисунок 10.Частота колебаний в течение четырех дней при погружении резонатора в аккумуляторную ячейку полностью заряженного аккумулятора (40% серная кислота) и температуре электролита.
Рисунок 11.
Частота колебаний за четыре дня…
Рисунок 11.
Частота колебаний в течение четырех дней после температурной компенсации и девиации Аллана.
Рисунок 11.Частота колебаний в течение четырех дней после температурной компенсации и девиации Аллана.
Рисунок 11.
Частота колебаний за четыре дня…
Рисунок 11.
Частота колебаний в течение четырех дней после температурной компенсации и девиации Аллана.
Рисунок 11.Частота колебаний в течение четырех дней после температурной компенсации и девиации Аллана.
Рисунок 12.
Частота колебаний и температура…
Рисунок 12.
Частота колебаний и температура датчика QCM во время пробной зарядки.
Рисунок 12.Частота колебаний и температура датчика QCM во время пробной зарядки.
Рисунок 13.
Частота датчика QCM…
Рисунок 13.
Частота датчика QCM после температурной компенсации по уравнениям (14) — (17) и вариациям…
Рисунок 13.Частота датчика QCM после температурной компенсации с использованием уравнений (14) — (17) и вариации ρη в процессе заряда.
Рисунок 14.
Частота колебаний и температура…
Рисунок 14.
Частота колебаний и температура датчика QCM при испытании на разряд.
Рис 14.Частота колебаний и температура датчика QCM при испытании на разряд.
Рисунок 15.
Частота датчика QCM…
Рисунок 15.
Частота датчика QCM после температурной компенсации по уравнениям (14) — (17) и вариациям…
Рисунок 15.Частота датчика QCM после температурной компенсации с использованием уравнений (14) — (17) и вариации ρη в процессе разряда.
Все фигурки (16)
Похожие статьи
- Различные экспериментальные результаты влияния угла погружения на резонансную частоту кварцевых микровесов в жидкой фазе: с комментарием.
Шен Д., Кан Ц., Ли Х, Цай Х, Ван Ю. Шен Д. и др. Анальный Чим Акта. 19 июня 2007 г .; 593 (2): 188-95. DOI: 10.1016 / j.aca.2007.03.059. Epub 2007 1 апреля. Анальный Чим Акта. 2007 г. PMID: 17543606
- Небольшой объем лабораторных измерений на микросхеме с использованием кварцевых микровесов для измерения произведения вязкости и плотности ионных жидкостей при комнатной температуре.
Дой Н., Макхейл Дж., Ньютон М.И., Хардакр К., Дж. Р., Макиннес Дж. М., Кувшинов Д., Аллен Р. В.. Дой Н. и др. Биомикрофлюидика. 2010 8 марта; 4 (1): 14107. DOI: 10,1063 / 1,3353379. Биомикрофлюидика. 2010 г. PMID: 20644676 Бесплатная статья PMC.
- Многоточечный датчик на основе оптического волокна для измерения плотности электролита в свинцово-кислотных аккумуляторах.
Као-Пас А.М., Маркос-Асеведо Дж., Дель Рио-Васкес А., Мартинес-Пеньялвер С., Лаго-Феррейро А., Ногейрас-Мелендес А.А., Доваль-Гандой Дж.Cao-Paz AM, et al. Датчики (Базель). 2010; 10 (4): 2587-608. DOI: 10,3390 / s100402587. Epub 2010 25 марта. Датчики (Базель). 2010 г. PMID: 22319262 Бесплатная статья PMC.
- Кварцевые микровесы с электронными интерфейсными системами: обзор.
Аласси А., Бенаммар М., Бретт Д. Аласси А. и др. Датчики (Базель). 2017 5 декабря; 17 (12): 2799. DOI: 10,3390 / s17122799.Датчики (Базель). 2017 г. PMID: 29206212 Бесплатная статья PMC. Рассмотрение.
- Кварцевые микровесы: полезный инструмент для изучения тонких полимерных пленок и сложных биомолекулярных систем на границе раздела раствор-поверхность.
Маркс К.А. Маркс К.А. Биомакромолекулы. 2003 сентябрь-октябрь; 4 (5): 1099-120. DOI: 10.1021 / bm020116i. Биомакромолекулы. 2003 г. PMID: 12959572 Рассмотрение.
Процитировано
8 статей- Датчик измерения вязкости: прототип нового медицинского диагностического метода на основе кварцевого резонатора.
Миранда-Мартинес А., Ривера-Гонсалес М.Х., Зейноун М., Карвахаль-Ахумада, Л.А., Серрано-Ольмедо Дж. Дж. Миранда-Мартинес А. и др.Датчики (Базель). 2021 г., 13 апреля; 21 (8): 2743. DOI: 10,3390 / s21082743. Датчики (Базель). 2021 г. PMID: 33924605 Бесплатная статья PMC.
- Обнаружение белков без этикеток с помощью микроакустического биосенсора в сочетании с сортировкой по электрическому полю. Теоретическое исследование на моделях мочи.
Мухин Н., Коноплев Г., Осеев А., Шмидт М.П., Степанова О., Козырев А., Дмитриев А., Хирш С. Мухин Н. и др.Датчики (Базель). 2021 6 апреля; 21 (7): 2555. DOI: 10,3390 / s21072555. Датчики (Базель). 2021 г. PMID: 33
- 4 Бесплатная статья PMC.
- Высокочувствительный двойной электрохимический контроль качества для надежных трехэлектродных измерений.
Тот Д., Каспер М., Алик I, Авадейн М., Эбнер А., Бэйни Д., Грамсе Дж., Кинбергер Ф. Tóth D, et al. Датчики (Базель). 2021, 7 апреля; 21 (8): 2592.DOI: 10,3390 / s21082592. Датчики (Базель). 2021 г. PMID: 335 Бесплатная статья PMC.
- Улучшенные характеристики измерения индуктивности двойного кварцевого преобразователя.
Матко В, Миланович М. Матко В. и др. Датчики (Базель). 2019 11 мая; 19 (9): 2188. DOI: 10,3390 / s1
88. Датчики (Базель). 2019. PMID: 31083570 Бесплатная статья PMC.
- Платформа из фторированного MOF для выборочного удаления и определения SO 2 из дымовых газов и воздуха.
Tchalala MR, Bhatt PM, Chappanda KN, Tavares SR, Adil K, Belmabkhout Y, Shkurenko A, Cadiau A., Heymans N, De Weireld G, Maurin G, Salama KN, Eddaoudi M. Tchalala MR, et al. Nat Commun. 2019 22 марта; 10 (1): 1328. DOI: 10.1038 / s41467-019-09157-2. Nat Commun. 2019. PMID: 302 Бесплатная статья PMC.
использованная литература
- Линден Д., Редди Т. Справочник батарей. Макгроу Хилл; Нью-Йорк, Нью-Йорк, США: 2002.
- Мозли П.Т., Гарче Дж., Паркер К.Д., Рэнд Д.А.Дж. Свинцово-кислотные аккумуляторы с клапанным регулированием. Эльзевир; Амстердам, Нидерланды: 2004.
- Арнау А. Обзор интерфейсных электронных систем для микровесов из кристаллов кварца с разрезом в жидкостях.Датчики. 2008. 8: 370–411. — ЧВК — PubMed
- Зауэрбрей К.Г. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung.Z. Phys. 1959; 155: 206–222.
- Канадзава К.К., Гордон Дж.Г. Частота контакта кварцевых микровесов с жидкостью. Анальный. Chem. 1985; 57: 1770–1771.
Показать все 22 ссылки
Типы публикаций
- Поддержка исследований, Non-U.С. Правительство
LinkOut — дополнительные ресурсы
Источники полных текстов
Источники другой литературы
Исследовательские материалы
Как химический состав батареи определяет производительность
В основе конструкции батареи лежат химические реакции батареиАккумуляторы с продуманной конструкцией обеспечивают эффективное, надежное и безопасное питание вашего оборудования в течение длительного срока службы.Чтобы достичь этой комбинации идеалов, инженеры оценивают определенные параметры конструкции, включая потребности в напряжении и мощности, продолжительность рабочего цикла, температурные условия, цену и многое другое, чтобы руководствоваться своим выбором конструкции.
Химический состав батарей — это, пожалуй, самый фундаментальный выбор при проектировании. По своей сути все батареи представляют собой удобно расположенные электрохимические реакции. Способность батареи накапливать и разряжать электричество напрямую зависит от типа химической реакции.
В этой статье мы подробно рассмотрим, как химия влияет на производительность.Затем мы рассмотрим свойства некоторых распространенных химических соединений.
Для проектирования, тестирования и производства нестандартных аккумуляторных батарей выберите Aved. Мы создадим аккумуляторные блоки, идеально подходящие для вашего конкретного применения. Свяжитесь с нами для получения дополнительной информации о процессе или запросите коммерческое предложение сегодня .
Химический состав аккумуляторов влияет на напряжение, плотность энергии, способность к перезарядке, саморазряд, срок службы и безопасностьАккумуляторная батарея состоит из одного или нескольких упакованных аккумуляторных модулей.Батарейный модуль состоит из электрохимических ячеек, расположенных параллельно или последовательно. Электрохимический элемент, также называемый гальваническим элементом, состоит из трех основных частей: анода , катода и электролита . Вместе анод, катод и электролит позволяют протекать реакции окисления / восстановления .
Реакции окисления / восстановления — это примерно поток электронов . Когда железо окисляется, атомы железа отдают электроны, а молекулы кислорода приобретают электроны.Разница между ржавым куском металла и батареей заключается в разделении этих двух событий. Это заставляет электроны проходить через цепь, чтобы завершить реакцию. Во время разряда анод теряет электроны, а катод их приобретает. Электролит способствует этим реакциям и позволяет ионам существовать в растворе.
Во время разряда батареи анод окисляется и отдает электроны. Электроны проходят через цепь к катоду, вызывая реакцию восстановления.Электролит обеспечивает обмен ионами. Во время зарядки аккумулятора процесс обратный. Состав анода, катода и электролита изменяет многие свойства батареи.
Вот некоторые электрические свойства, которые зависят от химического состава батареи:
Напряжение элемента
Все гальванические элементы одного химического состава выдают одинаковое номинальное напряжение . Это связано с тем, что напряжение напрямую связано с благоприятностью реакции окисления / восстановления.Более благоприятные реакции вызывают более высокие напряжения. Например, литий-ионные химические соединения имеют номинальное напряжение около 3,6 В.
Плотность энергии
Напряжение — не единственное средство измерения ценности батареи. Вы можете получить любое необходимое напряжение и ток при правильном расположении ячеек последовательно и параллельно. В зависимости от ваших потребностей он может быть тяжелым, громоздким и дорогим. Плотность энергии измеряет энергию, запасаемую аккумулятором, в зависимости от его размера.Гравиметрическая плотность энергии измеряется в ватт-часах на килограмм (Втч / кг).
Перезаряжаемый
Это трюизм, что химические реакции протекают в двух направлениях. Вы можете начать с реагентов и получить продукты или использовать продукты для повторного получения реагентов. Если вы примените обратное напряжение и ток, вы можете заставить анод принимать электроны, а катод отдавать их, перезаряжая батарею — по крайней мере, теоретически. На практике отменить некоторые реакции бывает чрезвычайно сложно. Первичные элементы — это батареи, химический состав которых делает их перезарядку неэкономичной или небезопасной. Это одноразовые батареи. Вторичные элементы , также известные как аккумуляторные батареи, основаны на легкообратимой электрохимии. В этой статье мы сосредоточимся на химическом составе вторичных клеток.
Саморазряд и срок службы
В идеальном мире мы могли бы заряжать и разряжать батареи снова и снова без потери производительности или оставлять их на полке на месяцы без потери заряда.В реальном мире гальванические элементы страдают от нежелательных химических реакций. Пока батарея стоит на полке, происходят спонтанные химические реакции, которые истощают заряд батареи. Это называется саморазряд .
Аналогичным образом, когда аккумулятор заряжается и разряжается, происходят нежелательные химические реакции, которые снижают способность аккумулятора накапливать электричество. Количество циклов, в течение которых аккумулятор может использоваться до того, как он перестанет работать должным образом, составляет цикл жизни .
Как скорость саморазряда, так и продолжительность цикла зависят от химического состава батареи.Однако они также зависят от условий использования и хранения.
Экономика, окружающая среда и безопасность
Наконец, примите во внимание экологические и экономические соображения. Некоторые типы батарей просто дороже, чем другие. Литий-ионные элементы популярны и не зря, но дефицит металлического лития делает их дорогими.
Вы также должны учитывать соображения безопасности и окружающей среды в своих экономических расчетах.Некоторые химические составы батарей очень токсичны или вызывают коррозию, что может усложнить утилизацию.
Химические продукты на основе никеляБудучи одновременно доступными и проверенными, химические продукты на основе никеля находят множество применений. В этой статье мы сосредоточимся на трех основных химических соединениях никеля: никель-кадмиевый, никель-металлогидридный и никель-железный. Никель-цинковые и никель-водородные химические соединения также существуют, хотя их применение меньше. Никель-водородные батареи особенно используются на спутниках из-за их широкого диапазона температурных допусков.
Никель-кадмиевый
Никель-кадмиевые (NiCd) батареипрочные, эластичные и обеспечивают длительный срок службы. Их напряжение также очень стабильное, настолько, что состояние заряда нельзя определить по падению напряжения, как у других аккумуляторов. NiCd-элементы можно заряжать очень быстро без ущерба для безопасности. Наконец, никель-кадмиевые батареи являются одними из самых доступных вторичных батарей на рынке.
Однако у никель-кадмиевых аккумуляторов есть некоторые недостатки.Во-первых, хотя они опережают свинцово-кислотные батареи по плотности энергии, они работают хуже, чем другие современные аккумуляторы. Во-вторых, у них наблюдается высокая скорость саморазряда .
У никель-кадмиевых аккумуляторовнаблюдается интересное, но неудобное явление: эффект памяти . Эффект памяти относится к тому, как снаружи никель-кадмиевые батареи «запоминают», насколько глубоко они были разряжены в прошлом, и обеспечивают эту глубину разряда только в будущих циклах. Это вызвано скоплением кристаллов соли, которые засоряют электрод.
Образование кристаллов вызывает эффект памяти. Скопление кристаллов препятствует активной части анода. На верхнем изображении показано нормальное образование кристаллов на аноде. На нижнем изображении показаны большие препятствующие кристаллы. Источник: Aero Electric
Наконец, и это, пожалуй, самое главное, никель-кадмиевые элементы представляют опасность для окружающей среды. Кадмий очень токсичен, а электролит — гидроксид калия, очень сильное основание. Эти опасности затрудняют надлежащую утилизацию никель-кадмиевых элементов.Хотя иногда они считаются устаревшими, никель-кадмиевые элементы все еще используются в нишевых приложениях, таких как авиация.
Ознакомьтесь с техническими характеристиками никель-кадмиевых аккумуляторов:
- Номинальное напряжение элемента : 1,2 В
- Плотность энергии : ~ 45-80 Втч / кг
- Анод : гидроксид никеля
- Катод : гидроксид кадмия
- Электролит : гидроксид калия
- Саморазряд : ~ 10%
- Опасность для окружающей среды : Токсичный, коррозионный
Никель-металлогидридный
Никель-металлогидридные элементы (NiMH) представляют собой более современную версию NiCd-элементов.На первый взгляд, NiMH-элементы по-прежнему очень похожи на NiCd-элементы — в них по-прежнему используется щелочной электролит, такой как гидроксид калия, а катодом по-прежнему является гидроксид никеля.
Основное отличие состоит в том, что NiMH-элементы заменяют токсичный кадмий на аноды с более высокими характеристиками. Точный состав варьируется — отсюда и использование «металла» — но все аноды представляют собой сплавы редкоземельных металлов. Эта замена увеличивает стоимость, но делает их более экологичными и обеспечивает более высокую емкость , уменьшает эффект памяти , а снижает температурную чувствительность .
Ознакомьтесь с техническими характеристиками никель-кадмиевых аккумуляторов:
Никель-железо
Никель-железные элементы встречаются редко, возможно, из-за их высокой цены, низкой плотности энергии и высокого саморазряда. Однако они эластичны, долговечны и долговечны при высоких температурах.
Ознакомьтесь с техническими характеристиками никель-железных аккумуляторов:
- Номинальное напряжение элемента : ~ 1,2 В
- Плотность энергии : ~ 50 Втч / кг
- Анод : железо
- Катод : гидроксид никеля
- Электролит : гидроксид калия
- Саморазряд : 20-30% в месяц
- Опасность для окружающей среды : Коррозийный
Свинцово-кислотные аккумуляторы — это рабочие лошадки.Эти прочные и надежные батареи обеспечивают низкую стоимость энергии и низкий уровень саморазряда. Помимо экологических проблем, связанных со свинцом и сильнокислотными электролитами, основными недостатками свинцово-кислотных аккумуляторов являются вес и низкая удельная энергия. Это делает их идеальным выбором для ситуаций, когда вес не имеет большого значения, например для автомобилей, гольф-каров, вилочных погрузчиков и источников бесперебойного питания.
Химический состав свинцово-кислотных аккумуляторов различается. Свинец составляет большую часть анода в виде сетки.Однако свинец слишком мягкий, чтобы выдерживать его собственный вес, поэтому для улучшения структурной целостности и электрохимических свойств используются такие металлы, как сурьма, кальций, олово или селен.
Ознакомьтесь со следующими характеристиками свинцово-кислотных аккумуляторов:
- Номинальное напряжение элемента : ~ 2 В
- Плотность энергии : 30-50 Втч / кг
- Анод : свинец (с другими)
- Катод : диоксид свинца
- Электролит : серный кислота
- Саморазряд : 5% в месяц
- Опасности для окружающей среды : токсичный, коррозионный
Самая популярная вещь в накопителях энергии на сегодняшний день, литий-ионные (литий-ионные) батареи обеспечивают высокую плотность энергии и при этом остаются легкими, что делает их востребованными для телефонов, компьютеров, электромобилей и т. Д.
Литий-ионные батареифактически не используют чистый металлический литий. Как и натрий, литий обладает высокой реакционной способностью, и первые литий-металлические батареи были склонны к возгоранию и взрыву — знакомая проблема для литиевых батарей.
Вместо этого литий-ионные батареи имеют катоды из ионных соединений лития. Существует несколько типов катодов, включая оксид лития-кобальта (LiCoO2), фосфат лития-железа (LiFePO4), оксид лития-марганца (LiMn2O4) и оксид лития-никель-марганца-кобальта (LiNiMnCoO2).
Аноды для литий-ионных элементов состоят из пористого материала, такого как графит, который связывает ионы лития и выделяет их в электролит во время разряда батареи. Силиконовые аноды также являются перспективными анодными материалами. В будущем в качестве анодов можно будет использовать графен (листы углерода толщиной в один атом).
В качестве электролитов в литий-ионных элементах используются соли лития, растворенные в (легковоспламеняющихся) органических соединениях. Твердые керамические электролиты могут стать многообещающей альтернативой.
У литий-ионной химии есть два основных недостатка: стоит и хрупкость .Литий может быть дорогостоящим, а его добыча — интенсивный и экологически вредный процесс. Однако металлы, такие как кобальт, используемые в литий-ионной химии, поднимают цены на батареи не меньше, а то и больше, чем одноименный литий.
Помимо своей дороговизны, литий-ионные батареи требуют особых условий эксплуатации, поскольку они чувствительны к перезарядке и быстрой разрядке. Литий-ионные элементы получили репутацию огнестойких или взрывоопасных . Этих проблем можно избежать за счет правильного проектирования и тестирования, защиты цепей, правильного использования и предотвращения повреждений.Но факт остается фактом: литий-ионные аккумуляторы хрупкие.
Это видео из EE World Online показывает, что происходит, когда вы удаляете схему защиты и игнорируете рекомендации по безопасности для литий-ионных батарей:
Ознакомьтесь со следующими характеристиками литий-ионного аккумулятора:
- Номинальное напряжение элемента : 3,6 В
- Плотность энергии : 110-265 Втч / кг
- Анод : углерод, кремний и др.
- Катод : соединения лития
- Электролит : соли лития в органических растворителях
- Саморазряд : 0.От 35% до 2,5% в месяц
- Опасности для окружающей среды : Легковоспламеняющийся органический электролит
От расположения ячеек до системы терморегулирования — производительность аккумуляторной батареи зависит от многих факторов. Химический состав аккумуляторов — это фундаментальный выбор при проектировании и выборе аккумуляторов.
Состав анода, катода и электролита определяет напряжение батареи, плотность энергии, саморазряд, срок службы и многое другое.Конечно, химический состав батареи сложным образом взаимодействует с другими переменными. Посетите наш блог, чтобы узнать больше о том, как температура влияет на производительность аккумулятора. [PD1]
Конструкция батарейного блока включает множество переменных, из которых химический состав батарей — лишь одна из них. Наши высококвалифицированные инженеры и техники могут спроектировать аккумулятор, отвечающий конкретным потребностям вашего предприятия. Свяжитесь с нами , чтобы обсудить подробный проект или запросить расценки , чтобы начать работу над индивидуальным решением для аккумуляторной батареи.
Правда о свинцово-кислотных и свинцово-кислотных. Литий-ионные батареи в жилых домах
Клинт Демеритт 17 марта 2021 г.
Каждый жилец дома знает, что качественный двигатель и домашние аккумуляторные батареи являются ключом к успешному путешествию, но не все понимают плюсы и минусы различных типов батарей. Есть ли большая разница между двумя основными типами батарей, свинцово-кислотными и литий-ионными?
Будет ли иметь значение, какой тип батареи вы выберете для удовлетворения своих потребностей в энергии в качестве автофургона? (Подсказка: держите пари!)
Что в этом такого? Что ж, как только вы поймете разницу между свинцово-кислотными и свинцовыми кислотами.литий-ионные аккумуляторы, вы будете хорошо вооружены, чтобы выбрать аккумулятор или набор аккумуляторов, которые обеспечат ваши потребности на долгие годы. Это грандиозная сделка, так что давайте прямо сейчас:
Свинцово-кислотные и литий-ионные батареи
Свинцово-кислотные батареи используются с середины 1800-х годов и являются самым ранним из существующих типов аккумуляторных батарей! Технология свинцово-кислотных аккумуляторов, которой уже более 170 лет, является зрелой и успешной. Но это также означает, что он не использует преимущества самых передовых доступных технологий.Давайте посмотрим, как это может повлиять, в частности, на жителей домов на колесах.
Свинцово-кислотные батареи производят электричество в результате химической реакции. Каждая 12-вольтовая батарея содержит шесть (6) ячеек. И каждая ячейка содержит смесь серной кислоты и воды (в разной степени). Каждая ячейка имеет положительную клемму и отрицательную клемму. Когда аккумулятор вырабатывает энергию, он при этом разряжается. Химическая реакция заставляет серную кислоту распадаться на воду, хранящуюся внутри каждой ячейки, чтобы разбавить кислоту.Таким образом, использование силы истощает кислоту.
Когда аккумулятор заряжается, процесс меняется в обратном направлении, и при перезарядке аккумуляторы снова накапливаются молекулы кислоты. Этот процесс — накопление энергии. (Помните — аккумулятор не накапливает электричество. Он накапливает химическую энергию, необходимую для производства электричества.)
Каждая из шести ячеек 12-вольтовой свинцово-кислотной батареи имеет напряжение около 2,1 вольт при полной зарядке. Эти шесть ячеек вместе дают полностью заряженную батарею, насчитывающую около 12.6 вольт. (Мы используем такие термины, как «около» и «около», потому что точное напряжение зависит от различных факторов, в частности от батареи, а также от использования и ухода за этой батареей.)
Типы свинцово-кислотных аккумуляторов
Теперь, когда мы знаем, как работает типичная свинцово-кислотная батарея, давайте посмотрим на различные типы имеющихся свинцово-кислотных аккумуляторов и их различия.
Затоплено
Свинцово-кислотная аккумуляторная батарея залитой водой — это аккумуляторная батарея, обычно используемая в качестве аккумуляторной батареи двигателя для запуска транспортного средства.Этот тип батареи также можно использовать в качестве батареи для тележки для гольфа, мотоцикла или даже батареи глубокого цикла в солнечной системе.
При залитой свинцово-кислотной батарее владелец может получить доступ к шести (6) отдельным элементам, упомянутым ранее, и может (и должен!) Добавить в элементы дистиллированную воду, чтобы они не высыхали. Эти батареи тяжелые и требуют серьезного обслуживания.
Запечатанный
Герметичный свинцово-кислотный аккумулятор по существу аналогичен внутреннему функционированию самой батареи.Однако слово «запечатанный» означает, что у нас нет доступа к шести элементам, как в залитой свинцово-кислотной батарее. Обычно эти батареи используются в качестве батарей для запуска двигателей или в устройствах глубокого цикла.
В отличие от свинцово-кислотных свинцово-кислотных аккумуляторов, производители конструируют герметичные свинцово-кислотные аккумуляторы с достаточным количеством кислоты, чтобы обеспечить надежную работу аккумулятора в течение срока действия гарантии. В герметичную свинцово-кислотную батарею нельзя добавлять дистиллированную воду, поэтому никакого реального обслуживания не требуется.Эти батареи также не выделяют газов и могут быть установлены в закрытых помещениях.
Абсорбированный стеклянный мат (AGM)
AGM означает «Абсорбированный стеклянный мат», что означает, что электролиты в этих батареях взвешены близко к свинцовым пластинам. Этот метод якобы увеличивает эффективность разряда и перезарядки. Нередко можно увидеть аккумуляторы AGM, используемые в жилых автофургонах, морских судах или в аккумуляторных батареях двигателей. В отличие от залитых и герметичных аккумуляторов, AGM-аккумулятор по-прежнему является аккумулятором с жидкими элементами.
лари
Подобно батарее AGM, батарея гелевых элементов имеет взвешенный электролит, но гелевый элемент содержит диоксид кремния, позволяющий ему затвердеть, поэтому это не батарея с влажными элементами, как батарея AGM.
Гелевые батареи, пожалуй, наиболее чувствительны к повреждениям от перезарядки. Эти батареи требуют специальных зарядных устройств и обычно используются в приложениях с глубоким циклом, таких как инвалидные коляски, троллинговые двигатели и жилые автофургоны. Гелевые батареи не так распространены, как другие типы свинцово-кислотных батарей, которые мы обсуждали.
Плюсы свинцово-кислотных аккумуляторов
Свинцово-кислотные батареи популярны по разным причинам. Во-первых, они предлагают зрелые технологии, которые существуют уже более полутора веков. Это часто дает людям чувство безопасности как широко понятной технологии.
Свинцово-кислотные батареи относительно недороги в производстве (хотя и вредны для окружающей среды), поэтому их относительно дешево покупать заранее. С точки зрения затрат, они поначалу кажутся более выгодными для потребителей.Однако при этом не учитывается общий срок службы батареи или фактическое количество энергии, которое вы получаете от них. Продолжайте читать, чтобы узнать, как свинцово-кислотные соединения сравниваются с литием по этим показателям.
Свинцово-кислотные аккумуляторыспособны к глубокому разряду, хотя глубокий разряд значительно сокращает срок их службы.
Минусы свинцово-кислотных аккумуляторов по сравнению с литий-ионными
Хотя свинцово-кислотные батареи были самым успешным источником энергии в течение многих лет, они имеют ряд серьезных недостатков по сравнению с современными литиевыми батареями.
Вес, пространство и плотность энергии
Свинцово-кислотные батареи очень тяжелые. Вес может быть серьезным недостатком для мобильных приложений. Они также не хранят значительного количества энергии для своего размера. Их вес означает, что для хранения энергии, достаточной для домашнего использования, потребуется много места. То, сколько они хранят на единицу веса и пространства, называется их плотностью энергии, которая относительно низка для батарей.
Требования к зарядке и разрядке
Свинцово-кислотные батареи заряжаются долго.Длительное время зарядки связано с их внутренней конструкцией, которая замедляет заряд по мере приближения к завершению. Цикл абсорбционной зарядки вызывает это замедление.
Если аккумулятор не успевает всасывать заряд до разрядки, это может вызвать сульфатирование аккумулятора. Сульфатирование влияет на время зарядки, эффективность зарядки и увеличивает температуру аккумулятора.
Когда вы слишком долго разряжаете свинцово-кислотную батарею, она также теряет часть своей способности принимать заряд, что снижает ее емкость.Это повреждение связано с тем, что сульфат свинца кристаллизуется и больше не растворяется.
Эффект Пойкерта
Свинцово-кислотные батареи при высокой скорости разряда для больших приборов страдают эффектом Пойкерта. Эффект Пойкерта — это явление, при котором батарея вырабатывает меньше энергии до падения напряжения при разряде при высоких нагрузках, чем при более низких нагрузках. Это означает, что вы не получаете всю энергию от вставленной батареи. Тепловые и химические потери тратят энергию.
По мере увеличения тока емкость снижается.Перезарядка также может вызвать «газообразование». Аккумулятор выделяет водород, кислород и сероводород. Это легковоспламеняющееся сочетание, которое в некоторых случаях также может привести к взрывам. Если вы когда-нибудь почувствуете запах тухлых яиц, исходящих от свинцово-кислотной батареи, выпустите воздух из зоны и немедленно отключите ее.
Свинцово-кислотные аккумуляторные батареи в целом могут быть экономичным решением для аккумулирования электроэнергии, но для их работоспособности и безопасности требуются очень специфические параметры зарядки и разрядки.
Ограниченный срок службы
Если какой-либо из указанных выше параметров заряда выходит из строя, срок службы свинцово-кислотной батареи сокращается. Даже если все параметры поддерживаются в идеальном состоянии, химические процессы в батарее нарушаются по мере использования и со временем снижают емкость батареи.
Воздействие на окружающую среду
Свинцово-кислотные батареи являются одними из самых перерабатываемых предметов в мире. Это очень важно и важно, потому что содержание свинца в них на протяжении многих лет является причиной серьезных проблем, связанных с окружающей средой и здоровьем.Однако 5% свинцово-кислотных аккумуляторов не перерабатываются. В результате в окружающую среду выбрасываются миллионы метрических тонн свинца.
Свинцовые рудники также являются одними из самых токсичных и вызвали образование ядовитых грунтовых вод на больших площадях. Длительное воздействие свинца, даже в незначительных количествах, может вызвать повреждение мозга и почек и проблемы с обучением у детей, что беспокоит всех нас, живущих на этой планете.
К сожалению, здесь оказывается слишком много свинцово-кислотных аккумуляторовЛитий-ионные аккумуляторы
Литий-ионные аккумуляторыв последние годы становятся все более популярными, и не без оснований.Давайте посмотрим на некоторые причины, по которым эти относительные новички привлекли столько внимания!
В ходе химического процесса в литий-ионных аккумуляторах во время зарядки и разрядки ионы лития перемещаются между положительным и отрицательным электродами. Когда батарея разряжается, ионы лития движутся к положительному электроду, теряя или приобретая электрон в результате химических реакций. Эти химические реакции создают поток электронов, который производит электрический ток.В процессе зарядки происходит обратное.
В мобильной электронике, такой как телефоны, электросамокаты и велосипеды, гироскутеры и инвалидные коляски, обычно используются литиевые батареи. Но в последние годы использование литий-ионных батарей расширилось, и они нашли применение в жилых автофургонах, лодках и многих других солнечных батареях.
Типы литий-ионных батарей
Подобно свинцово-кислотным аккумуляторам, существует много различных типов литий-ионных аккумуляторов. Существует еще много типов литий-ионных батарей, поскольку их химический состав может сильно различаться.Несмотря на то, что существует так много типов, большинство литий-ионных аккумуляторов имеют аналогичные преимущества по сравнению со свинцово-кислотными.
В данной статье мы будем в первую очередь обращаться к батареям LiFePo4 или так называемым литиево-железо-фосфатным батареям. «Литий-железо» — наиболее распространенный химический состав, используемый для накопления энергии в жилых автофургонах, лодках и домах. Люди используют эти батареи, потому что они обладают превосходными характеристиками по сравнению со свинцово-кислотными, но при этом являются очень безопасным химическим составом.
Плюсы литий-ионных аккумуляторов
При сравнении свинцово-кислотных илитий-ионные аккумуляторы мы преодолеваем практически все минусы свинцово-кислотных. Что касается использования жилых автофургонов, в частности, литий-ионные батареи будут работать с несколькими устройствами одновременно. Единственным ограничением является мощность инвертора RV.
Но если у вас достаточно инвертора, вы сможете управлять холодильником, светом, вентилятором, телевизором, компьютерами и даже кондиционерами.
Вес, пространство и плотность энергии
Плотность энергии означает, сколько энергии хранит батарея в зависимости от ее площади и веса.Литиевые батареи имеют гораздо более высокую плотность энергии, чем свинцово-кислотные.
Более высокая плотность энергии является огромным преимуществом для мобильных вариантов использования, поскольку пространство и вес ограничены. При том же количестве энергии, что и в свинцово-кислотных, литиевые батареи весят меньше четверти веса!
Также требуется меньше батарей, поэтому для хранения можно использовать больше места. Литий-ионные аккумуляторы хранят гораздо больше энергии в том же объеме места и при этом снижают вес.
Высокая плотность энергии литий-ионных аккумуляторов делает их идеальными для мобильных устройств питания.Зарядно-разрядные характеристики
При сравнении свинцово-кислотных аккумуляторов по сравнению с литий-ионными, мы обнаружили, что напряжение свинцово-кислотных аккумуляторов глубокого цикла значительно проседает под нагрузкой и по мере их разряда.
Литий-ионный аккумулятор испытывает гораздо меньшее падение напряжения и сохраняет более высокое напряжение в течение всего цикла разряда. Литиевая батарея в том же приложении RV может обеспечить всю необходимую пиковую мощность и более высокое напряжение независимо от нагрузки.Более высокое напряжение делает их намного лучше для мощных приложений, таких как микроволновая печь или варочная панель.
Литиевые батареитакже не подвержены эффекту Пойкерта, описанному выше. Из-за этого, независимо от того, насколько велика нагрузка на батареи, вы получите энергию, которую вы вложили.
Одним из многих преимуществ литий-ионных аккумуляторов является их способность выдерживать очень высокий зарядный ток. Такая высокая скорость заряда означает гораздо более быстрое время зарядки, чем у свинцово-кислотных аккумуляторов любого типа.Эта более высокая скорость зарядки требует подходящего зарядного устройства, но представьте, что ваши аккумуляторы заряжаются за долю времени, необходимого для свинцово-кислотных аккумуляторов. Это определенная победа!
Зарядные характеристики литий-ионного аккумулятора не так критичны. Вы можете запускать и останавливать зарядку по мере необходимости, не влияя на производительность или срок службы батареи. Эти характеристики заряда означают отсутствие заботы о прохождении длительного цикла поглощения и делают их намного лучше для приложений с частичным зарядом, таких как сбор солнечной энергии и рекуперативное торможение от транспортных средств.
Срок службы
Наконец, литий-ионные аккумуляторы лучше выдерживают глубокий разряд, чем их свинцово-кислотные аналоги. Например, если вы регулярно разряжаете свинцово-кислотную батарею до 50% или около того, эта батарея, вероятно, даст вам около 500-800 циклов, прежде чем ее потребуется заменить. Для сравнения: литий-ионный аккумулятор, разряженный даже до 20%, обеспечивает около 5000 циклов. Таким образом, увеличенный срок службы литий-ионной батареи имеет большое значение.
Минусы литий-ионных батарейГлавный недостаток литий-ионных аккумуляторов, о котором мы часто слышим, — это стоимость.Литий-ионные батареи значительно дороже, чем свинцово-кислотные. Если принять это за чистую монету, ваш выбор между свинцово-кислотными или литий-ионными батареями может показаться очевидным.
, однако, прежде чем принять решение, важно понять увеличенный срок службы и другие положительные моменты, которые в конечном итоге служат для того, чтобы со временем стоимость двух типов аккумуляторов стала более схожей.
Это видео Тома Мортона из Mortons on the Move, инженера-электрика и постоянного путешественника в жилом доме, рассматривает некоторые реальные тесты между свинцово-кислотными и свинцово-кислотными соединениями.литий-ионные батареи Battle Born. Интересно, что он обнаружил, что даже с более высокой первоначальной стоимостью литий-ионных батарей они будут более рентабельными, чем свинцово-кислотные, в течение всего срока их службы.
Истинным недостатком литий-ионных аккумуляторов по сравнению со свинцово-кислотными может быть то, что эти батареи имеют гораздо меньшее распространение, чем свинцово-кислотные.
Например, для применения в доме на колесах очень мало продавцов продают батареи LiFePO4 по сравнению с каждым автомобильным магазином и большим магазином, продающим свинцово-кислотные батареи.К счастью, после того, как вы приобрели литиевые батареи, вам не нужно будет их заменять, как свинцово-кислотные, и они должны служить на протяжении всего срока службы вашего автомобиля (а может быть, даже дольше!).
Хотя литий-ионные аккумуляторы могут выдерживать очень высокий зарядный ток, их необходимо заряжать в соответствии с рекомендациями производителя. Это означает, что вам может потребоваться новое оборудование для правильной зарядки батарей.
Если вы подключите литий-ионные аккумуляторы к традиционному зарядному оборудованию (например, к генератору переменного тока в автомобиле), они могут повредить зарядное устройство.По этой причине очень важно установить правильное зарядное устройство для ваших литий-ионных аккумуляторов.
Свинцово-кислотные и литий-ионные батареи: что лучше?
В битве между свинцово-кислотными и литий-ионными аккумуляторами вопрос о том, какой из них лучше, зависит главным образом от вашего приложения. Например, если вы ищете новую аккумуляторную батарею для запуска двигателя вашего автомобиля, вам следует приобрести свинцово-кислотную аккумуляторную батарею.
Но если вы RVer, который хочет питать несколько устройств и / или бытовой техники в своей установке, и не беспокоиться о том, как вы их используете, или если они умрут, то литий-ионные батареи, скорее всего, заслуживают внимания.
Литий-ионные аккумуляторы — долгожданное дополнение к миру накопителей энергии для тех, кто путешествует, разбивает лагерь или проживает полный рабочий день. Если вы заинтересованы в том, чтобы оставаться комфортно и тепло, сохранять пищу холодной и безопасной, хранить лекарства в холодильнике, работать в дороге или развлекаться, литий-ионные батареи присоединились к битве, и они здесь, чтобы остаться!
Хотите узнать больше об электрических системах и литиевых батареях?
Мы знаем, что строительство или модернизация электрической системы может быть сложной задачей, поэтому мы здесь, чтобы помочь.Наши специалисты по продажам и обслуживанию клиентов из Рино, штат Невада, готовы ответить на ваши вопросы по телефону (855) 292-2831!
Также присоединяйтесь к нам в Facebook, Instagram и YouTube, чтобы узнать больше о том, как системы с литиевыми батареями могут способствовать вашему образу жизни, увидеть, как другие построили свои системы, и обрести уверенность, чтобы выйти и остаться в стороне.
Присоединяйтесь к нашему списку контактов
Подпишитесь сейчас на новости и обновления в свой почтовый ящик.Суперконденсаторы против батарей — База знаний BatteryGuy.com
В суперконденсаторах нет ничего нового. General Electric пробовала использовать их потенциал в 1950-х годах, но сегодня пресса внезапно загорелась рассказами о том, что эта технология навсегда изменит способ хранения энергии. Было даже предположение, что батареи в том виде, в каком мы их знаем, больше никогда не будут прежними.
Волнение действительно кажется заслуженным.У них есть способность перезаряжаться за секунды и в отличие от всех
. Электрические автобусы с питанием от суперконденсаторов используются в Китае почти десять лет.типов батарей, которые зависят от внутренних химических реакций и поэтому изнашиваются, а суперконденсаторы со временем не разрушаются. Это означает, что суперконденсатор на 2,7 В сегодня будет суперконденсатором на 2,7 В через 15 лет. Все остальные современные конструкции аккумуляторов постепенно теряют производительность, а это означает, что ваша 12-вольтовая батарея сегодня может превратиться в 11,4-вольтовую батарею всего за 3 года.
Пожалуй, больше всего привлекает внимание то, что суперконденсаторы можно напечатать на 3D-принтере, что делает их в высшей степени универсальными для любой формы без необходимости создания производственной линии. Не меньшее восхищение вызывает их ультратонкая природа, что означает, что их можно легко интегрировать в одежду и другие ткани.
Так стоит ли готовить учебники истории для батарей? Еще не совсем.
Развитие портативной энергетики не было линейным. Технологический прогресс не всегда продвигал производительность аккумуляторов на каждый уровень.Вот почему, хотя литий-ионный аккумулятор, который питает ваш телефон, появился в 1990-х годах, тот, который запускает ваш автомобиль, скорее всего, все еще свинцово-кислотный и основан на конструкции, которой более 200 лет!
«Новое» обычно означает «лучше» или способов. Литий-ионные батареи хорошо разряжают стабильную энергию в течение длительных периодов времени, но они дороги. Свинцово-кислотные батареи быстро производят большое количество энергии и, что самое главное, дешевы в производстве.
История батареи изобилует техническими достижениями, но на каждом этапе старые химические продукты выживают и продолжают использоваться, потому что, хотя вся новая концепция захватывает заголовки, она никогда не становится лучше каждые способов.
Суперконденсаторы ничем не отличаются… на данный момент. Несмотря на то, что они могут заряжаться быстро, работать намного дольше, сохранять большую мощность и работать при экстремальных температурах, большинство других химикатов просто не могут справиться с ними, они плохо обеспечивают постоянную мощность в течение длительных периодов, как показано на графике ниже.
Суперконденсатор в сравнении с характеристиками заряда и разряда батареи. Батареи поддерживают постоянное напряжение во время разряда, суперконденсаторы — нет — график Tecate GroupС точки зрения накопления энергии существует распространенная путаница. В то время как суперконденсатор того же веса, что и батарея, может удерживать большую мощность, его мощность в ваттах / кг — Power Density до десяти раз лучше, чем у литий-ионных батарей. Его неспособность к медленному разряду означает, что его Плотность энергии (Ватт-час / кг или Втч / кг) является частью той, что предлагается литий-ионным аккумулятором.
Плотность мощности и плотность энергии суперконденсаторов по сравнению с другими формами хранения — Изображение: Tecate GroupОни также довольно плохо удерживают свой заряд, саморазряжаясь до половины своей емкости в течение 40 дней, когда не используются, — это не та характеристика, которую вы хотите под капотом вашего автомобиля или в вашей дымовой пожарной сигнализации.
Наконец, суперконденсаторная ячейка имеет напряжение около 2,5 по сравнению с напряжением 3,6 иона лития. Вы можете начать соединять их вместе, но сама схема становится причиной внутреннего сопротивления, которое может уменьшить преимущества суперконденсатора.
Короче говоря, все еще остается желать лучшего для тех, кто хочет полностью заменить все батареи на суперконденсаторы.
Так к чему весь такой ажиотаж?
Так же, как литий-ионный аккумулятор сделал возможными мобильные телефоны, но не заменил аккумуляторы легковых и грузовых автомобилей, суперконденсатор определенно играет роль в портативных источниках энергии.
Китай уже использует их в некоторых гибридных автобусах с 2006 года. Когда автобус тормозит, останавливаясь и забирая пассажиров, энергия, генерируемая тормозами, передается на суперконденсаторы.Он хранится там, пока пассажиры садятся на борт, а затем обеспечивает готовый источник ускорения при трогании с места.
Это означает, что автобусу требуется меньше литий-ионных батарей (в некоторых случаях вообще не требуется), что делает его легче и позволяет проехать дальше на одной зарядке. Дэн Йе, исполнительный директор Sinautec, совместного предприятия в США и Китая, производящего автобусы только с суперконденсаторами, утверждает, что автомобили могут идти на 40% дальше, чем стандартные электрические автобусы, и на 40% дешевле в производстве.
Но когда дело касается автомобилей, нужно проявлять осторожность.Автобусы постоянно останавливаются и трогаются с места, поэтому существует гарантированный постоянный источник энергии, перемещающийся от тормозов к суперконденсаторам. Они также следуют обычному маршруту, где могут быть размещены резервные зарядные станции, если при торможении суперконденсаторы недостаточно заряжены.
Джо Шиндалл — профессор электротехники и информатики Массачусетского технологического института. Он отмечает, что из-за этих проблем суперконденсаторы «плохо подходят для электромобилей».
Суперконденсаторы в смартфонах и ноутбуках?
В настоящее время это маловероятно, потому что, хотя способность перезаряжаться в течение нескольких секунд заставляет многих пускать слюни с нетерпением, суперконденсаторы не сохраняют стабильное напряжение или емкость при разряде.Это именно то, что нужно смартфонам и ноутбукам для работы в течение длительного времени, поэтому кажется, что литий-ионные батареи пока не сойдутся с места.
Когда дело доходит до полной замены батарей другого химического состава, суперконденсатор пока этого не сделает.
Вместо этого они стремятся присоединиться к аккумуляторным батареям в мире портативных источников энергии и предлагают улучшения в некоторых областях, но ничего близкого к полной замене, похоже, не подразумевают многие заголовки.
Последняя битва
В общем, суперконденсаторы подходят для приложений, требующих возможности быстрой зарядки и разрядки, где это время измеряется в секундах или нескольких минутах.Для всего, что требует более длительного времени, батареи остаются лучшим решением.
| Характеристика | Суперконденсаторы | Литий-ионные батареи |
|---|---|---|
| Вт / кг (удельная мощность) | 5 | до 240 |
| Втч / кг (удельная энергия) | до 10 000 | до 3000 |
| Время заряда (элемента) | секунд | минут |
| Напряжение элемента | г.2,5 | 3,6 |
| Срок службы | 1 миллион + | до 3000 |
| Диапазон рабочих температур | Нагнетание: от –40 до 65 ° C (от –40 до 149 ° F) Перезарядка: от –40 до 65 ° C (от –40 до 149 ° F) | Разрядка: от –20 до 60 ° C (от –4 до 140 ° F) Перезарядка: от 0 до 45 ° C (от 32 ° до 113 ° F) |
| Саморазряд | 50% в месяц | до 3% в месяц |
Дополнительная литература и источники:
Гибридный суперконденсаторобеспечивает плотность энергии свинцово-кислотных аккумуляторов (видео)
Потребность в увеличении запаса хода электромобилей и сокращении времени зарядки привела к огромному количеству исследований в области улучшения химического состава аккумуляторов.
Но зачем останавливаться на хлам, идущем в батарею? Почему бы не поменять сам аккумулятор?
Ученые из Калифорнийского института наносистем при Калифорнийском университете в Лос-Анджелесе говорят, что они разработали гибридное устройство, которое выходит за рамки простых изменений в химии клеток.
ПРОВЕРКА: Volvo разрабатывает структурные суперконденсаторные нанобатареи для будущих электромобилей (октябрь 2013 г.)
Экспериментальное устройство сочетает в себе плотность энергии свинцово-кислотной батареи с быстрой зарядкой и разрядкой суперконденсатора.
Согласно исследованию, опубликованному в журнале Proceedings Национальной академии наук (через Gizmag ), он в шесть раз более энергоемкий, чем средний коммерческий суперконденсатор.
Эта комбинация качеств имеет большое потенциальное влияние на электромобили. Теоретически он может предложить более компактный накопитель энергии и более быструю зарядку без ущерба для дальности действия.
Гибридный суперконденсатор, разработанный UCLA
Исследователи утверждают, что тестируемая версия может удерживать в два раза больше заряда, чем типичная тонкопленочная литиевая батарея, но на поверхности в пятую часть толщины листа бумаги.
Сообщается, что эта производительность была достигнута за счет увеличения площади контакта между электролитом и двумя электродами.
Эти электроды изготовлены из диоксида марганца, но имеют трехмерную структуру графена с лазерной разметкой (LSG).
СМОТРИТЕ ТАКЖЕ: Генеральный директор Tesla: Суперконденсаторы Trump Electric Car Batteries. (Мар 2011)
Структура графена обладает высокой проводимостью и имеет большую площадь поверхности, чем предыдущие конструкции.
Суперконденсаторыобычно устанавливаются друг на друга и упаковываются как единое целое, но исследователи решили воспользоваться тонким дизайном своего устройства и попробовать что-то другое.
Тестовая версия прикреплена к солнечной батарее, поглощая энергию от своего элемента в течение дня и разряжая ее ночью, чтобы зажечь светодиод.
Структура гибридного суперконденсатора, разработанного UCLA
Помимо плотности энергии и способности к быстрой зарядке, исследователи полагают, что компактность того, что они называют «микросуперконденсатором», также может быть важным преимуществом.
Среди возможных применений они видят его использование в повязках для высвобождения доз лекарств.
ПОДРОБНЕЕ: спасут ли ультраконденсаторы системы Start-Stop от потребительского гнева? (Сен 2014)
Все свойства устройства могут быть полезны и в электромобилях, но пока это чисто теоретически.
Как и в случае со всеми экспериментальными технологиями, важно отметить, что многообещающие лабораторные результаты не всегда означают коммерческую жизнеспособность.
Тем не менее, в поисках решения проблем с запасом хода и зарядкой электромобиля, вероятно, стоит обратить внимание не только на аккумулятор.
[кончик шляпы: Хью Кроуфорд]
_______________________________________________
Подпишитесь на GreenCarReports в Facebook, Twitter и Google+.
Журнал энергетики и энергетических технологий
Открытый доступ Оригинальное исследованиеХиронори Такаги, Коичи Какимото, Дайсуке Мори, Соу Таминато, Ясуо Такеда, Осаму Ямамото * , Нобуюки Иманиши
Высшая школа инженерии, Университет Миэ, Цу, Миэ, 514-8507, Япония
* Для корреспонденции: Осаму Ямамото
Академический редактор: Ахамед Иршад
Специальный выпуск: Батареи: прошлое, настоящее и будущее
Поступила: 12.01.2021 | Одобрена в печать: 12 февраля 2021 г. | Опубликован: 24 февраля 2021 г.
Журнал энергетики и энергетических технологий 2021 , том 3, выпуск 1, DOI: 10.21926 / jept.2101010
Рекомендуемое цитирование: Takagi H, Kakimoto K, Mori D, Taminato S, Takeda Y, Yamamoto O, Imanishi N. Перезаряжаемые водно-литиевые батареи высокой плотности энергии с водной гидрохинон-сульфоновой кислотой и катодом с окислительно-восстановительной парой бензохинон-сульфоновой кислоты. Журнал энергетики и энергетических технологий 2021 ; 3 (1): 13; DOI: 10.21926 / jept.2101010.
© 2021 Авторы. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons by Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе или любом формате при условии правильного цитирования оригинальной работы.
АбстракцияДля электромобилей возрос спрос на перезаряжаемые батареи с высокой плотностью энергии помимо литий-ионных. В настоящем исследовании была предложена новая водно-литиевая аккумуляторная батарея с высокой плотностью энергии. Батарея состояла из литий-металлического анода, литий-стабильного неводного электролита, водостойкого литий-ионного проводящего твердого электролита из Li 1,4 Al 0,4 Ge 0.2 Ti 1,4 (PO 4 ) 3 -эпокси-TiO 2 сепаратор и окислительно-восстановительная пара гидрохинонсульфоновая кислота (HQS) / бензохинонсульфоновая кислота (BQS) в водном растворе уксусной кислоты (HAc) . Было зарегистрировано напряжение холостого хода 3,7 В при 25 ° C, и теоретическая плотность энергии батареи, основанная на реакции 2Li + BQS + 2H 2 O = 2 LiOH + HQS, составила 833 Вт · ч · кг -1 , примерно в два раза выше, чем у литий-ионного аккумулятора. Батарея была успешно перезагружена до 0.5 мА см -2 и 25 ° C с низкой поляризацией.
Ключевые словаАккумулятор с высокой плотностью энергии; водно-литиевая батарея; литий-металлический электрод; бензохинонсульфоновая кислота; твердый электролит
1. ВведениеЛитиевый анод — лучший кандидат для батареи с высокой плотностью энергии из-за его высокой теоретической удельной емкости 3860 мАч -1 и самого высокого потенциала электрохимического восстановления -3.04 В по сравнению с обычным водородным электродом (NHE). Литий бурно реагирует с водой; поэтому водный электролит никогда не используется, а неводные электролиты были в основном разработаны для батарей с литиевыми анодами [ 1 , 2 ]. В 2004 году Visco et al. [ 3 , 4 ] предложили уникальную водную литий-воздушную батарею , которая состояла из металлического литиевого анода, водостабильного литий-ионного проводящего твердого электролитного сепаратора, водного электролита и воздушного электрода.Сепаратор электролита типа NASICON Li 1 + x Al x Ti 2-x (PO 4 ) 3 (LATP) предотвращал прямой контакт между анодом из металлического лития и водным раствором электролита. Ожидалось, что водная литий-воздушная батарея обеспечит высокую удельную мощность и будет работать в воздушной атмосфере [ 5 ].
В основном, в литературе было предложено два типа водно-литиевых батарей; один с водным электролитом и водостойкими электродами с интеркаляцией лития [ 6 ], а другой с водостабильным сепаратором твердого электролита [ 3 ].Бывшая водно-литиевая батарея демонстрирует высокую удельную мощность; однако удельная плотность энергии ниже, чем у обычных литий-ионных батарей [ 7 ]. В настоящее время предложены различные водно-литиевые батареи с сепараторами твердого электролита. Чжоу и его сотрудники сообщили о прототипе водно-литиевой батареи с сепаратором твердого электролита [ 8 ]. Этот элемент был собран с использованием 1 M LiClO 4 в этиленкарбонате и диметилкарбонате в качестве электролита для Li-анода и водного раствора, содержащего 1 M LiOH и 1 M KOH в качестве электролитов для катода Ni (OH) 2 .Два электролита были разделены LATP. Плотность энергии этой ячейки была рассчитана как 857 Вт · ч · кг -1 на основе веса активных материалов электродов. Точно так же ячейка, состоящая из литиевого анода с жидким электролитом и водорастворимым Fe (CN) 6 3- / Fe (CN) 6 4- катод с окислительно-восстановительной парой, разделенный LATP, был предложен Гуденафом. и другие. [ 9 ]. Теоретическая удельная плотность энергии этой окислительно-восстановительной пары составила 392 Вт · ч -1 , Вт · ч, что сопоставимо с удельной энергией обычных литий-ионных батарей, хотя ожидалось более высокое значение удельной мощности.Wu et al. сообщили о Li / гель-полимерном электролите / LATP / водном электролите / LiMn 2 O 4 элементе [ 10 ]. Удельная плотность энергии элемента Li / LiMn 2 O 4 , основанная на массе электродов, была оценена как 446 Вт · ч · кг -1 . Иманиши и его сотрудники [ 11 , 12 , 13 ] предложили водно-литиевую батарею с более высокой удельной плотностью энергии, которая состояла из литиевого анода с жидким электролитом, водного MCl 2 (M = Co, Ni , Sn) раствор католита и Li 1.4 Al 0,4 Ge 0,2 Ti 1,4 (PO 4 ) 3 (LAGTP) сепаратор. Теоретическая удельная плотность энергии элемента Li / NiCl 2 составляла 1047 Вт · ч -1 , исходя из веса лития и NiCl 2 , и была по крайней мере вдвое больше, чем у обычной литий-ионной батареи. Расчетная удельная плотность энергии, рассчитанная с использованием массы компонентов ячейки с сепаратором LAGTP толщиной 0,1 мм (кроме упаковки), составила 670 Вт · ч -1 .Более того, в литературе показано, что батарея с жидким католитом может быть разработана в крупномасштабную батарею без ухудшения характеристик элемента из-за высокой диффузии активного материала в католите [ 13 ].
В этом исследовании мы разработали новую водно-литиевую перезаряжаемую батарею с водорастворимым католитом органической окислительно-восстановительной пары 1,2-гидрохинон-3-сульфоновой кислоты (HQS) и 1,2-бензохинон-3-сульфоновой кислоты (BQS). ) и анод из металлического лития.Feng et al. [ 14 ] сообщили об органическом катоде, состоящем из диангидрида 3,4,9,10-перилентетракарбоновой кислоты в органическом растворителе, но растворимость этого соединения в воде была очень низкой. Кроме того, католит и анод из металлического лития были разделены LAGTP. Пара бензохинон-гидрохинон является прототипом органической окислительно-восстановительной системы, и их электрохимическое поведение активно изучается в течение последних многих лет [ 15 , 16 , 17 ].Однако растворимость бензохинона в воде не очень высока. Нараянан и др. [ 18 , 19 , 20 ] сообщили о водной проточной батарее на основе водорастворимой органической окислительно-восстановительной пары 1,2-бензохинон-3,5-дисульфоновой кислоты на катоде и антрахинон-2-сульфоновой кислоты. на аноде. В качестве католита использовали водорастворимый водный раствор BQS / HQS. Реакция ячеек батареи была следующей;
2 \ rm {Li} \ + \ BQS \ + \ 2H_2O \ = \ 2 \ LiOH \ + \ HQS
Напряжение холостого хода (OCV) ячейки было около 3.7 В при 25 ° C. Теоретическая удельная плотность энергии на основе масс литиевого анода H 2 O и BQS с OCV 3,7 В составила 833 Вт · ч · кг -1 . Хиноны сравнительно дешевле (~ 5-10 кг -1 ) [ 18 ]; следовательно, они очень подходят и привлекательны для крупногабаритных аккумуляторов для электромобилей и различных приложений хранения электроэнергии.
2. ЭкспериментальныйHQS получали ионным обменом 1,2-гидрохинон-3-сульфоновой калиевой соли (HQSK, Alfa Aesar) с использованием ионообменной смолы Amerlyst 15 DRY (Kurita Water, Япония).Поскольку LAGTP нужно было разложить в сильнокислом растворе [ 21 ], pH католита был доведен до pH 2. Водные растворы 0,8 M HQS в 5,5 M HAc и 2 M LiCl, 0,015 MH 2 SO 4 и 10 м хлорида 1-бутил-3-метилимидазолия (IBMmCl) с 1,0 M HCl (Sigma-Aldrich), все при pH 2,0, были исследованы в качестве католита. 2 M LiCl был добавлен к 5,5 M HAc для увеличения проводимости электролита. Электрохимические характеристики окислительно-восстановительной реакции HQS / BQS изучали с использованием лабораторного стакана с рабочим электродом, состоящим из смеси углеродного электрода, содержащего Pt (Pt-C) (Tanaka Kikinzoku, Япония) и политетрафторэтилена (PTFE) (Daikin Japan). ) (Массовое соотношение 8: 2), противоэлектрод из Pt и Ag / AgCl в электроде сравнения с насыщенным KCl.Катодную смесь прессовали на титановую сетку (Nikara, Япония).
Принципиальная схема полной испытательной ячейки Swagelok собственного производства показана на рисунке 1. Ячейка состояла из металлического литиевого анода толщиной 200 мкм (Honjometal, Япония), Li (CF 3 SO 2 ) 2 N (LiFSI), растворенный в диметиловом эфире тетра (этилен) гликоля (G4) (мольное соотношение 2: 1) и 1,3-диоксолане (DOL, 50 об.%) В качестве анодного электролита, прибл. LAGTP-эпокси-10 мас.% TiO 2 толщиной 200 мкм в качестве сепаратора твердого электролита, водный раствор 0.8M HQS в 5,5 M HAc и 2 M LiCl в качестве католита, а также в смеси Pt-C и PTFE в качестве катода. Сообщалось, что анодный электролит LiFSI-2G4-50 об.% DOL подавляет образование дендритов лития при высокой плотности тока [ 22 ]. Пленки LAGTP-эпокси-TiO 2 были приготовлены с использованием ранее описанного метода литья на ленту [ 23 ]. Тонкодисперсный порошок LAGTP получали золь-гель методом с использованием лимонной кислоты [ 24 ]. Вкратце, стехиометрические количества Ti (OC 2 H 5 ) 4 и Ge (OC 2 O 5 ) 4 (Sigma Aldrich) растворяли в этиленгликоле, добавляли до 0.2 М водный раствор лимонной кислоты, и раствор хорошо перемешивали. После образования геля к гелю добавляли стехиометрические количества LiNO 3 , Al (NO 3 ) 3.9h3O и NH 4 H 2 PO 4 (Nakalai Tesque, Япония). Гель выдерживали при 220 ° C в течение нескольких часов, а затем нагревали при 580 ° C в течение 4 часов. Затем гель измельчали и снова нагревали при 800 ° C в течение 4 часов. Смесь LAGTP, мелкодисперсного порошка TiO 2 (Kojundo Chemicals Japan, размер частиц 2 мкм), рыбьего жира Menhaden (Sigma Aldrich), Burver @ B-98 (Sigma Aldrich) и бензилбутилфталата (Wako Chemicals , Япония) измельчали в шаровой мельнице с пленочной мельницей (Fritsch, Mode 7).Полученную суспензию наносили изолентой на покрытую силиконом полиэтиленовую подложку с использованием устройства с двумя ракельными ножами. Лист, отлитый из зеленой ленты, осторожно сушили при 4 ° C с последующим нагревом при 500 ° C для удаления органических добавок и, наконец, спекали при 950 ° C. Пленки LAGTP-эпокси-TiO 2 получали погружением пленки LAGTP-TiO 2 в раствор тетрагидрофурана, содержащий 0,05 M 1,3-фенилендиамин (Sigma-Aldrich) и 2,2-бис (4-глицидилокси). -фенил) пропан (Sigma-Aldrich) с последующей реакцией полимеризации при 170 ° C в течение 24 часов [ 25 ].Количество эпоксидной смолы в пленке LAGTP-TiO 2 , оцененное по изменению веса, составляло около 2 мас.%. Наконец, смесь пористого углерода, содержащего Pt (Tanaka Kikinzoku, Япония) и политетрафторэтилена (PTFE), прессовали на титановую сетку (Nikara, Япония).
Рисунок 1 Схема испытательной ячейки.
Измерения импеданса проводились с использованием частотного анализатора (Solatron 1260) в диапазоне частот от 0,1 Гц до 1 МГц при напряжении смещения 10 мВ.Объемная проводимость и проводимость границ зерен образцов оценивалась из графиков комплексного импеданса с использованием программного обеспечения Zview 2. Электрохимические измерения проводили с использованием многоканального потенциогальваностата (Bio-Logic Science Instrument VMPX).
3. Результаты и обсуждениеСтабильность твердого электролита в водном католите является важным требованием к сепаратору в водно-литиевых батареях. Стабильность LATP в водных электролитах была исследована Иманиши с соавторами [ 21 , 26 , 27 , 28 ]. Они обнаружили, что LATP нестабилен в сильных кислотных и щелочных водных растворах, а литий-ионная проводимость LATP значительно снижалась при его погружении в эти растворы. Мы исследовали изменение импеданса ленточных литых пленок LAGTP-эпокси-TiO 2 в водном растворе 0,8 M HQS в 5,5 M HAc и 2M LiCl (pH = 2,0). Профили импеданса Au / LAGTP-эпокси-TiO 2 / Au в зависимости от периода погружения на рис. 2 (а) показали, что начальная общая проводимость пленки составляла 3.7×10 -4 Scm -1 при 25 ° C. Объемная проводимость не изменялась в течение двух недель, но проводимость границ зерен уменьшалась. Общая проводимость электролита через две недели составила 1,5 × 10 -4 Scm -1 , после чего не последовало дальнейшего значительного изменения общей проводимости. Картины XRD пленки LAGTP-эпокси-TiO 2 до и после погружения в 0,8 M HQS в 5,5 M HAc и 2M LiCl (pH = 2,0) на две недели также не показали значительных изменений.Другое требование к сепаратору твердого электролита для водно-литиевого элемента — непроницаемость для воды. Тест на водопроницаемость проводился с использованием ячейки H-типа, в которой одна камера была заполнена чистой водой, а другая — 1М водным раствором LiCl [ 25 ]. Скорость водопроницаемости определялась по содержанию Cl — в камере с водой. Пленка LAGTP-TiO 2 без эпоксидной смолы имела высокую литий-ионную проводимость 8.9×10 -4 Scm -1 , но проявила проницаемость для воды через пленку, в то время как вода не диффундировала через пленку LAGTP-эпокси-TiO 2 в течение одной недели. Таким образом, пленка LAGTP-эпокси-TiO 2 была приемлемой и рекомендована в качестве сепаратора в предлагаемых водно-литиевых батареях.
Рис. 2 (a) Профили импеданса LAGTP эпокси-TiO 2 , погруженного в водный раствор 0,8 M HQS в 5,5 M HAc и 2 M LiCl при pH 2.0 и 25 ° C как функция времени (b) Результаты испытаний на водопроницаемость для LAGTP-TiO 2 и LAGTP-эпокси-TiO 2 .
На рисунке 3 показаны циклические вольтамперограммы (CV) для Pt-C-электрода водного раствора 0,8 M HQS в 5,5 M HAc и 2 M LiCl, водного раствора 15 мМ H 2 SO 4 и 10 мкМ. IBMmCl с 1,0 M водным раствором HCl (IBMmCl-HCl) при 25 ° C, где HQS окисляли до BQS при 0,5 мА · см -2 в течение 20 часов. Имидазол, поддерживающий электролит ИБМ-1.Было обнаружено, что 0 M HCl подавляет реакцию присоединения бензохинона по Михаэлю к воде [ 29 ]. Кривая CV для раствора 15 мМ H 2 SO 4 была аналогична кривой для 1 мМ 1,2-бензохинон-3,5-дисульфоновой кислоты (BQDS) в растворе 1 MH 2 SO 4 [ 17 ]. Пиковый потенциал 1,15 В относительно NHE был сравним с 1,13 В относительно NHE, наблюдаемый в случае 1 мМ BQDS в 1 MH 2 SO 4 растворе [ 18 ], соответствующем окислительно-восстановительной реакции HQDS / BQDS. .Потенциалы реакции выделения водорода и выделения кислорода при pH 2,0 без перенапряжения составляли -0,118 В относительно NHE и 1,111 В относительно NHE, соответственно. Реакции выделения кислорода и водорода наблюдались при примерно 1,5 В относительно NHE и 0,0 В относительно NHE, соответственно, в 15 мМ H 2 SO 4 . CV для 5,5 M HAc и 2M LiCl и 10 м IBMmCl с 1,0 M HCl указывал на инициирование реакции окисления HQS при примерно 0,7 В относительно NHE, хотя четкого пика реакции окисления не наблюдалось.Результаты CV для HQS в 15 мМ H 2 SO 4 подтвердили, что окислительно-восстановительная реакция HQS / BQS протекает по двухэлектронной реакции BQS + 2H + + 2e = HQS, как сообщалось ранее для гидрохинон-бензохинона. окислительно-восстановительная система в водном растворе [ 30 ]. Wu et al. наблюдали реакцию электрохимического окисления HAc в водном растворе 0,5 MH 2 SO 4 при 1,14 В по сравнению с NHE для Pt 60 Ru 10 Sn 30 электрода с высоким содержанием Sn [ 31 ], а Sine et al.предположил, что электрод с низким содержанием Sn в Pt 80 Ru 10 Sn 10 не показал окисления HAc в 1 M HClO 3- 0,1 M водном растворе HAc [ 32 ]. Результаты, показанные в настоящем исследовании, согласуются с данными вышеупомянутых исследований и не показывают четкого пика окисления HAc.
Рисунок 3 Циклические вольтамперограммы Pt-C-электрода для 0,8 M HQS в 5,5 M HAc и 2 M LiCl (HAc), 15 мМ H 2 SO 4 (H 2 SO 4 ), и 10 м IBMmCl-1.Водные растворы 0 M HCl (IBMmCl-HCl) при 25 ° C. Скорость сканирования составляла 5 мВ · с -1 .
Кинетику окислительно-восстановительной реакции HQS / BQS на Pt-C-электродах исследовали в водных растворах с pH 2,0 при 25 ° C. Кривые перенапряжения (η) от плотности тока (j) для 0,8 M HQS в 5,5 M HAc-2 M LiCl (HAc), 15 мМ H 2 SO 4 (H 2 SO 4 ), и 10 м водные растворы IBMmCl-1.0 M HCl (IBMmCl-HCl) показаны на рисунке 4, где перенапряжения восстановления BQS были измерены после того, как окислилось около 20% HQS, и перенапряжения были записаны после поляризации в течение 10 мин на каждом этапе. плотность тока.Результаты показали, что перенапряжение окисления HQS было низким в католите, тогда как перенапряжение восстановления BQS было выше, чем перенапряжение окисления, и зависело от католита. При низкой плотности тока наименьшее перенапряжение наблюдалось в 0,8 M HQS, взятом в 5,5 M HAc-2 M LiCl (HAc), но при высокой плотности тока наблюдалось обратное, и перенапряжения исследуемого католита были выше, чем другой католит. Изменение напряжения ячейки с кривыми периода поляризации показано на рисунке 5.Ячейки сначала заряжали при 0,5 мА · см -2 на 10 мА · ч, а затем разряжали при 0,5 мА · см -2 . В этот момент около 80% BQS было восстановлено до HQS с перенапряжением 0,5 В. Перенапряжения плоского разряда около 0,15 В при 0,5 мА · см -2 наблюдались в 15 мМ H 2 SO 4 и 5,5. M HAc-2 M LiCl.
Рисунок 4 Кривые зависимости перенапряжения (η) от плотности тока (j) для окисления HQS и восстановления BQS на Pt-C электроде в 0.8 M HQS в 5,5 M HAc-2 M LiCl (HAc), 15 мМ H 2 SO 4 (H 2 SO 4 ) и 10 м IBMmCl-1,0 M HCl (IBMmCl-HCl) при 25 ° С.
Рисунок 5 Кривые зависимости потенциала электрода от емкости для окисления HQS и восстановления BQS на Pt-C электроде в 0,8 M HQS в 5,5 M HAc-2 M LiCl (HAc), 15 мМ H 2 SO 4 ( H 2 SO 4 ) и 10 м IBMmCl-1.0 M HCl (IBMmCl-HCl) при 25 ° C.
Также были исследованы полные характеристики электролизера анода из металлического лития и катода с окислительно-восстановительной парой BQS / HQS.Li / (LiFSI-2G) -50 об.% DOL / LAGTP-эпокси-TiO 2 / 0,8 M BQS в 5,5 M водном растворе HAc-2 M LiCl / ячейке Pt-C испытывали при 25 ° C. OCV составляло 3,7 В, что было немного ниже, чем значение 3,92 В, оцененное на основе потенциала восстановления BQS в 1 M H 2 SO 4 , о котором сообщалось в литературе [ 17 ]. Низкий OCV может быть связан с высоким pH католита, потенциалом соединения между LAGTP-эпокси-TiO 2 и водным католитом и анодным электролитом, а также низкой литий-ионной активностью в Li / анодном электролите.Профиль импеданса полной ячейки при 25 ° C показан на рисунке 6. Результат показал два полукруга; один в высокочастотном диапазоне от 1 МГц до 25 кГц соответствует вкладу межзеренной литий-ионной проводимости в LAGTP-эпокси-TiO 2 , а другой в низкочастотном диапазоне 25 кГц и 0,1 кГц приписывается вклад сопротивления переносу заряда [ 33 ]. Пересечение высокочастотного полукруга с действительной осью на высокой частоте является суммой объемного сопротивления LAGTP-эпокси-TiO 2 и сопротивлений буферного электролита и католита.Отношение этих сопротивлений электролита к общему сопротивлению ячейки составляло около 0,5. В данном исследовании использовались анодный электролит толщиной 1 мм и сепаратор ЛАГТП-эпоксид-TiO 2 толщиной 0,2 мм. Сопротивление электролита можно снизить за счет уменьшения толщины этих электролитов. На рисунке 7 показана кривая зависимости перенапряжения заряда и разряда от плотности тока для Li / (LiFSI-2G) -50 об.% DOL / LAGTP-эпокси-TiO 2 / 0,8 M HQS-5,5 M HAc-2 M LiCl водного элемента. , где ячейка была предварительно заряжена на 0.5 мА · см -2 на 50 ч (20% от полной зарядки). Перенапряжение заряда немного увеличилось с увеличением плотности тока, в то время как перенапряжение разряда значительно увеличилось. При 2 мА · см -2 перенапряжение при передаче туда и обратно составило 1,2 В, что соответствует потере энергии 33%.
Рисунок 6 Профиль импеданса Li / (LiFSI-2G) -50 об.% DOL / LAGTP-эпокси-TiO 2 / 0,8 M HQS-5,5 M Водный раствор HAc-2 M LiCl / ячейка Pt-C при 25 ° C.
Рисунок 7 Кривые зависимости перенапряжения (η) от плотности тока (j) для Li / (LiFSI-2G) -50 об.% DOL / LAGTP-эпоксид-TiO 2 / 0,8 M HQS-5,5 M HAc-2 M Водный раствор LiCl / ячейка Pt-C при 25 ° C.
Циклические характеристики Li / (LiFSI-2G) -50 об.% DOL / LAGTP-эпокси-TiO 2 / 0,8 M HQS-5,5 M Водный раствор HAc-2M LiCl / элемент Pt-C при 0,5 мА · см -2 на 1 час разряда, 1 час отдыха и затем 1 час заряда при 25 ° C, как показано на рисунке 8.Перенапряжение в обоих направлениях составило 0,4 В, что соответствует 12% потерям энергии. Напряжение разряда немного уменьшалось с каждым циклом. Профили глубокого заряда и разряда при 0,5 мА · см -2 показаны на рисунке 9. Напряжение отсечки для заряда и разряда составляло 4,5 В и 2,5 В соответственно, а масса заряженного HQS составляла 0,189 г (65 мАч. ). Наблюдаемые зарядная и разрядная емкости составляли 49,6 и 26,5 мАч соответственно, что соответствовало 76% и 41% полезности активного материала в католите, соответственно.Потенциальное плато для реакции выделения водорода наблюдалось при около 2,2 В. Расчетная плотность энергии предлагаемой ячейки Li / HQSK составляла 358 Вт · ч · кг -1 , исходя из масс Li, H 2 O и BQS и 41 % использования BQS с рабочим напряжением 3,4 В. Расчетная плотность энергии предложенной водно-литиевой батареи нового типа была сопоставима с удельной энергией традиционной литий-ионной батареи. Расчетная удельная плотность энергии элемента обычно зависит от удельной емкости поверхности [ 34 ], а характеристики элемента твердого активного материала, такого как LiCoO 2 в литий-ионных батареях, зависят от толщины электрода [ 35 ].Однако, как сообщается в литературе [ 11 ], рабочие характеристики элемента с жидким католитом не показывают значительной зависимости от удельной емкости площади. Следовательно, предлагаемая батарея Li / BQS с жидким католитом может обеспечить высокую плотность энергии при большой емкости.
Рисунок 8 Циклические характеристики Li / (LiFSI-2G) -50 об.% DOL / LAGTP-эпокси-TiO 2 / 0,8 M HQS-5,5 M Водный раствор HAc-2 M LiCl / Pt-C ячейки при 0,5 мА · см -2 и 25 ° C.
Рисунок 9 Кривые заряда и разряда Li / (LiFSI-2G) -50 об.% DOL / LAGTP-эпокси-TiO 2 / 0,8 M HQS-5,5 M HAc-2 M водный раствор LiCl / Pt-C ячейка 0,5 мА · см -2 и 25 ° C.
4. ЗаключениеПредлагаемая новая водно-литиевая батарея с водорастворимым и менее дорогим органическим католитом показала более высокую теоретическую удельную плотность энергии, чем обычные литий-ионные батареи. Ячейка показала хорошие результаты при 0.5 мА · см -2 и 25 ° C, и после 37 циклов не наблюдалось значительного разложения. Батарея с водным католитом могла заряжаться и разряжаться с высокой удельной емкостью, а стоимость катодных активных материалов была ниже, чем у обычных литий-ионных батарей. Таким образом, предлагаемая новая батарея имеет потенциальное применение для аккумуляторов большой емкости для электромобилей и систем хранения электроэнергии.
Вклад авторовHT приготовил тонкие пленки твердого электролита, выполнил электрохимические измерения и установил полную ячейку.KK приготовил мелкодисперсный порошок LAGTP. DM, S T, YT и OY поддерживали и давали советы по каждой экспериментальной работе. NI руководил направлением исследований и предоставлял инструкции и возможности для обсуждения между всеми авторами
ФинансированиеЭта работа была поддержана Программой передачи адаптируемых и бесшовных технологий JST через Целевые исследования и разработки (A-STEP) Номер гранта JPMJTM120EP.
Конкурирующие интересыАвторы заявили об отсутствии конкурирующих интересов.
Список литературы- Whittinham MS. Литиевые батареи и катодные материалы. Chem Rev.2004; 104: 4271-4302. [CrossRef]
- Брюс П.Г., Фрейнбергер С.А., Хардвик Л.Дж., Тараскон Дж. М.. Li-O 2 и Li-S батареи с высоким накопителем энергии.Nat Mater. 2012; 11: 19-29. [CrossRef]
- Visco SJ, Nimon E, Katz B, De Johne LC, Chu MY. Литий-металлические водные батареи. Материалы 12-го Международного совещания по литиевым батареям; 2004 г. 27 июня — 2 июля; Нара, Япония. Амстердам: Эльзевир.
- Visco SJ, Нимон Ю.С.Активные металлические / водные электрохимические ячейки и системы. Заявка на патент США; 2007; US7645543B2.
- Иманиши Н., Ямамото О. Перспективы и проблемы аккумуляторных литий-воздушных батарей. Mater Today Adv. 2019; 4: 100031. [CrossRef]
- Ли В., Дан-младший, Уэйнрайт Д.С.Перезаряжаемые литиевые батареи с водными электролитами. Наука. 1994; 264: 1115-1118. [CrossRef]
- Kim H, Hong J, Park KY, Kim H, Kim SW, Kang K. Водные перезаряжаемые ионно-литиевые и натриевые батареи. Chem Rev.2014; 114: 11788-11827. [CrossRef]
- Ли Х, Ван И, На Х, Лю Х, Чжоу Х.Перезаряжаемая Ni-Li батарея интегрированная водно-неводная система. J Am Chem Soc. 2009; 131: 15098-15099. [CrossRef]
- Лу Й., Гуденаф Дж. Б., Ким Ю. Водный катод для щелочно-ионных батарей нового поколения. J Am Chem Soc. 2011; 133: 5756-5759. [CrossRef]
- Ван X, Хоу Y, Чжу Y, Wu Y, Holze R.Перезаряжаемая литиевая батарея на водной основе, использующая металлический литий с покрытием в качестве анода. Sci Rep.2013; 3: 1401. [CrossRef]
- Морита Ю., Ватанабе С., Чжан П., Ван Х., Мори Д., Мацуда Ю. и др. Перезаряжаемые водные литий-металл-хлоридные аккумуляторные батареи с высокой удельной энергоемкостью. J Electrochem Soc. 2017; 164: A1958. [CrossRef]
- Морита Ю., Ватанабе С., Мори Д., Такеда Ю., Ямамото О, Иманиши Н.Перезаряжаемые литий-никелевые хлоридные батареи на водной основе с высокой плотностью энергии. САУ Омега. 2018; 3: 5558-5562. [CrossRef]
- Ватанабе С., Мори Д., Таминато С., Мацуда Ю., Ямамото О., Такеда Ю. и др. Водно-литиевая аккумуляторная батарея с водным катодом из хлорида олова (II) и водостабильным литий-ионным проводящим твердым электролитом. J Electrochem Soc. 2019; 166: A539.[CrossRef]
- Фэй Х, Лю И, Ань И, Сюй Х, Цзэн Дж, Тянь И и др. Стабильный полностью твердотельный калиевый аккумулятор, работающий при комнатной температуре, с композитным полимерным электролитом и экологически безопасным органическим катодом. J Источники энергии. 2018; 399: 294-298. [CrossRef]
- Fieser LF.Таутомерия гидроксихинонов. J Am Chem Soc. 1928; 50: 439-465. [CrossRef]
- Guin PS, Das S, Mandal PC. Электрохимическое восстановление хинонов в различных средах: обзор. Int J Electrochem. 2011; 2011: 816202. [CrossRef]
- Бейли С.И., Рритчи И.М.Циклическое вольтамперометрическое исследование водной электрохимии некоторых хинонов. Electrochim Acta. 1985; 30: 3-12. [CrossRef]
- Ян Б., Хубер-Буркхардт Л., Ван Ф., Пракаш Г.С., Нараянан С.Р. Недорогая проточная батарея на водной основе для крупномасштабного накопления электроэнергии на основе водорастворимых органических окислительно-восстановительных пар. J Electrochem Soc. 2014: 161: A1371 [CrossRef]
- Ян Б., Хубер-Буркхардт Л., Кришнамурти С., Мурали А., Пракаш Г.С., Нараянан С.Р.Высокопроизводительный водно-органический проточный аккумулятор с окислительно-восстановительными парами на основе хинона на обоих электродах. J Electrochem Soc. 2016; 163: A1442. [CrossRef]
- Хубер-Буркхардт Л., Кришнамурти С., Ян Б., Мурали А., Нирмалчандар А., Пракаш Г. С. и др. Новый бензохинон, устойчивый к реакциям Майкла, для водно-органических проточных окислительно-восстановительных батарей. J Electrochem Soc. 2017; 164: A600. [CrossRef]
- Шимониси Ю., Чжан Т., Джонсон П., Иманиши Н., Хирано А., Такеда Ю. и др.Исследование литий-воздушных вторичных батарей — стабильность стеклокерамики типа NASICON в растворе кислоты. J Источники энергии. 2010; 195: 6187-6191. [CrossRef]
- Ван Х., Мацуи М., Кувата Х., Соноки Х., Мацуда Й., Шан Х и др. Обратимый бездендритный электрод из металлического лития большой площади. Nat Commun. 2017; 8: 15106. [CrossRef]
- Бай Ф, Шан Х, Мори Д., Таминато С., Мацумото М., Ватанабе С. и др.Тонкопленочный твердый электролит с высокой литий-ионной проводимостью из Li 1,4 Al 0,4 Ge 0,2 Ti 1,4 (PO 4 ) 3 -TiO 2 для водных литиевых вторичных батарей. Ион твердого тела. 2019; 338: 127-133. [CrossRef]
- Кионо Н, Бай Ф, Немори Х, Минами Х, Мори Д., Такеда Й и др. Литий-ионные твердые электролиты Li 1.4 Al 0,4 Ge 0,2 Ti 1,4 (PO 4 ) 3 Композиты и MO x (M = Al, Ti и Zr). Ион твердого тела. 2018; 324: 114-127. [CrossRef]
- Takahashi K, Johnson P, Imanishi N, Sammes N, Takeda Y, Yamamoto O. Водостойкий, литий-ионный проводящий Li 1,4 Ti 1,6 Al 0,4 (PO 4 ) 3 -гибрид эпоксидной смолы простыня.J Electrochem Soc. 2012; 159: A1065.
- Hasegawa S, Imanishi N, Zhang T, Xie J, Hirano A, Takeda Y, et al. Исследование литий-воздушных вторичных батарей — Устойчивость литий-ионной стеклокерамики типа NASICON к воде. J Источники энергии. 2009; 189: 371-377. [CrossRef]
- Шимониши Ю., Чжан Т., Иманиши Н., Им Д., Ли Ди-джей, Хирано А. и др.Исследование литий-воздушных вторичных батарей — Стабильность литий-ионно-проводящего твердого электролита типа NASICON в щелочных водных растворах. J Источники энергии. 2011; 196: 5128-5132. [CrossRef]
- Чжан Т., Иманиши Н., Такеда Ю., Ямамото О. Водные литиевые / воздушные аккумуляторные батареи. Chem Lett. 2011; 40: 668-673. [CrossRef]
- Е Р., Хенкенсмайер Д., Чен Р.Катион имидазолия сделал возможным обратимость производного гидрохинона для создания водных окислительно-восстановительных электролитов. Устойчивое энергетическое топливо. 2020; 4: 2998-3005. [CrossRef]
- Куан М., Санчес Д., Василькив М.Ф., Смит Д.К. Вольтамперометрия хинонов в небуферированном водном растворе: переоценка роли переноса протона и водородных связей в водной электрохимии хинонов.J Am Chem Soc. 2007; 129: 12847-12856. [CrossRef]
- Wu G, Swaidan R, Cui G. Электроокисление этанола, ацетальдегида и уксусной кислоты с использованием катализаторов PtRuSn / C, полученных с помощью модифицированного процесса восстановления спирта. J Источники энергии. 2007; 172: 180-188. [CrossRef]
- Сине Дж., Смида Д., Лимат М., Фоти Дж., Комнинеллис К.Микроэмульсия синтезировала наночастицы Pt / Ru / Sn на BDD для электроокисления спирта. J Electrochem Soc. 2007; 154: B170. [CrossRef]
- Брюс П.Г., Западная АР. Ионная проводимость твердых растворов LISICON, Li 2 + 2x Zn 1 − x GeO 4 . J. Solid State Chem. 1982; 44: 354-365. [CrossRef]
- Park MS, Ma SB, Lee DJ, Im D, Doo SG, Yamamoto O.Очень обратимый анод из металлического лития. Sci Rep.2014; 4: 3815-3822. [CrossRef]
- Чжэн Х., Ли Дж., Сон Х, Лю Г, Батталья VS. Исчерпывающее понимание влияния толщины электродов на электрохимические характеристики катодов литий-ионных аккумуляторов. Electrochim Acta. 2012; 71: 258-265. [CrossRef]
Свинцово-кислотные батареи находятся на пути к исчезновению
© 2019 Bloomberg Finance LP .Аккумуляторы стали неотъемлемой частью нашей повседневной жизни в 20 веке.Но темпы изменений резко возросли в 21 веке с разработкой новых типов батарей. Произошедшая в результате революция в области аккумуляторных батарей позволяет начать сейсмический сдвиг в том, как мы приводим в действие наши транспортные системы и тяжелое оборудование, а также в том, как мы питаем наши города.
Ключом к этой революции стала разработка доступных аккумуляторов с гораздо большей плотностью энергии. Это новое поколение аккумуляторов угрожает положить конец долгому правлению свинцово-кислотных аккумуляторов.
Но потребителей можно простить за то, что они сбиты с толку по поводу множества различных типов батарей, борющихся за долю рынка в этом захватывающем новом будущем. Итак, давайте разберемся в основных типах батарей и их применении.
Категории батарей
Батареив широком смысле подразделяются на первичные и вторичные. Первичная батарея — это одноразовая батарея. Все мы знакомы с этими типами батарей. Наиболее распространенным типом первичной батареи является щелочная батарея, названная так потому, что ее электролит является щелочным (гидроксид калия).
Пакет из 20 батареек Duracell, который вы покупаете в хозяйственном магазине за 15 долларов, представляют собой щелочные батареи. Эти батареи бывают разных размеров и с разным уровнем напряжения, наиболее распространенные из которых имеют обозначения AA, AAA, C, D и 9 вольт.
Первичные батареи дешевы и используются в фонариках, пультах для телевизоров, игрушках и бытовой электронике.
Вторичные батареи перезаряжаемые. Первоначальная стоимость этих батарей обычно выше, чем у первичных батарей, но они начинают давать значительное экономическое преимущество в энергоемких приложениях, которые быстро потребляют щелочные батареи.
Типы вторичных батарей
Самый распространенный тип вторичной батареи — это свинцово-кислотная батарея. Свинцово-кислотный аккумулятор — это самый старый тип аккумуляторных батарей, который можно найти в большинстве автомобилей мира. Это относительно дешевый и надежный, но он имеет самое низкое соотношение энергии к объему и энергии к весу среди основных типов вторичных батарей. Это делает его популярным для приложений хранения энергии, в которых вес и пространство не имеют особого значения, например, резервное питание для солнечных фотоэлектрических систем.Но для мобильных приложений, которые в значительной степени зависят от заряда батареи, свинцово-кислотные батареи быстро вытесняются новыми типами батарей.
Литий-ионный аккумулятор стал самым серьезным претендентом на свержение свинцово-кислотного аккумулятора. Литий-ионные батареи находятся на другом конце шкалы плотности энергии по сравнению со свинцово-кислотными батареями. У них самое высокое соотношение энергии к объему и энергии к весу среди основных типов аккумуляторных батарей. Это означает, что вы можете упаковать больше энергии в меньшее пространство, и вес также будет меньше.
Литий-ионные батареи все еще новы по сравнению со свинцово-кислотными батареями. Удар по ним был дорогостоящим, но эти расходы резко упали за последнее десятилетие и, по прогнозам, будут продолжать снижаться.
Два других основных типа вторичных батарей основаны на никеле, и оба находятся между свинцово-кислотными и литий-ионными с точки зрения плотности энергии. Никель-кадмиевый аккумулятор (Ni-Cd аккумулятор) использует гидроксид никеля и металлический кадмий в качестве электродов. Никель-кадмиевые батареи отлично подходят для поддержания напряжения и заряда, когда они не используются.Но эти батареи хорошо известны благодаря эффектам «памяти», возникающим при перезарядке частично заряженной батареи. Это со временем снижает емкость аккумулятора.
Никель-кадмиевые батареикогда-то были популярны в портативных электроинструментах и портативных электронных устройствах. Но никель-металлогидридные (Ni-MH) батареи в значительной степени вытеснили их в этих приложениях из-за более низкой стоимости и более высокой плотности энергии. Помимо того, что у никель-кадмиевых аккумуляторов в три раза больше емкости, чем у никель-кадмиевых аккумуляторов того же размера, никель-металлогидридные аккумуляторы не обладают эффектом «памяти», как никель-кадмиевые аккумуляторы.
Выбор правильной батареи
Из-за растущего числа вариантов батарей может быть сложно определить лучший тип батареи для вашего приложения. Некоторые важные соображения включают плотность энергии, удельную мощность, стоимость, долговечность цикла, напряжение и безопасность.
Эти соображения обычно предполагают компромиссы. В идеале батарея должна обладать высокой энергией и удельной мощностью, а также хорошей долговечностью при невысокой цене. На самом деле потребителям приходилось платить больше за батареи с большей плотностью энергии.Но это меняется.
Исследовательская организация BloombergNEF сообщила, что средневзвешенная цена на литий-ионный аккумулятор (который включает элемент и аккумулятор) упала на 85% в период с 2010 по 2018 год, достигнув в среднем 176 долларов за кВтч. BloombergNEF также прогнозирует, что к 2024 году цены упадут до 94 долларов за киловатт-час и до 62 долларов за киловатт-час к 2030 году. Это отразит снижение цен на 95% в течение 20 лет. Для сравнения, свинцово-кислотные аккумуляторные батареи по-прежнему стоят около 150 долларов за киловатт-час, и это спустя 160 лет после изобретения свинцово-кислотных аккумуляторов.
Таким образом, может пройти совсем немного времени, прежде чем самая энергоемкая батарея станет самой дешевой батареей. Это имеет огромное значение для будущего свинцово-кислотных аккумуляторов.
Еще одно важное соображение — емкость аккумулятора. Емкость определяет время работы батареи, которое отражает ток разряда, который батарея может обеспечить до тех пор, пока не потребуется подзарядка.
Энергосодержание батареи получается путем умножения емкости батареи в ампер-часах (Ач) на напряжение для получения ватт-часов (Втч).Две батареи могут иметь одинаковую емкость Ач, но если одна имеет более высокое напряжение, она будет иметь больше энергии.
Это важные концепции, которые необходимо понять, если вы пытаетесь выбрать батарею для питания фонарика, а не батарею для питания вилочного погрузчика.
Плотность мощности определяет максимальную скорость разряда батареи. Некоторым батареям требуется низкая скорость разряда, но тем, которые используются для увеличения мощности, потребуется большая удельная мощность.
Поскольку аккумулятор разряжен, его необходимо перезарядить.Срок службы батареи определяет ее стабильность при повторяющихся циклах.
Наконец, необходимо учитывать условия эксплуатации аккумулятора. Например, высокие или низкие температуры могут повлиять на производительность и безопасность аккумулятора.
Пример использования
В течение следующих нескольких лет многие компании будут решать, следует ли переводить свои приложения со свинцово-кислотных аккумуляторов на более современные типы батарей. Есть несколько экономических соображений, которые можно продемонстрировать на примере.
Тим Каримов, президент калифорнийского поставщика литий-ионных аккумуляторов OneCharge, сказал, что их клиенты показывают, что «общая стоимость владения литий-ионными аккумуляторами в среднем на 20-40% ниже всего за 2-4 года».
Вот как они пришли к этому номеру. Хотя они не указывают базовую стоимость емкости для литий-ионных батарей по сравнению со свинцово-кислотными, они отмечают в презентации, что свинцово-кислотную батарею можно заменить литий-ионной батареей с минимальной стоимостью 60%. вместимость:
Презентация OneChargeПричина этого в том, что максимальный разряд свинцово-кислотных аккумуляторов составляет 80%, тогда как литий-ионные аккумуляторы могут разряжаться до нуля.В дополнение к этому, литий-ионные аккумуляторы можно заряжать в различные моменты дня (перерывы и т. Д.), Что быстро сократит срок службы свинцово-кислотных аккумуляторов.
Например, компания цитирует недавнее тематическое исследование, в котором заказчик смог сократить количество имеющихся у него погрузчиков с 17 до 12, переключившись со свинцово-кислотных аккумуляторов на литий-ионные — в основном из-за возможности. зарядка.
Таким образом, даже несмотря на то, что цена за емкость выше для литий-ионных аккумуляторов, тот факт, что вам нужна меньшая емкость, снижает литий-ионную премию (которая, согласно BloombergNEF, скорее всего, не будет премией в течение длительного времени).
Каримов ссылается на дополнительную экономию на примере практики выращивания, упаковки и транспортировки фруктов с использованием 2 смен и 30 грузовиков:
- Время простоя из-за замены батареи — 56 000 долларов в год
- Полив свинцово-кислотных аккумуляторов — 8000 долларов в год
- Потребность в новой аккумуляторной — 440 000 долларов
- Более высокие затраты на профилактическое обслуживание и страховые взносы, связанные с рисками для здоровья, связанными со свинцово-кислотой
Кроме того, у литий-ионных аккумуляторов более длительный срок службы — 3000 циклов по сравнению с менее чем 1500 циклами свинцово-кислотных.Исторически сложилось так, что потребители учитывали такую экономию при принятии решения о переходе на литий-ионные батареи. Но с учетом снижения цен на литий-ионные аккумуляторы это решение вскоре может быть намного проще.
Выводы
В мире происходит революция в области аккумуляторных батарей, но снижение цен и рост установленной базовой комплектации сигнализируют о том, что литий-ионные батареи заменят свинцово-кислотные. Поскольку литий-ионные батареи дороже свинцово-кислотных, экономия будет зависеть от того, насколько сильно они используются (что влияет на время простоя, техническое обслуживание и т. Д.).).
Но поскольку цена на литий-ионные батареи продолжает падать, экономическое обоснование будет убедительным только из-за цены батарей. Когда это произойдет, возраст свинцово-кислотных аккумуляторов подойдет к концу.
.