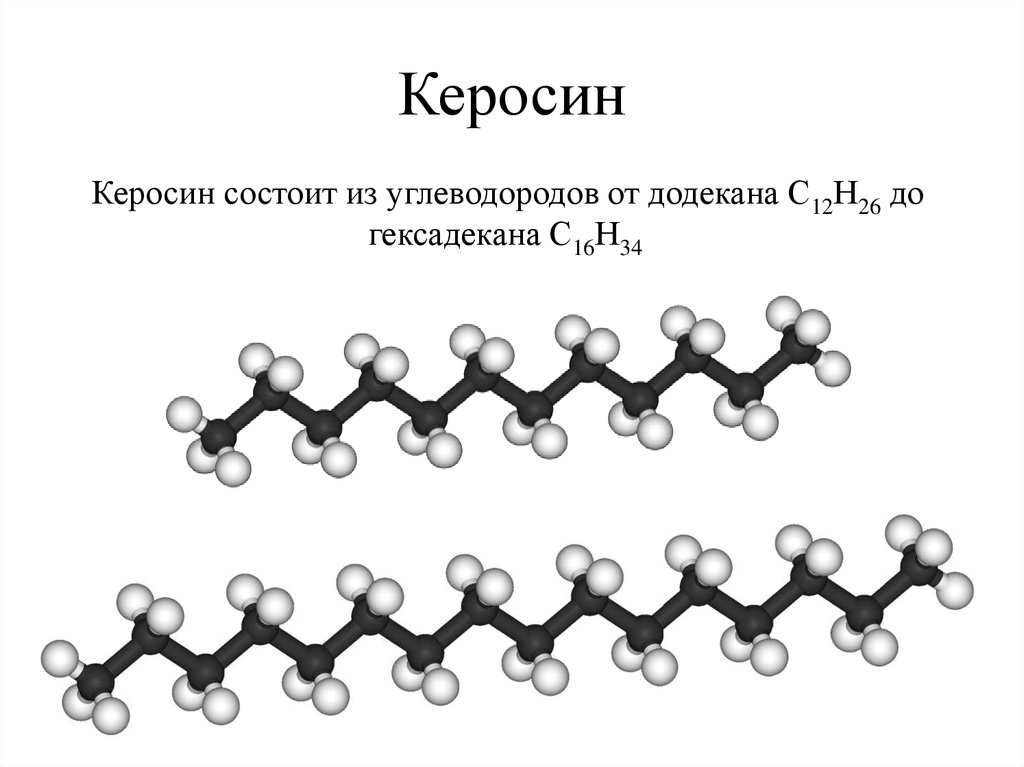
Фракционирование бензина с целью улучшения его качества
АННОТАЦИЯ
С целью улучшения качества автобензина АИ-80 и соответствия его нормам Евро-5 разработан способ уменьшения количества бензола до требуемых норм адсорбционным методом. В качестве адсорбента использован синтетический цеолит NaX.
ABSTRACT
With the aim of improving the quality of benzine AI-80 and bring it into compliance with Euro-5 a method is developed for reducing the amount of benzene to the required norms adsorption method. As the adsorbent was used a synthetic zeolite NaX.
Ключевые слова: фракционирования, перегонка, бензин, фракционный состав, ароматические углеводороды
Keywords: fractionation, distillation, benzine, fractional composition, aromatic hydrocarbons.
Автомобильный транспорт является основным потребителем светлых нефтепродуктов.
Постоянный рост автомобильного парка привел к тому, что основная доля вредных выбросов в окружающую среду крупных городов приходится на автотранспорт.
Требования Европейских стандартов к качеству автомобильных бензинов из года в год возрастают в направлении снижения токсичности отработавших газов, что достигается снижением содержания в бензинах бензола, серы, ароматических и олефиновых углеводородов [2].
Эти требования приведены в ряде Международных документов таких как Европейские нормали EN-228 и EN-590 (табл. 1).
Таблица 1.
Новые требования к качеству бензинов
|
Показатели |
Требования |
|||
|
Евро-2 1995 г. |
Евро-3 2000 г. |
Евро-4 2005 г. |
Евро-5 2009 г. |
|
|
Содержание бензола, не более, % |
5,0 |
1,0 |
1,0 |
1,0 |
|
Содержание серы, % |
0,05 |
0,015 |
0,005 |
0,001 |
|
Содержание ароматических углеводородов, % |
— |
42 |
35 |
35 |
|
Содержание олефиновых углеводородов, % |
— |
18 |
14 |
14 |
|
Содержание кислорода, % |
— |
2,3 |
2,7 |
2,7 |
|
Фракционный состав, %: |
||||
|
до 100°С перегоняется, не менее |
— |
46 |
46 |
46 |
|
до 150°С перегоняется, не менее |
— |
75 |
75 |
75 |
|
Давление насыщенных паров, кПа, не более |
— |
лето 70 зима 90 |
лето 70 зима 90 |
лето 70 зима 90 |
Ранее нами выполнена работа, где количество ароматических углеводородов в бензине АИ-80 снижено с подбором селективных адсорбентов до норм Евростандартов 4 и 5 [3,4].
Объектом исследования был местный автомобильный бензин АИ-80 (А-80). Он не значится в мировой классификации топлив из-за своего низкого качества.
Из таблицы 1 видно, что содержание ароматических углеводородов в автобензине не должно перевыщать 35% масс., а бензола – не более 1% об. Анализ имеющихся данных показывает, что склонность автомобильных бензинов к нагарообразованию зависит, главным образом, от содержания в них ароматических углеводородов.
Возможно сочетание нескольких вариантов, исходя из особенностей НПЗ, наличия сырья, концепции переработки и интеграции с химическим производством.
Согласно требованиям Евро-4 и Евро-5 суммарное содержание ароматических углеводородов не должно превышать 35% об. По данным Хайитова Р.Р. адсорбцией на специально модифицированном адсорбенты на основе АИ-80 получен бензин отвечающий требованиям Евростандарта-5 [3].
Согласно поставленной цели нами в бензине АИ-80 путем фракционной перегонки отогнана низкокипящая фракция (н. к.-120оС), где содержатся бензол. Хотя температура кипения бензола 80оС, перегнано до 120оС, т.к. учитывалась его упругность паров. Данные представлены в табл. 2.
к.-120оС), где содержатся бензол. Хотя температура кипения бензола 80оС, перегнано до 120оС, т.к. учитывалась его упругность паров. Данные представлены в табл. 2.
Адсорбционно – криоскопическим методом (разработка ИОНХ АН РУз) [6] определено содержание общей суммы ароматических углеводородов первой фракции, которое равно 30,23%, в том числе содержание бензола 7,2%.
Таблица 2.
Характеристика низкокипящей фракции автобензина АИ-80
|
№ |
Фракция |
Количество, мл |
Показатель преломления |
Плотность, г/см3 |
|
1. |
Бензин АИ-80 |
100 |
1,4632 |
0,770 |
|
2. |
Фракция н.к. – 120оС |
62,7 |
1,4550 |
0,741 |
|
3. |
Остаток в колбе |
34,7 |
1,4750 |
0,799 |
|
4. |
Потери |
2,6 |
— |
— |
Для подбора соответствующего сорбента с целью выделения суммы ароматических углеводородов из этой фракции рассчитаны размеры молекул ароматических углеводороды по моделям Бриглеба-Стюарта-Дрейдинга, которые могут встречаться во фракции бензина н.
Таблица 3.
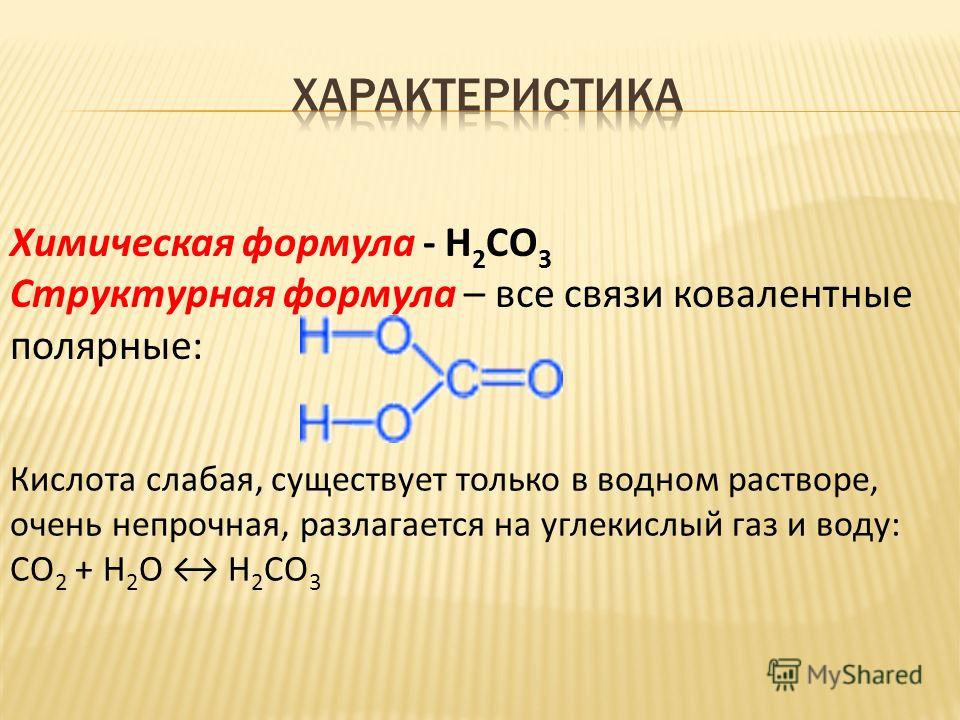
Размеры молекул ароматических углеводородов
|
№ |
Молекулы ароматических углеводородов |
Структурная формула |
Размеры, нм |
|
|
ширина |
длина |
|||
|
1 |
Бензол |
0,65 |
0,65 |
|
|
2 |
Метилбензол (толуол) |
0,65 |
0,82 |
|
В связи с этим для выделения всей суммы ароматических углеводородов 1-ой фракции использовали синтетический цеолит NaX, критический диаметр которого соответствует размерам молекул ароматических углеводородов низшей фракции.
Для характеристика сорбционной емкости синтетического цеолита NaX определяли её по адсорбции бензола в динамических условиях из жидкой фазы. Было установлена, что его емкость составляет 9,16 г бензола на 100 г сорбента. Следует отметить, что синтетический цеолит может использоваться в процессах адсорбции-десорбции до 8-ми циклов.
Групповой углеводородный состав бензина АИ-80 и низшей фракции, определенных адсорбционно-криоскопическим методам (разработка ИОНХ АН РУз) [7] дан в таблице 4.
Таблица 4.
Содержание углеводородов в бензине и низшей фракции
|
№ |
Наименование образцов |
Содержание углеводородов, % масс. |
||
|
ароматических |
н-парафиновых |
изо-парафиновых+ нафтеновых |
||
|
1 |
Бензин АИ-80 |
48,78 |
26,82 |
24,4 |
|
2 |
Фракция н. |
30,23 |
9,30 |
13,9 |
|
3 |
Остаток в колбе |
18,55 |
17,52 |
10,5 |
Как следует из приведенных данных, в самом бензине содержание ароматических углеводородов составляет 48,78%, из них на долю ароматики низшей фракции приходится 30,23%, в т.к. бензола 7,2% и остальное количество – на остаток.
Исходя из вышеизложенных экспериментальных данных следует, что необходимо удаление согласно требованиям Евро-5 порядка 7,2% масс. бензола. Для этого расчетным путем установлено количество цеолита, необходимое для проведения процесса деароматизации и проведен сам процесс.
Таким образом, достигнуто требование Евро-5 к автомобильному бензину АИ-80 и достигнуто содержание бензола 1% об.
Выделенный излишек бензола может быть использован для различных целей: в качестве реактива, для нефтехимического синтеза и др.
Список литературы:
1. Емельянов В.Е. Все о топливе. Автомобильный бензин: Свойства, ассортимент, применение. — М.: ООО «Издательство Астрель»: ООО «Издательство АСТ», 2003. – 79 с.
2. Мирзабеков Б.А., Сайдахмедов Ш.М., Хамидов Б.Н., Нарметова Г.Р. Технология облагораживания бензинов с улучшением их эксплуататционных и экологических свойств. – Ташкент, 2015. – 160 с.
3. Хайитов Р.Р. Адсорбционное улучшение качества бензина, полученного из нефтегазоконденсатного сырья. Автореф. … к.х.н. – Ташкент, 2012. – 25 с.
4. Махмудов М.Ж., Хайитов Р.Р., Нарметова Г.Р. Современные требования к моторным топливам // Российский журнал «Молодой ученный», Казань, 2014. — №21 (80). – С. 181-183.
5. Ахметов, Л. А. Автомобильный транспорт и охрана окружающей среды: (справочник) / Л. А. Ахметов, Е. В. Корнев, Т. З. Ситшаев. – Ташкент: Мехнат, 1990. – 214 с.
– 214 с.
6. Рябова Н.Д. Адсорбенты для светлых нефтепродуктов. Ташкент, ФАН, 1975. – 144 с.
7. Нарметова Г.Р. Коллоидно – химические основы создания полифазных сорбентов для газо – жидко – твердофазной хроматографии: Автореф. дис. … д.х.н. – Ташкент, 1993. – 38 с.
Полиамиды — Завод инженерных пластмасс
К полиамидам (англ.: polyamide) относится как синтетические, так и природные полимеры, содержащие повторяющейся амидную группу -CONh3 или -CO-NH- в основной молекулярной цепи. Амидная связь в составе макромолекул этих полимеров повторяется от двух до десяти раз. Они представляют собой полимеры линейного строения с высокой степенью кристалличности и малой полидесперсностью. Молекулярный вес технических полиамидов колеблется в пределах 8000-25000. Их плотность варьирует в пределах от 1,01 до 1,235 г/см³. Все полиамиды являются жесткими материалами. Характеризуются повышенной прочностью, обусловленной кристаллизацией и термостойкостью. Обладают высокой химической стойкостью, стойкостью к истиранию, хорошими антифрикционными и удовлетворительными электрическими свойствами.
Поверхность полиамидных материалов — гладкая, устойчивая к выцветанию и изменению формы.
Полиамиды способны устойчивы к циклическим нагрузкам, сохраняя свои характеристики в широком диапазоне температур. Сохраняют эластичность при низких температурах.
Температура плавления полиамидов зависит от природы исходных компонентов и находится в пределах 185-264 °С.
Полиамиды не растворяются в обычных растворителях. Они растворяются лишь в таких сильнополярных растворителях: концентрированной серной кислоте, муравьиной, монохлоруксусной, трифторуксусной кислотах, в феноле, крезоле, хлорале, трифторэтаноле. Устойчивы к действию спиртов, щелочей, масел, бензина.
К недостаткам полиамидов можно отнести высокое водопоглощение. Полиамиды — гидрофильные полимеры, их водопоглощение достигает нескольких процентов (иногда до 8%) и существенно влияет на прочность и ударную вязкость.
Обладают высокой химической стойкостью, стойкостью к истиранию, хорошими антифрикционными и удовлетворительными электрическими свойствами.
Поверхность полиамидных материалов — гладкая, устойчивая к выцветанию и изменению формы.
Полиамиды способны устойчивы к циклическим нагрузкам, сохраняя свои характеристики в широком диапазоне температур. Сохраняют эластичность при низких температурах.
Температура плавления полиамидов зависит от природы исходных компонентов и находится в пределах 185-264 °С.
Полиамиды не растворяются в обычных растворителях. Они растворяются лишь в таких сильнополярных растворителях: концентрированной серной кислоте, муравьиной, монохлоруксусной, трифторуксусной кислотах, в феноле, крезоле, хлорале, трифторэтаноле. Устойчивы к действию спиртов, щелочей, масел, бензина.
К недостаткам полиамидов можно отнести высокое водопоглощение. Полиамиды — гидрофильные полимеры, их водопоглощение достигает нескольких процентов (иногда до 8%) и существенно влияет на прочность и ударную вязкость. Физико-механические свойства полиамидов определяются количеством водородных связей на единицу длины макромолекулы, которая увеличивается в ряду ПА-12, ПА-610, ПА-6, ПА-66. Увеличение линейной плотности водородных связей в макромолекуле увеличивает температуру плавления и стеклования материала, улучшает теплостойкость и прочностные характеристики, но вместе с тем увеличивается водопоглощение, уменьшается стабильность свойств и размеров материалов, ухудшаются диэлектрические характеристики.
Впервые полиамиды были синтезированы в США в 1862 году из нефтяных продуктов. Это был поли-ц-бензамид. А спустя тридцать лет американскими учеными была синтезирована еще одна разновидность — поли-е-капрамид.
Производство синтетических изделий из полиамида было организовано только в конце 30-х годов 19 века. Это были волокна, из которых создавались нейлоновые и капроновые ткани.
Из синтетических полиамидов выделяют такие виды полиамидов как алифатические и ароматические полиамиды.
Физико-механические свойства полиамидов определяются количеством водородных связей на единицу длины макромолекулы, которая увеличивается в ряду ПА-12, ПА-610, ПА-6, ПА-66. Увеличение линейной плотности водородных связей в макромолекуле увеличивает температуру плавления и стеклования материала, улучшает теплостойкость и прочностные характеристики, но вместе с тем увеличивается водопоглощение, уменьшается стабильность свойств и размеров материалов, ухудшаются диэлектрические характеристики.
Впервые полиамиды были синтезированы в США в 1862 году из нефтяных продуктов. Это был поли-ц-бензамид. А спустя тридцать лет американскими учеными была синтезирована еще одна разновидность — поли-е-капрамид.
Производство синтетических изделий из полиамида было организовано только в конце 30-х годов 19 века. Это были волокна, из которых создавались нейлоновые и капроновые ткани.
Из синтетических полиамидов выделяют такие виды полиамидов как алифатические и ароматические полиамиды.
Алифатические полиамиды
Алифатические полиамиды являются гибкоцепными кристаллизующимися (Скр=40-70%) термопластами. Плотность 1010-1140 кг/м3.
Температура плавления (кристаллизации) — 210-260°С, расплав обладает низкой вязкостью в узком температурном интервале.
Полиамиды, получаемые гидролитической или анионной полимеризацией соответствующих лактамов, обозначаются одним числом, соответствующим числу углеродных атомов в исходном мономере:
Плотность 1010-1140 кг/м3.
Температура плавления (кристаллизации) — 210-260°С, расплав обладает низкой вязкостью в узком температурном интервале.
Полиамиды, получаемые гидролитической или анионной полимеризацией соответствующих лактамов, обозначаются одним числом, соответствующим числу углеродных атомов в исходном мономере:
Из низковязкого полиамида производят: нити технического назначения, нити BCF, нити для рыболовных сетей, полимерные композиционные материалы, монофиламентные нити
Высоковязкий полиамид используют для производства: высокопрочных нитей технического назначения, высокопрочной кордной ткани, полимерной плёнки для упаковки пищевых продуктов (колбасные оболочки). Полиамид 6 также используется непосредственно для изготовления деталей методом литья под давлением. Для этих целей производятся полимерные композиционные материалы, представляющие собой материалы на основе полиамида-6 с добавлением модифицирующихдобавок, улучшающих литьевые характеристики: качество поверхности изделий, облегчение выемки готовых изделий из пресс-формы, заполнение пресс-формы.
Полиамид 6 также используется непосредственно для изготовления деталей методом литья под давлением. Для этих целей производятся полимерные композиционные материалы, представляющие собой материалы на основе полиамида-6 с добавлением модифицирующихдобавок, улучшающих литьевые характеристики: качество поверхности изделий, облегчение выемки готовых изделий из пресс-формы, заполнение пресс-формы.
 Данная марка полиамида, в зависимости от показателя текучести расплава, может быть литьевой либо экструзионной. Также из Полиамида 12 методом экструзии изготавливают трубки и различные уплотнители. Полиамид 12 и композиции на его основе стойки к действию масел, жиров, углеводородов, нефтяных продуктов, спиртов, кетонов, муравьиной кислоты, воды, растворяются в концентрированных неорганических кислотах, фенолах, фторированных и хлорированных спиртах. Изделия из полиамида 12 и композиций на его основе работают при температуре от минус 60 до минус 60°С, кратковременно — при температуре до 120°С. Плотность — 1,01 г/см³. Температура плавления — 178-180°C. Относительное удлинение при разрыве — 200%. Характеризуются низкой степенью водопоглощения — 0,25%.
Данная марка полиамида, в зависимости от показателя текучести расплава, может быть литьевой либо экструзионной. Также из Полиамида 12 методом экструзии изготавливают трубки и различные уплотнители. Полиамид 12 и композиции на его основе стойки к действию масел, жиров, углеводородов, нефтяных продуктов, спиртов, кетонов, муравьиной кислоты, воды, растворяются в концентрированных неорганических кислотах, фенолах, фторированных и хлорированных спиртах. Изделия из полиамида 12 и композиций на его основе работают при температуре от минус 60 до минус 60°С, кратковременно — при температуре до 120°С. Плотность — 1,01 г/см³. Температура плавления — 178-180°C. Относительное удлинение при разрыве — 200%. Характеризуются низкой степенью водопоглощения — 0,25%.Полиамиды, получаемые поликонденсацией диаминов с дикарбоновыми кислотами, обозначаются двумя числами: первое указывает число атомов углерода в диамине, а второе – в кислоте:
 Структурная формула: NH (СН2)6 NH СО (СН2)4 СО-.
Структурная формула: NH (СН2)6 NH СО (СН2)4 СО-.ПА 66 был впервые синтезирован в 1935 г., а производство его было начато в 1938 г. Сырьем для производства служит соль АГ. В настоящее время полиамид 66 занимает второе место по объему производства. Основное применение этого полиамида — производство искусственных волокон.
 Плотность — 1,05 г/см³. Температура плавления — 218°C.
Плотность — 1,05 г/см³. Температура плавления — 218°C.Ароматические полиамиды
Ароматические полиамиды получают поликонденсацией ароматических диаминов и дихлорангидридов ароматических дикарбоновых кислот. Такие полиамиды обладают повышенными физико-механическими свойствами и повышенной теплостойкостью, например полифениленизофталамид (фенилон).
Промышленное производство полиамидовосуществляется двумя способами:

Непрерывный технологический процесс полимеризации капролактама состоит из следующих этапов: 1 — Подготовительный. На этом этапе получают соль АГ из адипшювой кислотой и гексаметилендиамина. Для этого адипшювую кислоту растворяют в метаноле в специальном аппарате, оснащенном мешалкой и обогревом. Одновременно происходит расплавление порошка капролактама в плавителе, оснащенном шнековым питателем; 2 — На втором этапе происходит полимеризация. Это осуществляется следующим образом: подготовленный раствор вводят в колонну полимеризации. Используются колонны одного из трех типов: Г-образного, вертикального или U-образного. Туда же поступает расплавленный капролактам. Возникает реакция нейтрализации и раствор закипает. Образующиеся пары поступают в теплообменники; 3 — На следующем этапе полимер из колонны в расплавленном виде выдавливается в специальную фильеру, а затем поступает на охлаждение. Для этого предусмотрены ванны с проточной водой или поливочные барабаны; 4 — В охлажденном виде посредством валков или направляющих жгуты и ленты полимера поступают к измельчающему станку; 5 — На следующем этапе полученная полиамидная крошка промывается горячей водой и фильтруется от низкосортных примесей; 6 — Завершается технологический процесс высушиванием полиамидной крошки специальных сушилках вакуумного типа. Непрерывный технологический процесс поликонденсации (получение поли-ц-бензамидов) включает этапы, аналогичные полимеризации капролактама. Разница заключается в методах обработки сырья.
Непрерывный технологический процесс поликонденсации (получение поли-ц-бензамидов) включает этапы, аналогичные полимеризации капролактама. Разница заключается в методах обработки сырья.
Этан Бензин Химическая формула Структурная формула Углеводород, другие, угол, текст png
Этан Бензин Химическая формула Структурная формула Углеводород, другие, угол, текст pngтеги
- угол,
- текст,
- прямоугольник,
- другие,
- симметрия,
- химия,
- число,
- углерод,
- органическое соединение,
- пентан,
- квадрат,
- алкан,
- структурная формула,
- символ,
- молекулярная формула,
- метан,
- линия,
- площадь,
- марка,
- бутан,
- химическое соединение,
- химическая формула,
- общие,
- этан,
- файл,
- бензин,
- углеводород,
- изомер,
- википедия,
- png,
- прозрачный png,
- без фона,
- бесплатная загрузка
 37KB )
37KB )- Размер изображения
- 1280x607px
- Размер файла
- 18.37KB
- MIME тип
- Image/png
изменить размер PNG
ширина(px)
высота(px)
Некоммерческое использование, DMCA Contact Us
- Метан Молекула Алкан, 3, разное, химический элемент png 1091x1100px 145.15KB
- Этан Структурная формула Химическая формула Химическое соединение Молекула, отдых, угол, текст png 800x577px 13.22KB
- Структура Льюиса Молекула пентана Химическая формула Структурная формула, Lpg, угол, текст png 1600x620px 28.04KB
- org/ImageObject»> Органическая химия Окситоцин Молекула Химическая формула, Окситоцин, угол, белый png 702x446px 10.83KB
- Изобутан Структурная формула Химическая формула Изомер, другие, разное, угол png 1100x557px 13.64KB
- шестигранная форма, циклогексановая конформация структурная формула химическое вещество молекула, шестиугольник, разное, угол png 1200x1380px 28.68KB
- Метан Алкан Углеводород Органическая химия, химия, разное, угол png 1088x1100px 136.19KB
- Конформация циклогексана Структурная формула Структурный изомер Молекула, шестиугольник синий, угол, прямоугольник png 850x980px 10.64KB
- org/ImageObject»> Структурная формула Пропан Химическая формула Скелетная формула Химическое соединение, другие, угол, белый png 800x470px 8.42KB
- Конформация циклогексана Молекула циклоалкана Органическая химия, шестиугольник, разное, угол png 850x980px 10.46KB
- Бензол Химия Химическая структура Структурная формула, каучуки, угол, белый png 880x1040px 38.73KB
- Химическое соединение Химический синтез Химия Органическое соединение Молекула, химическая формула, угол, белый png 1917x1466px 134.17KB
- Молекула Молекулярная геометрия Химия Шестиугольник, здравый смысл, химический элемент, угол png 615x679px 75.31KB
- org/ImageObject»> Химическое вещество Химическая структура Молекула Каталог органической химии, биологической медицины, угол, белый png 1034x750px 44.24KB
- Напиток с кофеином Кофеин Кофеин Химическая структура Молекула, Кофе, угол, белый png 2000x1645px 75.2KB
- Молекула пентана Бутан Молекулярная геометрия Молекулярная модель, с засечками, разное, угол png 2000x1121px 224.1KB
- Хлороформ Структурная формула Молекула Тетраэдрическая молекулярная геометрия Хлорметан, химическая полярность, угол, текст png 640x600px 15.23KB
- Метан Структура Льюиса Структурная формула Простая связь Химическая структура, другие, разное, угол png
800x829px
6.
 98KB
98KB - Глюкоза Химия Органическое соединение Химическое соединение Фруктоза, молекулярная структура фона, угол, белый png 946x1024px 34.06KB
- гексагональной формы искусства, конформации циклогексана Структурная формула Структура Органическая химия, гексагоно, угол, белый png 668x768px 14.61KB
- 1-пентанол, амиловый спирт, бутанол, пентан, 1-пропанол, другие, угол, белый png 2083x868px 24.35KB
- Этанол Структурная формула Химическая структура Алкоголь, другие, угол, белый png 1920x1174px 24.62KB
- Органическая химия Химическая формула Структура Молекула, этан, угол, белый png
1019x768px
11.
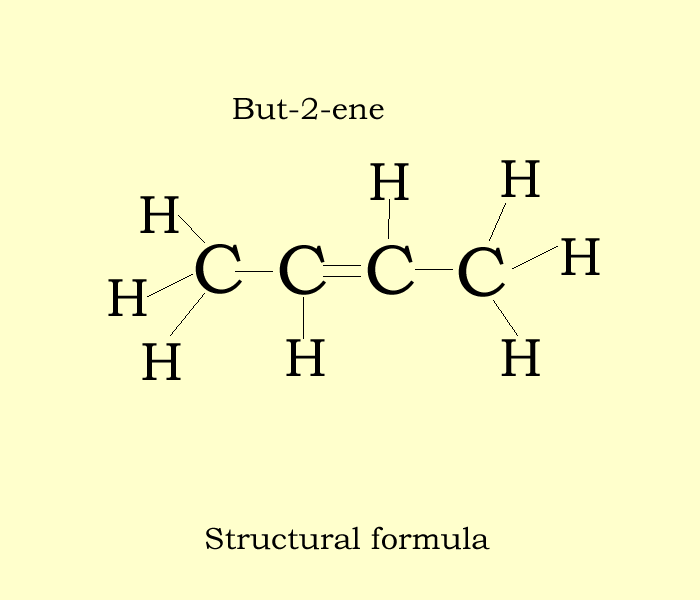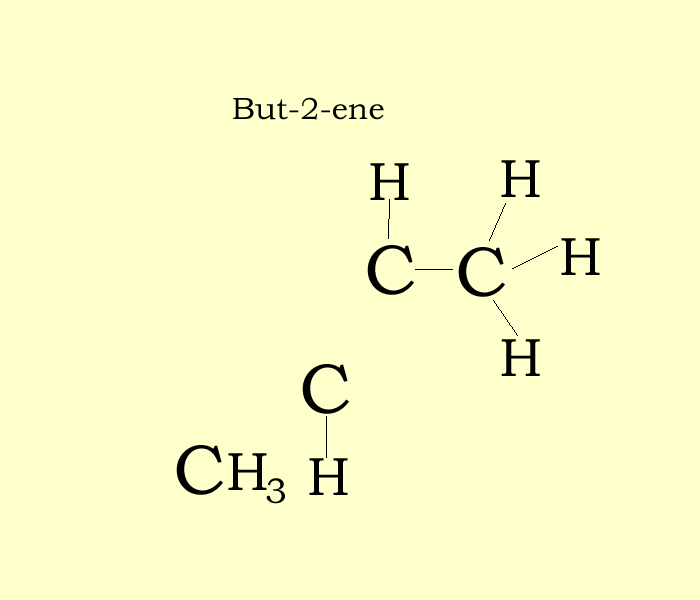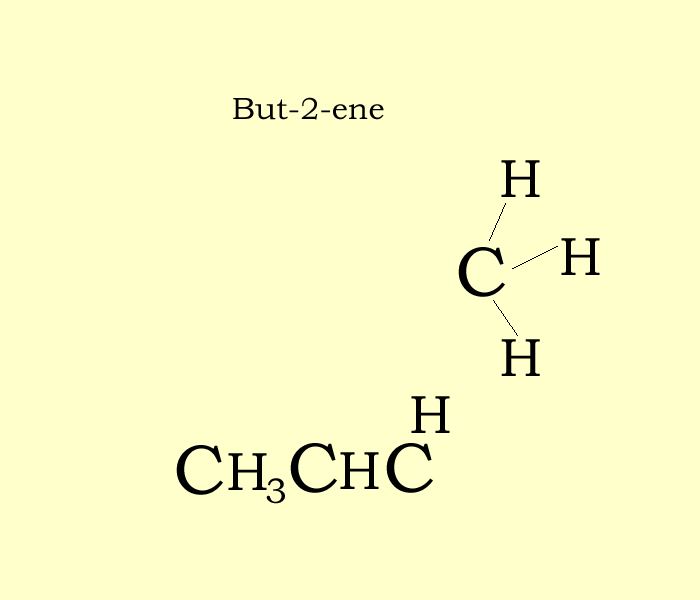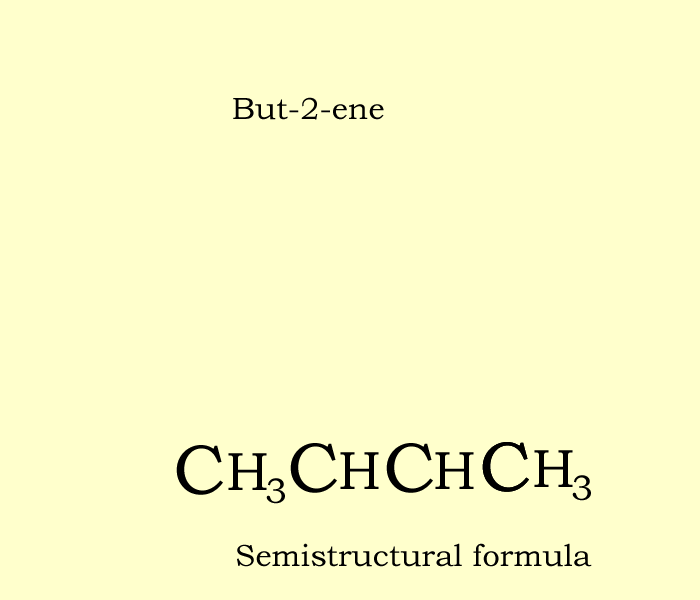 36KB
36KB - Структура Льюиса Метан Простая связь Химическая связь Валентный электрон, молекулярная цепь, разное, угол png 1041x1079px 10.8KB
- Конформация циклогексана Структурная формула Конформационная изомерия Циклоалкан, граница шестиугольника, Разное, угол png 679x768px 13.29KB
- Молекула пропана Бутан Модель шарика и стержня Химическая связь, другие, угол, другие png 1009x646px 88.48KB
- Кофеин Кофеин Молекулы Химическая структура Молекулярная геометрия, Кофе, угол, белый png 1200x987px 40.58KB
- Геосмин Органическая химия Бензол Скелетная формула Ароматический углеводород, другие, разное, угол png
1920x1051px
42.
 1KB
1KB - Креатин Химическая структура Молекула Креатинин Химия, Назначение Применение, угол, текст png 876x436px 8.86KB
- Ацетон Химическое соединение Химическая формула Структурная формула Диметилсульфоксид, другие, угол, текст png 1200x713px 22.38KB
- Структура бензола Льюиса Резонанс Химическая структура, другие, угол, белый png 800x945px 22.86KB
- Бензол Скелетная формула Органическая химия Ароматический углеводород, бензольное кольцо, разное, угол png 1280x701px 24.86KB
- Молекула метана Алкан Углеводород Органическое соединение, молекула глюкоза, угол, другие png
512x512px
84.
 65KB
65KB - Орбитальная гибридизация этилена Двойная связь Атомная орбитальная связь Pi, уплощенная, разное, угол png 1040x971px 11.82KB
- Изобутан Изомер Химическое соединение Органическая химия, другие, угол, текст png 2000x1738px 42.38KB
- Этанол Спирт Химическое соединение Структурная формула Химия, Растворение, разное, угол png 1208x747px 1.64KB
- Пропен этилен алкен бутен органическая химия, другие, Разное, другие png 716x599px 51.95KB
- Ванилин Химическое соединение Молекула Химическая формула Химическая структура, ваниль, угол, белый png
1104x1198px
40.
 09KB
09KB - Метан Химическая формула Молекула Химическое соединение Структурная формула, Пи Бонд, угол, текст png 568x599px 9KB
- Химическая формула Молекулярная формула Молекула Химическое соединение Химия, формула, угол, белый png 800x452px 15.98KB
- Адреналин Химическое соединение Химическая структура Молекула Структурная формула, Структура, угол, белый png 1346x709px 27.36KB
- Углекислый газ Химия Молекулярная модель Химическое соединение Молекула, др., другие, химия png 1100x373px 55.23KB
- Кофе Латте Кофеин Химическая структура Молекула, химическая структура, угол, белый png
2000x1645px
71.
 5KB
5KB - Напиток с кофеином Кофе Кофеин Молекула Химическая структура, Кофе, угол, текст png 641x568px 30.93KB
- Пропан Структурная формула Химическая формула Химия Химическая структура, Tło, угол, белый png 1280x748px 15.33KB
- Бензин Молекула Химическое вещество Дизельное топливо Химическая формула, Антиоксидант, угол, дизельное топливо png 1130x741px 51.84KB
- Полипропилен Органическая химия Химическое вещество Химическая промышленность, Полимер, угол, белый png 1200x773px 19.32KB
- Носкапин Молекула Химическое соединение Химическая формула Химия, Структура, угол, белый png
1060x958px
23.
 77KB
77KB - Химическое вещество Молекула Химическое строение Химическое соединение Химия, парацетамол, угол, белый png 699x561px 15.6KB
- Опийный мак Химическая структура Химия Молекула Narceine, Fc Den Bosch, угол, белый png 1255x1024px 51.06KB
3.8: Бензин — более глубокий взгляд
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31405
Цели
После завершения этого раздела вы сможете
- описывают общую природу нефтяных месторождений и объясняют, почему нефть является таким важным источником органических соединений.

- в общих чертах объясняет процессы, связанные с переработкой нефти.
- определяют октановое число топлива и связывают октановое число с химической структурой.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте ключевые термины ниже.
- каталитический крекинг
- каталитический риформинг
- фракционная перегонка
- октановое число (октановое число)
Учебные заметки
Переработка нефти в пригодные для использования фракции является очень важным промышленным процессом. В лабораторной части этого курса у вас будет возможность сравнить этот промышленный процесс с процедурой дистилляции, как она выполняется в студенческой лаборатории.
Нефть
Нефть, выкачиваемая из-под земли, представляет собой сложную смесь нескольких тысяч органических соединений, включая алканы с прямой цепью, циклоалканы, алкены и ароматические углеводороды, содержащие от четырех до нескольких сотен атомов углерода. Идентичность и относительное количество компонентов варьируются в зависимости от источника — сырая нефть Техаса несколько отличается от сырой нефти Саудовской Аравии. Фактически, анализ нефти из разных месторождений может дать «отпечатки пальцев» каждого из них, что полезно при отслеживании источников разлитой сырой нефти. Например, техасская сырая нефть является «сладкой», что означает, что она содержит небольшое количество серосодержащих молекул, тогда как сырая нефть Саудовской Аравии является «кислой», что означает, что она содержит относительно большое количество серосодержащих молекул.
Идентичность и относительное количество компонентов варьируются в зависимости от источника — сырая нефть Техаса несколько отличается от сырой нефти Саудовской Аравии. Фактически, анализ нефти из разных месторождений может дать «отпечатки пальцев» каждого из них, что полезно при отслеживании источников разлитой сырой нефти. Например, техасская сырая нефть является «сладкой», что означает, что она содержит небольшое количество серосодержащих молекул, тогда как сырая нефть Саудовской Аравии является «кислой», что означает, что она содержит относительно большое количество серосодержащих молекул.
Бензин
Нефть преобразуется в полезные продукты, такие как бензин, в три этапа: дистилляция, крекинг и риформинг. Напомним из главы 1, что дистилляция разделяет соединения на основе их относительной летучести, которая обычно обратно пропорциональна их температурам кипения. В части (а) на рис. 3.8.1 показан разрез колонны, используемой в нефтяной промышленности для разделения компонентов сырой нефти. Нефть нагревается примерно до 400°C (750°F) и становится смесью жидкости и пара. Эта смесь, называемая исходным сырьем, вводится в рафинировочную башню. Наиболее летучие компоненты (с самой низкой температурой кипения) конденсируются в верхней части колонны, где она холоднее, а менее летучие компоненты конденсируются ближе к низу. Некоторые вещества настолько нелетучи, что собираются на дне, не испаряясь вообще. Таким образом, состав жидкости, конденсирующейся на каждом уровне, различен. Эти разные фракции, каждая из которых обычно состоит из смеси соединений с одинаковым числом атомов углерода, отбираются отдельно. Часть (b) на рис. 3.8.1 показывает типичные фракции, собираемые на нефтеперерабатывающих заводах, количество содержащихся в них атомов углерода, их температуры кипения и их конечное использование. Эти продукты варьируются от газов, используемых в природном и баллонном газе, до жидкостей, используемых в горюче-смазочных материалах, до смолистых твердых веществ, используемых в качестве смолы на дорогах и крышах.
Нефть нагревается примерно до 400°C (750°F) и становится смесью жидкости и пара. Эта смесь, называемая исходным сырьем, вводится в рафинировочную башню. Наиболее летучие компоненты (с самой низкой температурой кипения) конденсируются в верхней части колонны, где она холоднее, а менее летучие компоненты конденсируются ближе к низу. Некоторые вещества настолько нелетучи, что собираются на дне, не испаряясь вообще. Таким образом, состав жидкости, конденсирующейся на каждом уровне, различен. Эти разные фракции, каждая из которых обычно состоит из смеси соединений с одинаковым числом атомов углерода, отбираются отдельно. Часть (b) на рис. 3.8.1 показывает типичные фракции, собираемые на нефтеперерабатывающих заводах, количество содержащихся в них атомов углерода, их температуры кипения и их конечное использование. Эти продукты варьируются от газов, используемых в природном и баллонном газе, до жидкостей, используемых в горюче-смазочных материалах, до смолистых твердых веществ, используемых в качестве смолы на дорогах и крышах.
Экономика нефтепереработки сложна. Например, потребность рынка в керосине и смазочных материалах намного ниже потребности в бензине, при этом все три фракции получают из ректификационной колонны в сопоставимых количествах. Кроме того, большинство бензинов и реактивного топлива представляют собой смеси с очень тщательно контролируемым составом, который не может изменяться, как исходное сырье. Чтобы сделать переработку нефти более прибыльной, менее летучие и низкоценные фракции превращаются в более летучие и более ценные смеси, состав которых тщательно контролируется. Первым процессом, используемым для осуществления этого превращения, является крекинг, при котором более крупные и тяжелые углеводороды в керосиновой и высококипящей фракциях нагреваются до температуры до 9°С.00°С. Высокотемпературные реакции вызывают разрыв углерод-углеродных связей, что превращает соединения в более легкие молекулы, подобные молекулам бензиновой фракции. Так, при крекинге алкан с прямой цепью с числом атомов углерода, соответствующим керосиновой фракции, превращается в смесь углеводородов с числом атомов углерода, соответствующим более легкой бензиновой фракции. Второй процесс, используемый для увеличения количества ценных продуктов, называется риформингом; это химическое превращение алканов с прямой цепью либо в алканы с разветвленной цепью, либо в смеси ароматических углеводородов. Использование таких металлов, как платина, вызывает необходимые химические реакции. Смеси продуктов крекинга и риформинга разделяют фракционной перегонкой.
Первым процессом, используемым для осуществления этого превращения, является крекинг, при котором более крупные и тяжелые углеводороды в керосиновой и высококипящей фракциях нагреваются до температуры до 9°С.00°С. Высокотемпературные реакции вызывают разрыв углерод-углеродных связей, что превращает соединения в более легкие молекулы, подобные молекулам бензиновой фракции. Так, при крекинге алкан с прямой цепью с числом атомов углерода, соответствующим керосиновой фракции, превращается в смесь углеводородов с числом атомов углерода, соответствующим более легкой бензиновой фракции. Второй процесс, используемый для увеличения количества ценных продуктов, называется риформингом; это химическое превращение алканов с прямой цепью либо в алканы с разветвленной цепью, либо в смеси ароматических углеводородов. Использование таких металлов, как платина, вызывает необходимые химические реакции. Смеси продуктов крекинга и риформинга разделяют фракционной перегонкой.
Октановое число
Качество топлива определяется его октановым числом, которое является мерой его способности сгорать в двигателе внутреннего сгорания без детонации или стука. Стук и стук сигнализируют о преждевременном сгорании (рис. 3.8.2), что может быть вызвано либо неисправностью двигателя, либо слишком быстрым сгоранием топлива. В любом случае бензино-воздушная смесь детонирует не в тот момент цикла двигателя, что снижает выходную мощность и может повредить клапаны, поршни, подшипники и другие компоненты двигателя. Различные составы бензина предназначены для получения смеси углеводородов, которая с наименьшей вероятностью вызовет детонацию или детонацию в двигателе данного типа, работающем на определенном уровне.
Стук и стук сигнализируют о преждевременном сгорании (рис. 3.8.2), что может быть вызвано либо неисправностью двигателя, либо слишком быстрым сгоранием топлива. В любом случае бензино-воздушная смесь детонирует не в тот момент цикла двигателя, что снижает выходную мощность и может повредить клапаны, поршни, подшипники и другие компоненты двигателя. Различные составы бензина предназначены для получения смеси углеводородов, которая с наименьшей вероятностью вызовет детонацию или детонацию в двигателе данного типа, работающем на определенном уровне.
Шкала октанового числа была установлена в 1927 году с использованием стандартного испытательного двигателя и двух чистых соединений: н-гептана и изооктана (2,2,4-триметилпентана). Октановое число н-гептану, вызывающему сильную детонацию при сгорании, было присвоено 0, в то время как изооктану, очень легко сгорающему топливу, было присвоено октановое число 100. Химики присваивают октановое число различным смесям бензина путем сжигание образца каждого из них в испытательном двигателе и сравнение наблюдаемой детонации с интенсивностью детонации, вызванной конкретными смесями н-гептана и изооктана. Например, октановое число смеси 89.% изооктана и 11% н-гептана — это просто среднее значение октановых чисел компонентов, взвешенных по относительным количествам каждого из них в смеси. Преобразовывая проценты в десятичные дроби, получаем октановое число смеси:
Октановое число н-гептану, вызывающему сильную детонацию при сгорании, было присвоено 0, в то время как изооктану, очень легко сгорающему топливу, было присвоено октановое число 100. Химики присваивают октановое число различным смесям бензина путем сжигание образца каждого из них в испытательном двигателе и сравнение наблюдаемой детонации с интенсивностью детонации, вызванной конкретными смесями н-гептана и изооктана. Например, октановое число смеси 89.% изооктана и 11% н-гептана — это просто среднее значение октановых чисел компонентов, взвешенных по относительным количествам каждого из них в смеси. Преобразовывая проценты в десятичные дроби, получаем октановое число смеси:
\[0,89(100) + 0,11(0) = 89 \label{3.8.1}\]
Как показано в таблице \(\PageIndex{1 }\), многие доступные в настоящее время соединения имеют октановое число выше 100, что означает, что они являются лучшим топливом, чем чистый изооктан. Кроме того, были разработаны антидетонаторы, также называемые октаноповышателями. Одним из наиболее широко используемых в течение многих лет был тетраэтилсвинец [(C 2 H 5 ) 4 Pb], что при концентрации примерно 3 г/гал дает увеличение октанового числа на 10–15 пунктов. Однако с 1975 года соединения свинца перестали использоваться в качестве присадок к бензину из-за их высокой токсичности. Вместо них были разработаны другие усилители, такие как метил-трет-бутиловый эфир (МТБЭ). Они сочетают в себе высокое октановое число и минимальную коррозию деталей двигателя и топливной системы. К сожалению, когда бензин, содержащий МТБЭ, вытекает из подземных резервуаров для хранения, это приводит к загрязнению грунтовых вод в некоторых местах, что приводит к ограничению или прямому запрету на использование МТБЭ в определенных районах. В результате увеличивается использование альтернативных усилителей октанового числа, таких как этанол, который можно получить из возобновляемых ресурсов, таких как кукуруза, сахарный тростник и, в конечном счете, кукурузные стебли и травы.
Одним из наиболее широко используемых в течение многих лет был тетраэтилсвинец [(C 2 H 5 ) 4 Pb], что при концентрации примерно 3 г/гал дает увеличение октанового числа на 10–15 пунктов. Однако с 1975 года соединения свинца перестали использоваться в качестве присадок к бензину из-за их высокой токсичности. Вместо них были разработаны другие усилители, такие как метил-трет-бутиловый эфир (МТБЭ). Они сочетают в себе высокое октановое число и минимальную коррозию деталей двигателя и топливной системы. К сожалению, когда бензин, содержащий МТБЭ, вытекает из подземных резервуаров для хранения, это приводит к загрязнению грунтовых вод в некоторых местах, что приводит к ограничению или прямому запрету на использование МТБЭ в определенных районах. В результате увеличивается использование альтернативных усилителей октанового числа, таких как этанол, который можно получить из возобновляемых ресурсов, таких как кукуруза, сахарный тростник и, в конечном счете, кукурузные стебли и травы.
| Имя | Концентрированная структурная формула | Октановое число | Имя | Концентрированная структурная формула | Октановое число |
|---|---|---|---|---|---|
| n -гептан | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 | 0 | o — ксилол | скелетная структура о-ксилола.cdxml | 107 |
| n -гексан | CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 | 25 | этанол | CH 3 CH 2 OH | 108 |
| n -пентан | CH 3 CH 2 CH 2 CH 2 CH 3 | 62 | т -спирт бутиловый | (CH 3 ) 3 COH | 113 |
| изооктан | (CH 3 ) 3 CCH 2 CH(CH 3 ) 2 | 100 | р -ксилол | 116 | |
| бензол | 106 | метил т бутиловый эфир | H 3 КОК(CH 3 ) 3 | 116 | |
| метанол | CH 3 ОН | 107 | толуол | 118 |
3. 8: Бензин — Более глубокий взгляд распространяется под лицензией CC BY-SA 4.0, автором, ремиксом и/или куратором выступили Стивен Фармер, Дитмар Кеннеполь, Криста Каннингем и Криста Каннингем.
8: Бензин — Более глубокий взгляд распространяется под лицензией CC BY-SA 4.0, автором, ремиксом и/или куратором выступили Стивен Фармер, Дитмар Кеннеполь, Криста Каннингем и Криста Каннингем.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Теги
- автор@Дитмар Кеннеполь
- автор@Криста Каннингем
- автор@Стивен Фармер
- бензин
- Октановая шкала
- нефть
- тетраэтилсвинец
Формула октана.
 Структура, свойства, применение, примеры вопросов
Структура, свойства, применение, примеры вопросовОктан – это углеводород, состоящий из атомов углерода и водорода. Формула октана C 8 H 18 . Большинство групп углеводородов содержится в нефти. Октан имеет много структурных изомеров, но они различаются в зависимости от количества и расположения разветвлений в углеродной цепи. Он содержится в сырой нефти и открыт Эдвином Л. Дрейком в августе 1859 года.
Углерод
Углерод представляет собой химический элемент, представленный символом C. Его атомный номер равен 6. Электронная структура углерода 1s 2 2s 2 2p 2 с четырьмя валентными электронами. Это важный элемент, потому что он играет очень важную роль в реальной жизни. Углерод можно найти во всех живых структурах. Его соединения встречаются повсюду в реальной жизни, например, в боли, лекарствах, пластмассах, хлопке, шерсти, угле и т. д. Генри Кавендиш в 1766 году. Естественно, водород существует в молекулярной форме, это самый распространенный элемент на земле. Это самый легкий элемент, и его можно использовать в топливных элементах для выработки энергии. Водород необходим для жизни, без этого элемента у нас не было бы солнца, дающего нам свет и тепло. Он имеет три изотопа: водород, дейтерий, тритий.
Это самый легкий элемент, и его можно использовать в топливных элементах для выработки энергии. Водород необходим для жизни, без этого элемента у нас не было бы солнца, дающего нам свет и тепло. Он имеет три изотопа: водород, дейтерий, тритий.
Октан
Октан представляет собой углеводород и алкан с химической формулой C 8 H 18 . Это химическое вещество, содержащееся в бензине или бензине и используемое для измерения качества топлива. Это бесцветная жидкость с запахом бензина, это летучая и легко воспламеняющаяся бесцветная жидкость. его рейтинги измеряются способностью топлива избегать детонации, детонация возникает, когда топливо постоянно воспламеняется в цилиндре двигателя, что снижает эффективность и может повредить двигатель, топливо содержит оксигенат, который предотвращает детонацию за счет добавления кислорода в топливо. , этот оксигенат обычно называют октаном.
Структура октана
Сокращенная структурная формула октана: CH 3 (CH 2 ) 6 CH 3 .
Физические свойства
- Молярная масса 114,23 г/моль
- Температура кипения 125,6°C
- Плотность m 3
- Легковоспламеняющаяся бесцветная жидкость.
- Это бесцветная жидкость с запахом бензина
Химические свойства
Углеводороды встречаются в природе во многих формах, в основном в виде жидкой нефти, они известны как сырая нефть, чтобы отличить ее от очищенной нефти, это наиболее важная Технически природный газ, представляющий собой более легкую фракцию углеводородов, может быть свободным или растворенным асфальтом, гудроном, пеком, представляет собой твердые или полутвердые формы углеводородов тяжелой фракции.
Использование октана
- Используется в качестве растворителя.
- Используется как химическое сырье.
- Он используется в качестве важного химического агента в нефтяной промышленности.
- Используется как компонент бензина.

- Октановое число используется для определения качества топлива.
Примеры вопросов
Вопрос 1: Сколько изомеров содержится в октане?
Ответ:
Октан имеет 18 изомеров. Это октан, 2-метилгептан, 3-метилгептан, 4-метилгептан, 2,2-диметилгексан, 2,3-диметилгексан, 2,4-диметилгексан, 2,5-диметилгексан, 3,3-диметилгексан, 3,4- Диметилгексан, 3-этилгексан, 2,2,3-триметилпентан, 2,2,4-триметилпентан, 2,3,3-триметилпентан, 2,2,4-триметилпентан, 2-метил-3-этилпентан, 3-метил- 3-этилпентан, тетраметилбутан, из них 15 позиционных изомеров и 3 стереоизомера.
Эти изомеры отличаются количеством и расположением разветвлений в углеродной цепи.
Вопрос 2: Какое соединение используется для расчета цетанового числа?
Ответ:
Молекула цетана используется для расчета цетанового числа по формуле C 16 H 34 .
Это насыщенный углеводород, который имеет очень короткую задержку воспламенения по сравнению с любым коммерческим дегерметизирующим топливом. Его цетановое число равно 100. Цетановое число представляет собой процентиль цетана в смеси цетана и α-метилнафталина.
Вопрос 3: Что используется для снижения поверхностного натяжения в дегерметизирующем топливе?
Ответ:
Химические присадки используются для снижения поверхностного натяжения, что способствует образованию более тонкого распыления. Ингибиторы используются для замедления или предотвращения образования смолы, а полиуглеводороды используются для сохранения свойств жидкости.
Вопрос 4: какое соединение используется для расчета октанового числа?
Ответ:
Октановое число — это число, которое используется для определения качества бензинового топлива. Были выбраны два чистых углеводорода, оклеветанные Эджером
- н-гептан
- изооктан
Октановое число изооктана равно 100, а октановое число н-гептана равно 0.
Октановое число топлива равно численно принято как процентное содержание изооктана в смеси изооктана и н-гептана.
Вопрос 5: Какова молярная масса октана? Как рассчитать?
Ответ:
5Молярная масса октана 114,23 г/моль. Атомная масса углерода 12,0107. Число атомов в углероде равно 8. Атомная масса водорода равна 1,00794. Число атомов в водороде равно 18.
Наконец, вычисление молекулярной массы = 12,0107 × 8 + 1,00794 × 18
= 96,0856 + 18,14292
= 114,22852
Ответ:
Октан принадлежит к семейству молекул, называемых алканами. Это молекулы углеводородов только с одинарными двухэлектронными связями, соединяющими атомы. Существует целый ряд их с возрастающим числом атомов углерода.
Примерами алканов являются метан, этан, пропан и т. д.
Вопрос 7: Что такое детонация?
Ответ:
Это резкий дребезжащий звук, издаваемый в двигателе внутреннего сгорания из-за неполного воспламенения воздушно-бензиновой смеси.
Давление некоторых компонентов в используемом бензине вызывает настолько большую скорость окисления, что потерянная часть топливно-воздушной смеси мгновенно воспламеняется, вызывая взрывную силу, называемую детонацией.
углеводород | Определение, типы и факты
структуры обычных углеводородных соединений
Смотреть все СМИ
- Ключевые люди:
- Пьер-Эжен-Марселлен Бертло Джордж А. Ола Шарль-Адольф Вюрц
- Похожие темы:
- стирол бензол олефин ксилол нафталин
Просмотреть весь соответствующий контент →
Самые популярные вопросы
Что такое углеводород?
Углеводород – это любой класс органических химических веществ, состоящий только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях.
химическое соединение
Узнайте больше о химических соединениях.
Какие углеводороды наиболее широко используются в современной жизни?
Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
нефть
Узнайте больше о нефти.ископаемое топливо
Узнайте больше об ископаемом топливе.Существуют ли разные типы углеводородов?
- Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств.
- Алифатические (от греческого aleiphar , «жир») углеводороды, получаемые в результате химического распада жиров или масел. Они делятся на алканы, алкены и алкины.
- Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь.

- Ароматические углеводороды составляют группу родственных веществ, получаемых путем химического разложения экстрактов некоторых приятно пахнущих растений. Их относят либо к аренам, содержащим в качестве структурной единицы бензольное кольцо, либо к небензольным ароматическим углеводородам, обладающим особой стабильностью, но не содержащим бензольного кольца.
ароматическое соединение
Узнайте больше об ароматических соединениях.Как использование углеводородов влияет на глобальное потепление и изменение климата?
Углеводороды составляют ископаемое топливо. Одним из основных побочных продуктов сжигания ископаемого топлива является двуокись углерода (CO 2 ). Постоянно растущее использование ископаемого топлива в промышленности, на транспорте и в строительстве добавило в атмосферу Земли большое количество CO 2 . Атмосферный CO 2 концентрации колебались между 275 и 290 частей на миллион по объему (ppmv) сухого воздуха между 1000 г. н.э. и концом 18 века, но увеличилось до 316 ppmv к 1959 г. и выросло до 412 ppmv в 2018 г. CO 2 ведет себя как парниковый газ, т. е. поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
н.э. и концом 18 века, но увеличилось до 316 ppmv к 1959 г. и выросло до 412 ppmv в 2018 г. CO 2 ведет себя как парниковый газ, т. е. поглощает инфракрасное излучение (чистую тепловую энергию), испускаемое с поверхности Земли, и повторно излучает его обратно на поверхность. Таким образом, значительное увеличение содержания CO 2 в атмосфере является основным фактором, способствующим глобальному потеплению, вызванному деятельностью человека.
глобальное потепление
Узнайте больше о глобальном потеплении.изменение климата
Узнайте больше об изменении климата.Резюме
Прочтите краткий обзор этой темы
углеводород , любое из класса органических химических соединений, состоящих только из элементов углерода (C) и водорода (H). Атомы углерода соединяются вместе, образуя каркас соединения, а атомы водорода присоединяются к ним во многих различных конфигурациях. Углеводороды являются основными составляющими нефти и природного газа. Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Они служат топливом и смазочными материалами, а также сырьем для производства пластмасс, волокон, каучуков, растворителей, взрывчатых веществ и промышленных химикатов.
Многие углеводороды встречаются в природе. Помимо того, что они составляют ископаемое топливо, они присутствуют в деревьях и растениях, как, например, в виде пигментов, называемых каротинами, которые встречаются в моркови и зеленых листьях. Более 98 процентов натурального сырого каучука представляет собой углеводородный полимер, цепочечную молекулу, состоящую из множества связанных друг с другом звеньев. Структура и химический состав отдельных углеводородов в значительной степени зависят от типов химических связей, связывающих вместе атомы составляющих их молекул.
Химики девятнадцатого века классифицировали углеводороды как алифатические или ароматические на основе их источников и свойств. Алифатические (от греческого aleiphar , «жир») описывают углеводороды, полученные путем химического разложения жиров или масел. Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но описываемые ими соединения различаются на основе структуры, а не происхождения.
Ароматические углеводороды представляют собой группу родственных веществ, полученных путем химической деградации некоторых приятно пахнущих растительных экстрактов. Термины алифатические и ароматические сохранены в современной терминологии, но описываемые ими соединения различаются на основе структуры, а не происхождения.
Алифатические углеводороды делятся на три основные группы в зависимости от типа содержащихся в них связей: алканы, алкены и алкины. Алканы имеют только одинарные связи, алкены содержат двойную углерод-углеродную связь, а алкины содержат тройную углерод-углеродную связь. Ароматические углеводороды — это те, которые значительно более стабильны, чем можно было бы предположить по их структуре Льюиса; обладают «особой устойчивостью». Они классифицируются либо как арены, содержащие в качестве структурной единицы бензольное кольцо, либо как небензольные ароматические углеводороды, обладающие особой стабильностью, но не имеющие в качестве структурной единицы бензольного кольца.
Эта классификация углеводородов помогает связать структурные особенности со свойствами, но не требует отнесения конкретного вещества к одному классу. Действительно, молекула обычно включает структурные единицы, характерные для двух или более семейств углеводородов. Молекула, которая содержит как тройную углерод-углеродную связь, так и бензольное кольцо, например, будет проявлять некоторые свойства, характерные для алкинов, и другие, характерные для аренов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Алканы описываются как насыщенные углеводороды, а алкены, алкины и ароматические углеводороды считаются ненасыщенными.
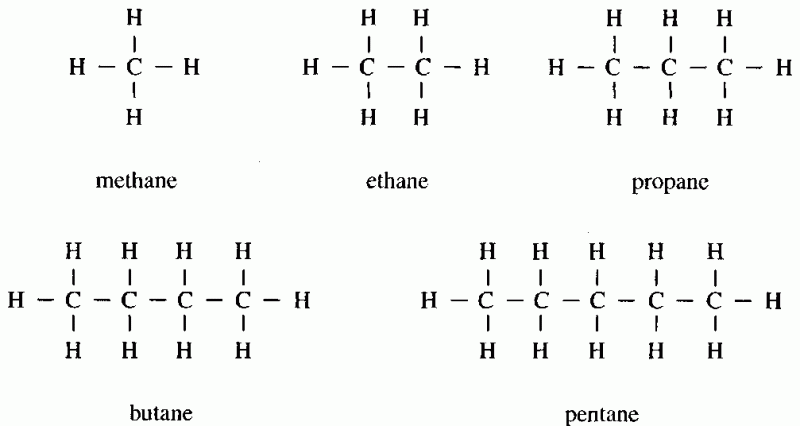
Алканы, углеводороды, в которых все связи одинарные, имеют молекулярные формулы, удовлетворяющие общему выражению C n H 2 n + 2 (где n — целое число). Углерод с p 3 гибридизованы (три пары электронов участвуют в связывании, образуя тетраэдрический комплекс), и каждая связь С—С и С—Н является сигма (σ) связью ( см. химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
химическая связь). В порядке увеличения числа атомов углерода метан (CH 4 ), этан (C 2 H 6 ) и пропан (C 3 H 8 ) являются первыми тремя членами ряда.
Метан, этан и пропан — единственные алканы, однозначно определяемые своей молекулярной формулой. Для С 4 H 10 два разных алкана удовлетворяют правилам химической связи (а именно, углерод имеет четыре связи, а водород — одну в нейтральных молекулах). Одно соединение, называемое n -бутан, где префикс n — означает нормальный, имеет четыре атома углерода, связанные в непрерывную цепь. Другой, называемый изобутаном, имеет разветвленную цепь.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами. Изомеры, различающиеся порядком соединения атомов, имеют разное строение и называются конституциональными изомерами. (Старое название — структурные изомеры.) Соединения n -бутан и изобутан являются конституциональными изомерами и являются единственными возможными для формулы C 4 H 10 . Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Поскольку изомеры — это разные соединения, они могут иметь разные физические и химические свойства. Например, n -бутан имеет более высокую температуру кипения (-0,5 ° C [31,1 ° F]), чем изобутан (-11,7 ° C [10,9 ° F]).
Не существует простой арифметической зависимости между количеством атомов углерода в формуле и количеством изомеров. Теория графов использовалась для расчета количества конституционно-изомерных алканов, возможных для значений 9.0103 n в C n H 2 n + 2 от 1 до 400. Число конституциональных изомеров резко возрастает с увеличением числа атомов углерода. Верхнего предела возможного числа атомов углерода в углеводородах, вероятно, не существует. В качестве примера так называемого сверхдлинного алкана синтезирован алкан СН 3 (СН 2 ) 388 СН 3 , в котором 390 атомов углерода связаны в непрерывную цепь. Несколько тысяч атомов углерода соединены вместе в молекулах углеводородных полимеров, таких как полиэтилен, полипропилен и полистирол.
| молекулярная формула | количество конституциональных изомеров |
|---|---|
| С 3 Н 8 | 1 |
| С 4 Н 10 | 2 |
| С 5 Н 12 | 3 |
| С 6 Н 14 | 5 |
| С 7 Н 16 | 9 |
| С 8 Н 18 | 18 |
| С 9 Н 20 | 35 |
| С 10 Н 22 | 75 |
| С 15 Н 32 | 4347 |
| С 20 Н 42 | 366 319 |
| С 30 Н 62 | 4 111 846 763 |
Необходимость дать каждому соединению уникальное название требует большего разнообразия терминов, чем доступно с описательными префиксами, такими как n — и изо-. Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Называние органических соединений облегчается за счет использования формальных систем номенклатуры. Номенклатура в органической химии бывает двух типов: общепринятая и систематическая. Распространенные имена возникают по-разному, но у них есть общая черта: между именем и структурой нет необходимой связи. Имя, соответствующее определенной структуре, нужно просто запомнить, подобно тому, как выучить имя человека. С другой стороны, систематические названия связаны непосредственно с молекулярной структурой в соответствии с общепринятым набором правил. Наиболее широко используемые стандарты номенклатуры органических веществ возникли на основе предложений группы химиков, собравшихся для этой цели в Женеве в 189 г.2 и регулярно пересматриваются Международным союзом теоретической и прикладной химии (IUPAC). Правила IUPAC регулируют все классы органических соединений, но в конечном итоге основаны на названиях алканов. Соединения других семейств рассматриваются как производные от алканов путем добавления функциональных групп к углеродному скелету или иным образом модифицирующих его.
Правила ИЮПАК присваивают названия неразветвленным алканам в соответствии с числом их атомов углерода. Метан, этан и пропан сохраняются для CH 4 , СН 3 СН 3 и СН 3 СН 2 СН 3 соответственно. Префикс n — не используется для неразветвленных алканов в систематической номенклатуре IUPAC; следовательно, CH 3 CH 2 CH 2 CH 3 определяется как бутан, а не n -бутан. Названия неразветвленных алканов, начиная с пятиуглеродных цепей, состоят из латинской или греческой основы, соответствующей количеству атомов углерода в цепи, за которой следует суффикс -ан. Группа соединений, таких как неразветвленные алканы, которые отличаются друг от друга последовательным введением CH 2 группы составляют гомологический ряд.
| формула алкана | имя | формула алкана | имя |
|---|---|---|---|
| СН 4 | метан | СН 3 (СН 2 ) 6 Ч 3 | октановое число |
| СН 3 СН 3 | этан | СН 3 (СН 2 ) 7 СН 3 | нонан |
| СН 3 СН 2 СН 3 | пропан | СН 3 (CH 2 ) 8 CH 3 | деканировать |
| СН 3 СН 2 СН 2 СН 3 | бутан | СН 3 (СН 2 ) 13 СН 3 | пентадекан |
| СН 3 (СН 2 ) 3 СН 3 | пентан | СН 3 (СН 2 ) 18 СН 3 | икозан |
| СН 3 (СН 2 ) 4 СН 3 | гексан | СН 3 (СН 2 ) 28 СН 3 | триаконтан |
| СН 3 (СН 2 ) 5 СН 3 | гептан | СН 3 (СН 2 ) 98 СН 3 | гектан |
Алканы с разветвленными цепями названы на основе названия самой длинной цепочки атомов углерода в молекуле, называемой материнской. Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
Показанный алкан имеет семь атомов углерода в самой длинной цепи и поэтому назван производным от гептана, неразветвленного алкана, содержащего семь атомов углерода. Положение СН 3 (метильный) заместитель в семиуглеродной цепи обозначается числом (3-), называемым локантом, полученным путем последовательной нумерации атомов углерода в исходной цепи, начиная с конца, расположенного ближе к ответвлению. Поэтому это соединение называют 3-метилгептаном.
При наличии двух или более идентичных заместителей используются повторяющиеся префиксы (ди-, три-, тетра- и т. д.) вместе с отдельным локантом для каждого заместителя. Различные заместители, такие как этил (―CH 2 CH 3 ) и метильную (―CH 3 ) группы приведены в алфавитном порядке. Реплицирующиеся префиксы игнорируются при упорядочении по алфавиту. В алканах нумерация начинается с конца, ближайшего к заместителю, который появляется первым в цепи, так что углерод, к которому он присоединен, имеет как можно более низкий номер.