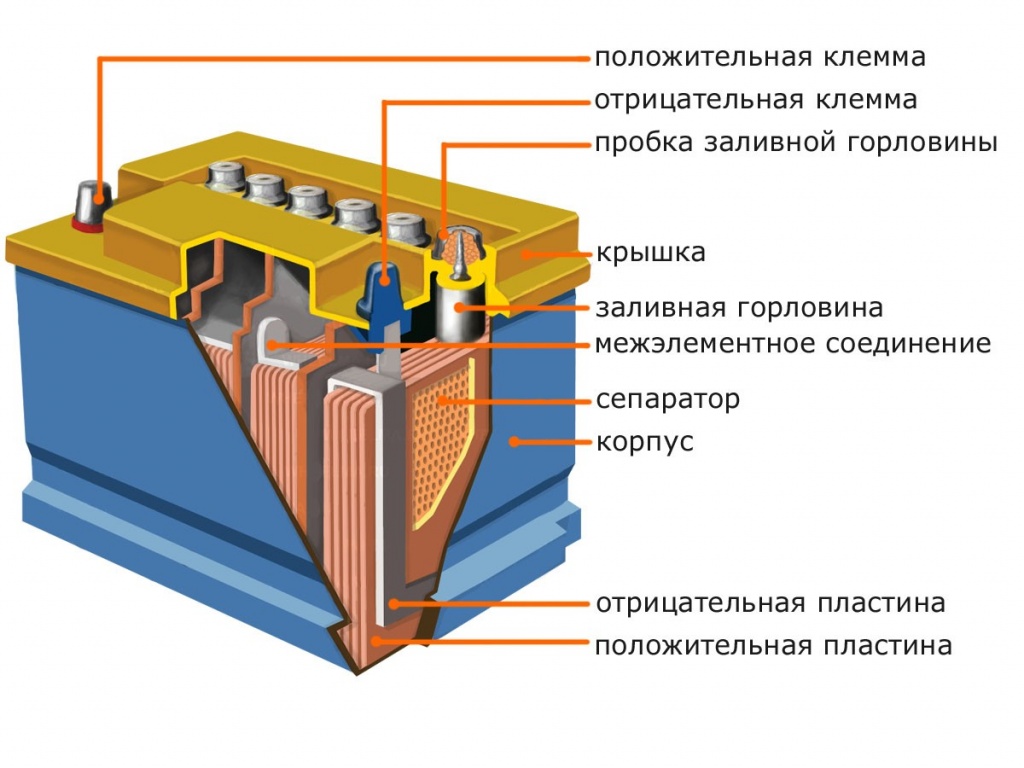
Устройство и параметры свинцово-кислотных аккумуляторов — принцип работы
Основная доля на рынке по-прежнему остается у свинцово-кислотных аккумуляторов. Это обусловлено простотой конструкции и невысокой ценой. Применяемых в них принцип используется многие десятки лет, но со временем он претерпевает разные изменения по увеличению емкости, росту энергетических характеристик и долговечности. Так, например, введение в свинцовый сплав легирующих добавок привело к росту многих практических показателей. Рассмотрим подробнее свинцовый аккумулятор и разберемся с особенностями его работы на химическом и физическом уровнях.
Конструкция АКБ
Устройство свинцово-кислотного аккумулятора не является загадкой. Условно в его конструкции имеется всего три компонента. Это корпус, энергетические ячейки и электролит, но, казалось бы, такое простое устройство постоянно изменяется, водятся какие-то добавки и дополнительные элементы, способствующие росту характеристик. Рассмотрим более подробно, из чего состоит аккумулятор:
- Снаружи имеется защитная герметичная оболочка, изготовленная из прочного кислотостойкого пластика.
 Внутри она разделена на отсеки, в каждой из которых находится электродная пара. Для повышения прочности корпус оснащен внутренними ребрами жесткости. Он должен быть герметичным, так как внутренняя среда способна сильно навредить окружающей. В самых бюджетных модификациях аккумуляторов типа WET также присутствуют пробки для доливки жидкости.
Внутри она разделена на отсеки, в каждой из которых находится электродная пара. Для повышения прочности корпус оснащен внутренними ребрами жесткости. Он должен быть герметичным, так как внутренняя среда способна сильно навредить окружающей. В самых бюджетных модификациях аккумуляторов типа WET также присутствуют пробки для доливки жидкости. - В каждой ячейке находятся электродные решетки. Они представляют собой пары разнополюсных пластин, которые чередуются. Положительные и отрицательные закреплены к токовым шинам. Электроды — в виде решеток с окном определенного размера и формы. В ранних моделях батарей их изготавливали методом литья под высоким давлением. В современных для введения легирующих добавок их производят методом штампования и ковки. Введение сурьмы и кальция увеличили стойкости к глубоким разрядам, отдачи высоких токов и продлению срока службы.
- В электродных решетках содержится активная паста. На положительных — оксид свинца, на отрицательных — губчатая свинцовая масса.
 Активная паста накапливает заряд и обеспечивает свободное перемещение электронов между пластинами. Один из электродов изолировано сепаратором, необходимый для исключения возникновения короткого замыкания между банками, когда начнет обсыпаться активная паста.
Активная паста накапливает заряд и обеспечивает свободное перемещение электронов между пластинами. Один из электродов изолировано сепаратором, необходимый для исключения возникновения короткого замыкания между банками, когда начнет обсыпаться активная паста. - В конструкции свинцового аккумулятора имеется 6 энергетических ячеек, которые соединены последовательно. Это сделано для того, чтобы получилось требуемое напряжение 12 В, потому что одна ячейка выдает всего 2 В. Токосъемные электроды вынесены в крышку корпуса батареи. Могут быть в виде конусовидных клемм, лепестков, болтов или углублений под болты. В зависимости от страны производителя и первоначального назначения, АКБ могут быть оборудованы клеммами сверху или на боковой стороне.
Особенности корпуса
Корпус, как и конфигурация клемм, бывает нескольких типов в зависимости от того, для какой машины страны был изготовлен источник постоянного тока. Можно разделить:
- на американские с резьбовыми клеммами;
- европейские с технологическим выступом для фиксации на штатном месте в нижней и верхней части;
- азиатские без выступов и клеммы выступают за пределы крышки, что указывает на особенности подключения батареи.
В моделях EFB-типа, это усовершенствованные классические свинцово-кислотные аккумуляторы, применена технология рециркуляции испарений электролита. Сам при этом источник тока считается необслуживаемым, то есть в него не нужно добавлять жидкость. Обычно электролит испаряется во время заряда батареи постоянным током или при потреблении больших токов. Это приводит к нагреву, и кислота начинает испаряться. Поднимаемый пар оседает на внутренней стороне крышки и охлаждается там, обратно сворачиваясь в жидкость и возвращаясь обратно в корпус.
На случай, если внутреннее давление критически возрастет, автоматически откроется спускной клапана. Он есть не на всех моделях батарей, но на всех современных источниках. Его наличие позволяет исключить возникновение аварии в случае перегрева или перегрузки.
Легирование пластин
В общем, конструкция всех модификаций свинцово-кислотных автомобильных аккумуляторов одинаковая. Это касается как стартерных, так и тяговых с большими рабочими токами, которые могут генерироваться в течение длительного времени.
- коррозия электродов;
- высокая чувствительность к глубоким разрядам;
- саморазряд;
- утечка электролита и его проникновение опасных испарений в окружающую атмосферу;
- малый срок службы и др.
Все это искоренить, конечно, не получается по многочисленным причинам, но несколько продлить срок эксплуатации АКБ, увеличить отдаваемый ею ток реально. Для этого разработчики стали экспериментировать с составом активной пасты, конструкцией электродов и сплавом, из которого они изготовлены.
В результате проб и ошибок было определено, что в сплав следует добавлять сурьму и кальций. Такой источник получил название гибридный. Сурьма снизила чувствительность к глубоким разрядам, а кальций продлили срок службы, так как он препятствует разрушению свинца. А для получения больших токов в производстве аккумуляторов применяют чистый свинцовый сплав.
Применяют следующие типы легирования:
- сурьма-свинец;
- сурьма-кальций;
- кальций-кальций;
- серебро-кальций.
Электродные решетки изготавливают цельнолитыми, то есть, льют в форму под высоким давлением и штампованными. В первом случае из-за высоких температур возможно легирование только добавление сурьмы. Она придает пластинам повышенную прочность и при ее введении электролит начинает закипать уже при 12 В. Для продления срока службы и сохранения высоких токов отдачи в свинцовый сплав стали добавлять кальций.
Такие решетки производятся преимущественно методом штампования. Второй электрод остается сурьмянистым. Комбинация металлов увеличивает срок службы и отдаваемее токи. Так, например, обычной свинцово-кислотный аккумулятор с сурьмянистым легированием работает не более 3 лет. Аккумуляторы с кальцием и сурьмой служат вдвое дольше, поэтому и дороже.
Электролит
В свинцово-кислотных аккумуляторах производители применяют 3 типа электролита в зависимости от его состояния:
- Жидкий — привычный всем раствор серной кислоты. Батареи токсичны при зарядке и опасны при аварии, так как кислота попадет в окружающую атмосферу.
- В капиллярном виде в абсорбере. Он представляет собой пористый материал со множеством пустот, которые заполняются кислотой. Так как материал пропитан, то даже при повороте источника постоянного тока вверх ногами батарея не перестанет работать.
- Гелеобразный — тип электролита в виде оксида кремния. Это густая малоподвижная масса, которая надежно обволакивает пластины со всех сторон, обеспечивая максимальный контакт и токоотдачу. Именно поэтому эти батареи обладают самыми высокими пусковыми токами и огромным сроком службы. Производитель заявляет о 12 годах работы.
Принцип работы
Работа автомобильного свинцово-кислотного аккумулятора основан на двойном преобразовании. В процессе зарядки электрическая энергия в виде тока и напряжения преобразуется в химическую. Во время штатной работы процесс оборачивается, и химическая реакция выделяет ток на зажимах при замыкании цепи. Во время заряда происходит процесс восстановления пластин АКБ и заполнения пустых ест в активной пасте положительно заряженными на плюсовом контакте и отрицательно заряженными частицами на минусовом.
В процессе зарядки электрическая энергия в виде тока и напряжения преобразуется в химическую. Во время штатной работы процесс оборачивается, и химическая реакция выделяет ток на зажимах при замыкании цепи. Во время заряда происходит процесс восстановления пластин АКБ и заполнения пустых ест в активной пасте положительно заряженными на плюсовом контакте и отрицательно заряженными частицами на минусовом.
Когда пользователь смыкает цепь, начинается преобразование химической энергии в электрическую, то есть, положительные частицы переходят на отрицательную обкладку с выделением определенного количества энергии через нагрузку. Величина этой энергии и ток зависят от сопротивления в нагрузке.
Пластины
Казалось бы, такая часть АКБ, как электродная пластина, может разнится от одной линейки батареи к другой. Существует две основных технологии производства пластин, но также есть и разные архитектурные решения, которые неизбежно влияют на работу батареи в целом. Простая прямоугольная решетка уже давно не используется. Применяют лучевые конструкции, так как при такой конфигурации токи лучше распределяются по пластине, обеспечивая ее равномерную выработку. В производстве применяются следующие технологии:
Применяют лучевые конструкции, так как при такой конфигурации токи лучше распределяются по пластине, обеспечивая ее равномерную выработку. В производстве применяются следующие технологии:
- Expandet metal — штамповка с просечкой и вытягиванием;
- Power Frame — в конструкции таких пластин присутствует опорная рамка, внутри которой находятся тонкие жилки.
- Power Pass — в такой архитектуре вертикально расположенные жилки направлены к ушкам пластин.
- Chess Plate — применена шахматная архитектура устройства пластин.
Что такое сульфация?
Важно знать о том, что свинцово-кислотные аккумуляторы со временем изнашиваются. В них появляется выработка, а на пластинах возникают различные наросты. Одним из подобных состояний является сульфация пластин. Он возникает в результате окисления активной пасты в результате длительного нахождения в разряженном состоянии. Белый налет становится настоящим диэлектриком, через который электроны неспособны просочиться. Данное состояние присуще батареям, которые регулярно разряжаются до 80% от начального состояния и долго находятся в таком виде. Существует технология удаления этого налета. Она заключается в зарядке импульсными зарядными и разрядными токами.
Данное состояние присуще батареям, которые регулярно разряжаются до 80% от начального состояния и долго находятся в таком виде. Существует технология удаления этого налета. Она заключается в зарядке импульсными зарядными и разрядными токами.
Статью подготовил:
Интернет-магазин AKBMOSCOW
§42. Кислотные аккумуляторы | Электротехника
Принцип действия. Аккумулятором называется химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от
Рис. 158. Заряд (а) и разряд (б) аккумулятора
постороннего источника (рис. 158,а). Этот процесс, называемый зарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 158, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.
На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы, которые имеют значительно больший срок службы, чем кислотные. Кислотные аккумуляторы ТН-450 применяют только на тепловозах, они имеют емкость 450 А*ч, номинальное напряжение — 2,2 В. Аккумуляторная батарея 32 ТН-450 состоит из 32 последовательно соединенных аккумуляторов; буква Т означает, что батарея установлена на тепловозе, буква Н — тип положительных пластин (намазные).
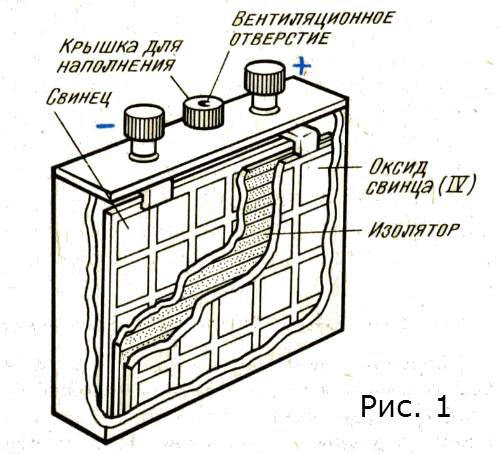
Устройство. В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда.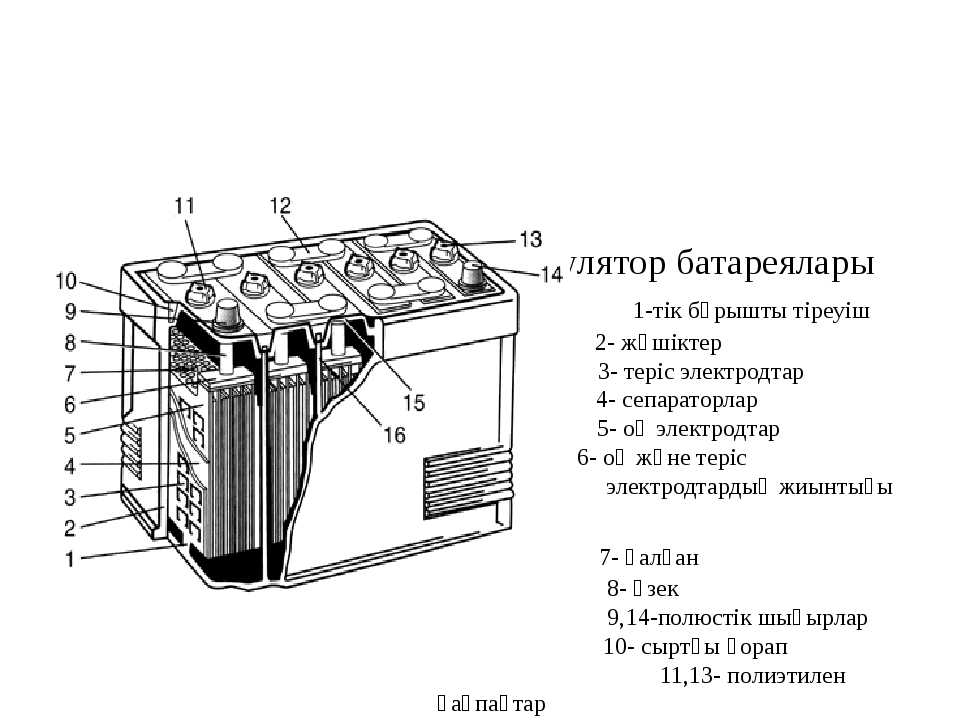 Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
Пластины аккумулятора могут иметь конструкцию поверхностного или намазного типа. Пластины поверхностного типа отливают из свинца; поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию ребер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
В аккумуляторных батареях тепловозов применяют пластины намазного типа (рис. 159, а). Такие пластины имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой.
Ячейки пластин после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий. Эти листы предотвращают возможность выпадания из пластин активной массы и не препятствуют в то же время доступу к ней электролита.
Исходным материалом для изготовления пасты для положительных пластин служит порошок свинца Pb, а для отрицательных— порошок , перекиси свинца PbO2, которые замешиваются на водном растворе серной кислоты. Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемые расширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Намазные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массы и размеров аккумулятора и позволяет получать при разряде большие токи.
Рис. 159. Устройство пластин (а) и общий вид (б) кислотного аккумулятора: 1 — блок намазных отрицательных пластин; 2 — выводные штыри; 3 — блок панцирных положительных пластин; 4 — панцирь; 5 — активная масса; 6 — отверстие с пробкой для заливки электролита; 7 — крышка; 8 — эбонитовый сосуд; 9 — пространство для осаждения шлама
Устройство пластин (а) и общий вид (б) кислотного аккумулятора: 1 — блок намазных отрицательных пластин; 2 — выводные штыри; 3 — блок панцирных положительных пластин; 4 — панцирь; 5 — активная масса; 6 — отверстие с пробкой для заливки электролита; 7 — крышка; 8 — эбонитовый сосуд; 9 — пространство для осаждения шлама
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2 и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
В некоторых аккумуляторах применены положительные пластины панцирного типа. В них каждая положительная пластина заключена в специальный панцирь (чехол) из эбонита или стеклоткани. Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 159,б) так, чтобы между каждыми двумя
Рис. 160. Прохождение через электролит положительных и отрицательных ионов при разряде (а) и заряде (б) кислотного аккумулятора
пластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
Разряд и заряд. При разряде аккумулятора (рис. 160, а) положительные ионы H2+ и отрицательные ионы кислотного остатка
S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному
1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает
разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи.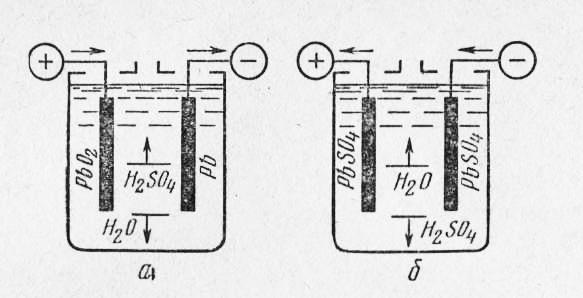 В результате
В результате
электрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2 положительного
электрода и ионов сернокислого остатка S04— со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04— — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
PbO2 + Pb + 2H2SO4 ? 2PbSO4 + 2H2O
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Номинальный разрядный ток численно равен 0,1СНОМ, максимальный при запуске дизеля (стартерный режим) — примерно 3СНОМ, зарядный ток — 0,2 СНОМ, где СНОМ — номинальная емкость.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8—1,7 В (рис. 161), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстанавливается до среднего значения 2 В. Это явление носит название «отдыха» аккумулятора. При нагрузке подобного «отдохнувшего» аккумулятора напряжение быстро понижается, поэтому измерение напряжения аккумулятора без нагрузки не дает правильного суждения о степени разряда.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6—2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
Уход за аккумуляторами. Кислотные аккумуляторы быстро теряют емкость или даже приходят в полную негодность при
Рис. 161. Кривые напряжения кислотного аккумулятора при заряде и разряде
неправильной эксплуатации. В них происходит саморазряд, в результате которого они теряют свою емкость (примерно 0,5— 0,7 % в сутки). Для компенсации саморазряда неработающие аккумуляторные батареи необходимо периодически подзаряжать. При загрязнении электролита, а также крышек аккумуляторов, их выводов и междуэлементных соединений происходит повышенный саморазряд, быстро истощающий батарею.
Батарея аккумулятора должна быть всегда чистой, а выводы для предохранения от окисления покрыты тонким слоем технического вазелина. Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.
Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.
Свинцово-кислотная батарея, рабочие преимущества и недостатки
Краткое описание
Батарея представляет собой электрическое устройство, хранящее химическую энергию, которая может быть преобразована в электрическую энергию. Это устройство накопления энергии, которое производит электричество, подключая свои клеммы к электрическому гаджету, прибору или машине. Две широкие категории батарей: перезаряжаемые и неперезаряжаемые типы. Важно отметить, что батарея вырабатывает только напряжение постоянного тока, однако можно использовать инвертор для перехода на переменный ток. В этой статье мы рассмотрим один из типов аккумуляторных батарей под названием свинцово-кислотный 9.0005 аккумуляторы . Самым ранним источником электроэнергии была батарея, и на сегодняшний день это все еще популярное устройство, от которого невозможно отказаться.
Это устройство накопления энергии, которое производит электричество, подключая свои клеммы к электрическому гаджету, прибору или машине. Две широкие категории батарей: перезаряжаемые и неперезаряжаемые типы. Важно отметить, что батарея вырабатывает только напряжение постоянного тока, однако можно использовать инвертор для перехода на переменный ток. В этой статье мы рассмотрим один из типов аккумуляторных батарей под названием свинцово-кислотный 9.0005 аккумуляторы . Самым ранним источником электроэнергии была батарея, и на сегодняшний день это все еще популярное устройство, от которого невозможно отказаться.
конструкция
Как следует из названия, эта батарея изготовлена из кислого раствора, называемого электролитом, и электродов, погруженных в кислоту. Две части размещены в пластиковом корпусе, а на верхней крышке имеется вывод для доступа к раствору. Обычный используемый электролит — серная кислота, а пара электродов — свинец и оксид свинца (IV). Между кислотой и электродом происходит перезаряжаемая химическая реакция, производящая электричество. По мере развития технологий электролит представляет собой не только жидкость, но и кислая паста, такая как силикагель, также используется. Преимущество в том, что он не может легко высыпаться, и поэтому батарея не должна всегда находиться в вертикальном положении.
По мере развития технологий электролит представляет собой не только жидкость, но и кислая паста, такая как силикагель, также используется. Преимущество в том, что он не может легко высыпаться, и поэтому батарея не должна всегда находиться в вертикальном положении.
Рабочий
Для получения электрического тока, протекающего через клемму к нагрузке, должна произойти химическая реакция. Есть два состояния аккумулятора: заряженное и разряженное. Чтобы появился ток, его нужно зарядить.
Разрядка
Процесс производства тока называется разрядкой. Серная кислота реагирует с положительным анодом, изготовленным из оксида свинца, с образованием сульфата свинца и воды.
PbO 2 + SO 4 2- + 4H + + 2E — PBSO 4 + 2H 2 O
на катодном электроде-ведущем режиме с выпущенными и двумя. Свободные электроны текут от катода через подключенную цепь к клемме анода.
Pb+ SO 4 2- 4 PbSO 4 + 2e –
Анод из оксида свинца покрыт слоем сульфата свинца, который является плохим проводником. Это означает, что по мере продолжения разрядки скорость реакции снижается, и, в свою очередь, производимый ток уменьшается. Идеальное состояние полной разрядки – это когда вся кислота превратилась в воду, а все ионы сульфата прореагировали со свинцом с образованием сульфата свинца. Однако это нецелесообразно, так как перезарядка становится сложной, а иногда и вовсе невыполнимой. В качестве профилактической меры аккумулятор нельзя разряжать ниже уровня 40%.
Перезарядка
На самом деле это обратная разрядка. Происходящая химическая реакция разлагает сульфат свинца в воде на серную кислоту и оксид свинца. Для осуществления процесса между клеммами подается постоянное напряжение. Текущий ток переносит электроны, которые реагируют с сульфатом свинца на катоде с образованием свинца и серной кислоты.
Текущий ток переносит электроны, которые реагируют с сульфатом свинца на катоде с образованием свинца и серной кислоты.
PbSO 4 +2e – Pb + SO 4 2-
На анодном электроде ток разлагает молекулы воды на ионы водорода и оксида, которые реагируют с сульфатом свинца с образованием оксида свинца и серной кислоты.
Подзарядка аккумулятора делает его доступным для производства электроэнергии, что позволяет перерабатывать устройство. Полная зарядка и разрядка называются циклом. Аккумуляторы можно активно использовать около 3 лет, после чего электрод и кислота изнашиваются и требуют замены. Для силикагелевых необслуживаемых батарей батарея просто утилизируется и приобретается новая. Следует соблюдать осторожность, чтобы не допустить перезаряда аккумулятора.
Техническое обслуживание
Для обеспечения безопасности и эффективной работы необходимо соблюдать ряд правил технического обслуживания. Они включают;
Они включают;
- Защита клемм от коррозии и надежное затягивание.
- Храните батарею в хорошо проветриваемом помещении.
- Частая подзарядка аккумулятора, даже если он не используется (имеет место саморазряд)
- Долив воды при низком уровне заряда.
- Физический осмотр корпуса на наличие трещин или вздутий.
Факторы, которые следует учитывать при выборе батареи
Вам нужна батарея, круто, как выбрать ту, которая будет служить вам хорошо? Устройство поставляется во всех размерах, формах и цветах, чтобы правильно понять его, обратите внимание на следующее;
- Напряжение. Напряжение определяется количеством ячеек. Ячейка обычно имеет выходное напряжение 2,1 В, а большинство аккумуляторов имеют 6 ячеек. Наиболее распространенное номинальное напряжение составляет 12 В. есть также один с удвоенным номинальным напряжением, то есть 24 В. по мере необходимости сегодня можно найти аккумуляторы номиналом 3В, 6В, 9В и 18В.
 требование покупателя по напряжению может не дать ему ни одной батареи с таким вводом, в этом случае конфигурация производится для достижения нужного напряжения. Используется серия, параллель или их гибрид.
требование покупателя по напряжению может не дать ему ни одной батареи с таким вводом, в этом случае конфигурация производится для достижения нужного напряжения. Используется серия, параллель или их гибрид. - Емкость – указывается в ампер-часах. Например, аккумулятор емкостью 100 Ач означает, что он может обеспечивать ток 100 А в течение одного часа, прежде чем он разрядится. Чем меньше ток, потребляемый батареей, тем больше времени потребуется для ее разрядки; верно и обратное.
- Технология — перезаряжаемая и неперезаряжаемая, жидкая и гелевая, литий-ионная технология, дизайн клемм, размер и форма для различных нужд пользователей.
- Назначение- солнечная батарея, автомобиль, источник бесперебойного питания, электронное устройство или большие машины. Место установки также следует учитывать.
Приложение
Существуют миллиарды устройств, для работы которых питание постоянного тока подается от батарей. К ним относятся;
- Автомобили – для питания стартера двигателя.

- Бесперебойное электропитание критической нагрузки, напр. больничное оборудование, центр обработки данных и офисные компьютеры.
- Аккумулятор солнечной энергии для ночного использования.
- Мобильное оборудование, которое не может быть подключено к сети, т.е. развлекательные и мультимедийные автомобили.
- Система запуска дизель-генераторов электрической энергии.
Преимущества
- Мобильный
- Способен производить большой ток
- Перезаряжается после разрядки.
- Низкое номинальное напряжение.
- Доступны и доступны по цене в разных размерах.
Недостатки
- Короткий пролет – около 3-5 лет
- Ориентирован ограничен вертикальной позицией из-за риска утечки.
- Электролит вызывает коррозию
- Зарядка требует времени
- Используемые свинцовые электроды ядовиты и представляют собой проблему утилизации.
Заключение
Свинцово-кислотная батарея стала настоящим благословением в мире электротехники. Он произвел революцию в энергетике и принес эффективность, которую невозможно представить по-другому. С момента своего открытия он все еще используется. Это нужно вам, вашему рабочему столу в офисе, вашему поставщику электроэнергии, и все получают от этого выгоду. Надеюсь, что пост дал вам зеленый свет в выборе батареи. Одно предостережение; Никогда не пытайтесь закоротить клеммы аккумулятора металлическим предметом.
Он произвел революцию в энергетике и принес эффективность, которую невозможно представить по-другому. С момента своего открытия он все еще используется. Это нужно вам, вашему рабочему столу в офисе, вашему поставщику электроэнергии, и все получают от этого выгоду. Надеюсь, что пост дал вам зеленый свет в выборе батареи. Одно предостережение; Никогда не пытайтесь закоротить клеммы аккумулятора металлическим предметом.
© 2018-2023 electricmag.com
Свинцово-кислотная батарея, конструкция, работа и зарядка
Содержание
1
Свинцово-кислотная батарея Введение: Свинцово-кислотная батарея для преобразования химической энергии в электрическую энергию такой тип электрической батареи называется свинцово-кислотной батареей. Поскольку свинцово-кислотные батареи имеют более высокое напряжение и более низкую стоимость, они чаще всего используются на электростанциях и подстанциях. Прочтите мою статью о том, как сделать свой собственный большой свинцово-кислотный аккумулятор с большим ампером, в этой статье также объясняется, какие инструменты у вас должны быть и как их использовать.
Прочтите мою статью о том, как сделать свой собственный большой свинцово-кислотный аккумулятор с большим ампером, в этой статье также объясняется, какие инструменты у вас должны быть и как их использовать.
Устройства, в которых химическая энергия преобразуется в электрическую, называются электрическими элементами. Когда определенное количество этих электрических элементов электрически соединены последовательно и параллельно, это образует батарею. В основном каждая электрическая ячейка состоит из двух разных или непохожих проводников, погруженных в проводящий раствор. Итак, электрическая батарея — это такой тип электрохимического устройства, которое преобразует химические реакции, происходящие между электрическими элементами, в электрическую энергию. Аккумулятор может иметь один или несколько гальванических элементов с внешними соединениями, называемыми электродами, для питания электрических устройств, таких как ИБП, мобильные телефоны, фонарики, электромобили и т. д. Электроды обычно отмечены знаками + и –.
д. Электроды обычно отмечены знаками + и –.
Без дальнейших промедлений приступим!!!
Батареи, доступные на Amazon:Служные кислотные аккумуляторы «Маленькие»
Крупные свинцовые кислотные батареи
Амерометр для свинцовой кислотной батареи
Электролит свинцовой кислоты
Сухие батареи
ИДИТЕЛЬНЫЕ И КОМПОНТЫ: 9
и компоненты: 9
и компоненты:
и компоненты:
Суперстартовый набор для начинающих
Цифровые осциллографы
Переменный источник питания
Цифровой мультиметр
Наборы паяльников
Небольшие переносные дрели для печатных плат
*Обратите внимание: это партнерские ссылки. Я могу получить комиссию, если вы купите компоненты по этим ссылкам. Я был бы признателен за вашу поддержку на этом пути!
Типы батарей:Обычно существует два типа батарей
- Основная батарея
- Дополнительная батарея
Я уже очень подробно рассказал о первичных и вторичных батареях. Вы обязательно должны прочитать эту статью.
Вы обязательно должны прочитать эту статью.
Свинцово-кислотный элемент был изобретен в 1859 году французским физиком Гастоном Планте и является первым типом аккумуляторной батареи. Несмотря на очень низкое отношение энергии к весу и низкое отношение энергии к объему, его способность обеспечивать высокие импульсные токи означает, что элементы имеют относительно большое отношение мощности к весу. Эти функции, наряду с их низкой стоимостью, делают их привлекательными для использования в автомобилях для обеспечения высокого тока, необходимого для стартеров.
Пластина +ve ячейки для хранения свинцовой кислоты изготовлена из перекиси свинца (PbO2), а отрицательная пластина изготовлена из губчатого свинца, т.е. Pb. В качестве электролита используется легкая серная кислота. Когда Свинцово-кислотный элемент подает ток на нагрузку или Свинцово-кислотный элемент разряжается, происходит химическая реакция, в результате которой на обеих пластинах образуется сульфат свинца, а электролит превращается в воду. После процесса разряда обе пластины превращаются в материал одного типа, из-за чего батарея не может вырабатывать достаточное напряжение для питания электрических нагрузок.
После процесса разряда обе пластины превращаются в материал одного типа, из-за чего батарея не может вырабатывать достаточное напряжение для питания электрических нагрузок.
Теперь для зарядки свинцово-кислотного элемента подается ток в противоположном направлении, таким образом химическая реакция меняется на противоположную, и снова положительная пластина становится перекисью свинца, а отрицательная пластина становится чистым свинцом, во время того же процесса электролит также восстанавливается, т.е. электролит становится серной кислотой.
Химическая реакция зарядки и разрядки свинцово-кислотного элемента может быть записана как.
Чтение приведенного выше уравнения слева направо представляет действие разрядки элемента, а чтение того же уравнения справа налево представляет действие зарядки элемента. При разрядке элемента перекись свинца, свинец и серная кислота вступают в химическую реакцию и превращаются в сульфат свинца и воду. Во время зарядки элемента сульфат свинца снова превращается в пероксид свинца, свинец и серную кислоту.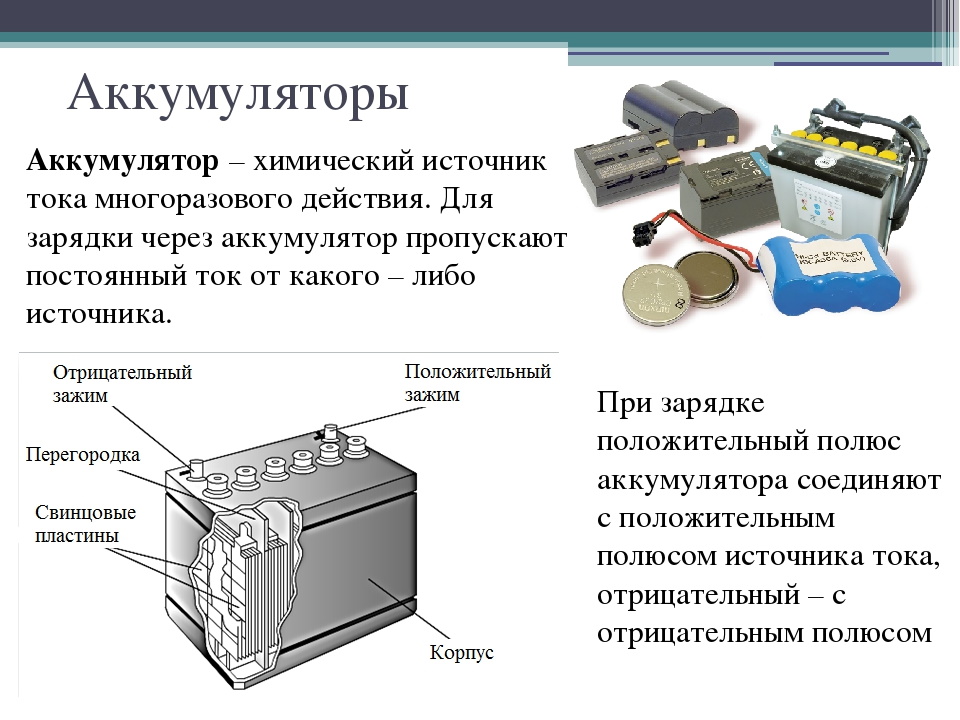 Среднее напряжение на клеммах свинцово-кислотного аккумулятора составляет примерно 2,2 В.
Среднее напряжение на клеммах свинцово-кислотного аккумулятора составляет примерно 2,2 В.
Принцип работы свинцово-кислотного элемента можно объяснить с помощью простого эксперимента.
Как видно на схеме выше, две свинцовые полоски погружены в разбавленную серную кислоту с удельным весом примерно равным 1.200. Одна свинцовая полоса является положительной пластиной, а другая свинцовая полоса — отрицательной. Эти положительные и отрицательные пластины соединены последовательно с лампой. Пластины и лампа подключены к внешнему источнику постоянного тока 115 В. Когда источник питания постоянного тока включен, начинает течь электрический ток, из-за которого полоски или электроды начинают производить лампочки. Через некоторое время цвет одной из пластин станет темно-шоколадным, а цвет другой пластины останется таким же, но если вы обратите внимание, то обнаружите, что твердая свинцовая поверхность другой пластины теперь превращается в губчатую.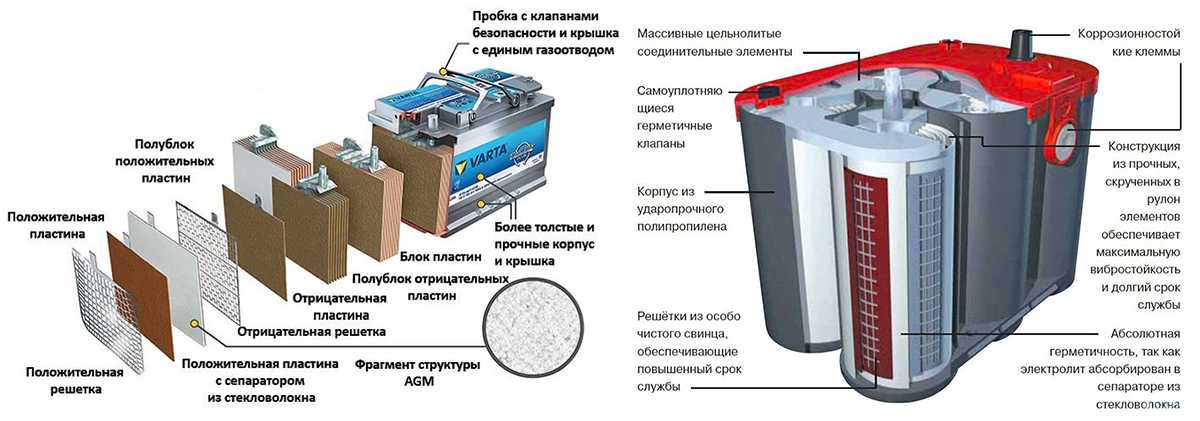 вести.
вести.
Когда на элемент подается питание, он начинает заряжаться, и вольтметр показывает приблизительно 2,5 вольта. Но когда ячейка начинает разряжаться, напряжение на ячейке падает примерно до 1,75 В, это падение напряжения ускоряется, и вскоре вольтметр показывает ноль на циферблате, а пластинка темно-коричневого шоколадного цвета превращается в пластину светлого цвета и вскоре сохраняет свой цвет. оригинальный цвет.
Пластина из темного шоколада является положительной пластиной или катодом. Пластина, которая частично превращается в губчатый свинец, является отрицательной пластиной или анодом. Большинство пузырьков производится отрицательной пластиной, которая представляет собой газообразный кислород. В элементах этого типа при протекании тока металлический свинец превращается в перекись свинца, в то время как в отрицательной пластине не происходит никаких химических изменений. Отрицательная пластина меняет форму с твердой на губчатую. Когда ячейка вырабатывает электрический ток, перекись положительной пластины превращается в сульфат свинца, а губчатый свинец также превращается в сульфат свинца, поэтому электрохимически обе пластины становятся одинаковыми.
Итак, так как обе пластины электрохимически одинаковы, напряжение не вырабатывается и элементы разряжаются. Опять же, в процессе зарядки электрический ток преобразует положительную пластину в пероксид, а отрицательную пластину — в губчатый свинец, таким образом, обе пластины становятся неодинаковыми, из-за чего создается напряжение, это напряжение составляет около 2,05. В процессе зарядки клеммы аккумулятора должны иметь напряжение 2,50 В для контроля внутреннего сопротивления и поляризации. Помните, что когда батарея заряжается, единственное изменение в электролите заключается в том, что вода в батарее начинает превращаться в серную кислоту, таким образом, из-за зарядки батареи увеличивается удельный вес. При разрядке элемента перекись свинца, свинец и серная кислота вступают в химическую реакцию и превращаются в сульфат свинца и воду, а удельный вес электролита снижается. В процессе зарядки отрицательная пластина вырабатывает водород, а положительная — кислород. Поскольку водород легко воспламеняется, во время зарядки держите его подальше от огня.
Как известно, свинцово-кислотная аккумуляторная батарея изготавливается путем последовательного или параллельного соединения нескольких свинцово-кислотных элементов. Емкость свинцово-кислотной аккумуляторной батареи зависит от количества используемых свинцово-кислотных элементов. Любой свинцово-кислотный аккумулятор нестандартного размера может быть изготовлен, если вы знаете о соединениях.
Свинцово-кислотный аккумулятор состоит из двух основных частей.
- контейнер и
- пластины
Поскольку этот контейнер для аккумулятора в основном содержит серную кислоту в качестве электролита, материалы, используемые для изготовления контейнера для свинцово-кислотного аккумулятора, должны быть устойчивы к серной кислоте. Материал контейнера также не должен содержать примесей, вредных для серной кислоты. Особенно железо и марганец непереносимы. Вот почему контейнер свинцово-кислотного аккумулятора обычно изготавливается из дерева, облицованного свинцом, стекла, эбонита, твердой резины из битумного компаунда, керамических материалов и формованных пластиковых деталей. любого из этих материалов. Контейнер плотно закрывается верхней крышкой. В верхней крышке имеется три отверстия, по одному на каждом конце для стоек и одно посередине для вентиляционной пробки, через которые заливается электролит и выходят газы.
Особенно железо и марганец непереносимы. Вот почему контейнер свинцово-кислотного аккумулятора обычно изготавливается из дерева, облицованного свинцом, стекла, эбонита, твердой резины из битумного компаунда, керамических материалов и формованных пластиковых деталей. любого из этих материалов. Контейнер плотно закрывается верхней крышкой. В верхней крышке имеется три отверстия, по одному на каждом конце для стоек и одно посередине для вентиляционной пробки, через которые заливается электролит и выходят газы.
Имеются два ребра для удержания положительных пластин свинцово-кислотного аккумулятора внутри нижней части контейнера свинцово-кислотного аккумулятора и два других ребра для удержания отрицательных пластин. Ребра или призмы служат опорами для пластин, защищая их от короткого замыкания, которое в противном случае могло бы произойти в результате схлопывания активного материала с пластин на дно контейнера.
Пластины для свинцово-кислотных аккумуляторов: Пластины для свинцово-кислотных аккумуляторов имеют разнообразную конструкцию, и все они состоят из своего рода сетки, состоящей из свинца и активного материала.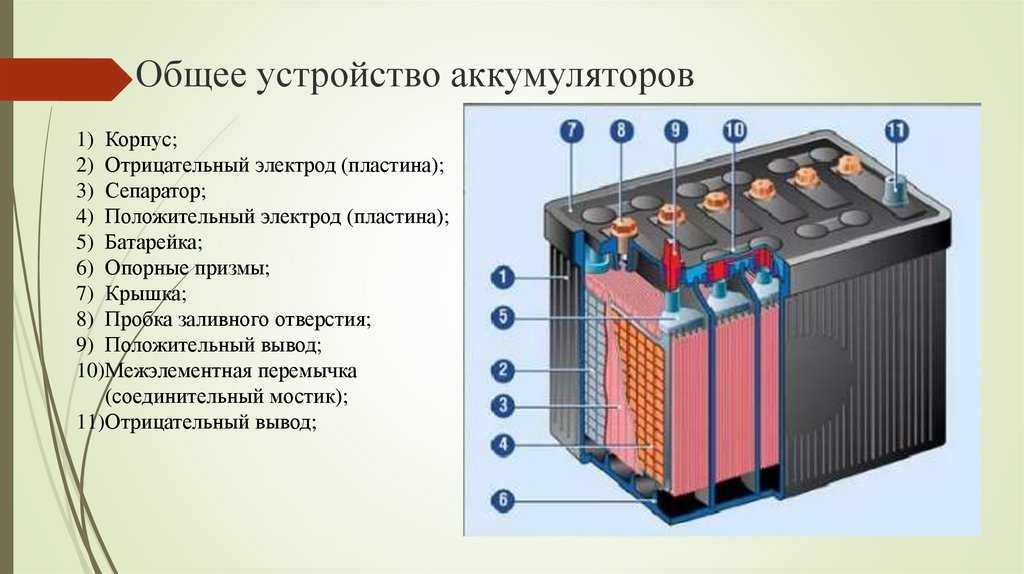 Сетка необходима, если электрический ток должен быть проведен и ток должен быть равномерно распределен по активному материалу. Если ток распределяется неравномерно, активный материал разрыхляется и выпадает.
Сетка необходима, если электрический ток должен быть проведен и ток должен быть равномерно распределен по активному материалу. Если ток распределяется неравномерно, активный материал разрыхляется и выпадает.
Все пластины соединены в положительную и отрицательную группы, чтобы можно было легко выполнить окончательные соединения. Отрицательных пластин больше, чем положительных. Как видно на схеме выше, каждая положительная пластина зажата между двумя отрицательными пластинами, это сделано для того, чтобы химическая реакция могла происходить с обеих сторон положительных пластин. Это также защищает пластины от коробления. Между положительной и отрицательной пластинами размещаются разделители, изготовленные из дерева, резины или стекломата, которые защищают положительные и отрицательные пластины от физического контакта.
Одна сторона разделителя гладкая, а другая сторона с рифлением. Сторона с канавками прилегает к положительной стороне пластины, чтобы раствор электролита мог легко перемещаться, так как большая часть химической реакции происходит на этой стороне.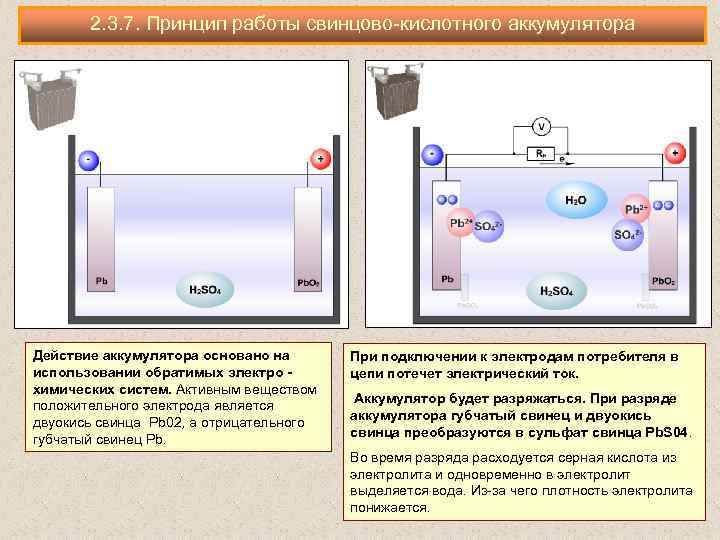
Пластины для свинцово-кислотных аккумуляторов двух типов
- Формованные пластины или пластины Планте
- Вклеенные или накладные пластины.
Плиты Планте используются в основном для стационарных батарей, так как они имеют больший вес и более дорогие, чем вклеенные плиты. Но пластины более долговечны и с меньшей вероятностью теряют активный материал при быстрой зарядке и разрядке. Пластина плантеса имеет малую удельную массу.
Процесс Фора больше подходит для изготовления негативных пластин, чем позитивных. Отрицательное активное вещество/материал довольно прочное и подвергается сравнительно небольшим изменениям при зарядке и разрядке.
- Положительная пластина
- Отрицательная пластина
- Сепараторы
- Электролит
- Элемент
- Крышки ячеек и вентиляционные заглушки
- Клеммы аккумулятора
- Соединители для ячеек
- Контейнер
Решетки содержат сплав свинца и сурьмы.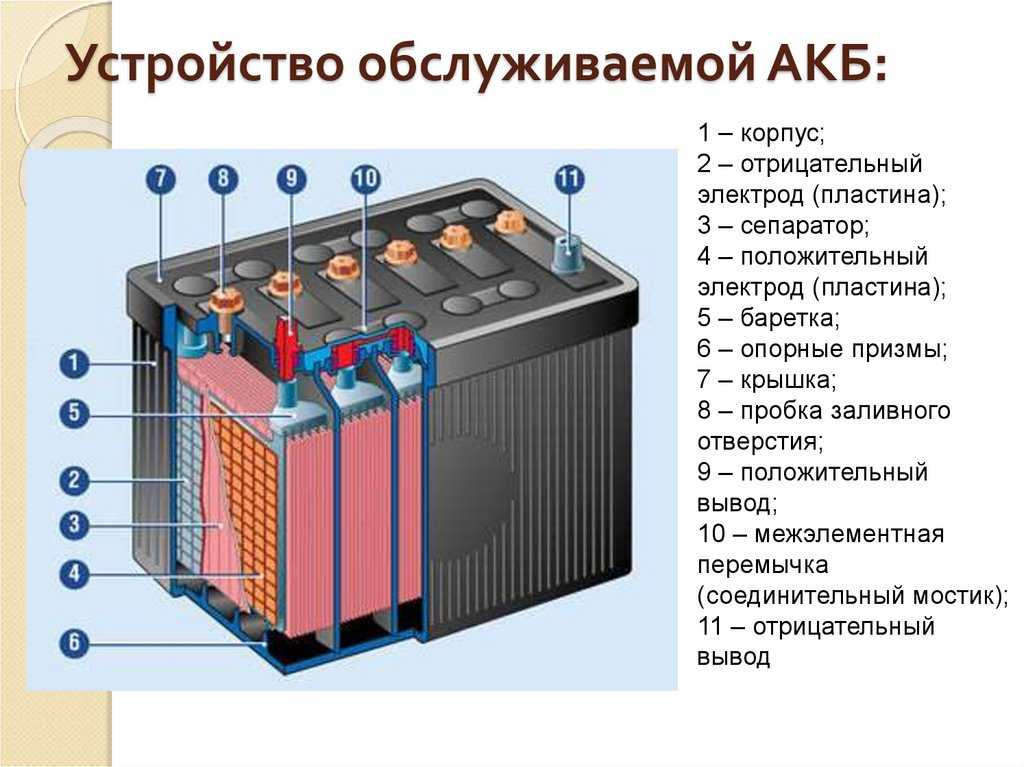 Обычно их делают с поперечным ребром, пересекающим места под прямым углом или по диагонали. Сетка для положительных и отрицательных пластин имеет одинаковую конструкцию, но сетки для отрицательных пластин сделаны более легкими, поскольку они не так критичны для равномерной проводимости тока.
Обычно их делают с поперечным ребром, пересекающим места под прямым углом или по диагонали. Сетка для положительных и отрицательных пластин имеет одинаковую конструкцию, но сетки для отрицательных пластин сделаны более легкими, поскольку они не так критичны для равномерной проводимости тока.
Сепараторы размещаются между положительной и отрицательной пластинами, эти разделители изготовлены из дерева, резины или стеклянного мата, который защищает положительные и отрицательные пластины от физического контакта. Одна сторона сепаратора гладкая, а другая сторона сепаратора рифленая. Сторона с канавками прилегает к положительной стороне пластины, так что раствор электролита может легко перемещаться, так как большая часть химической реакции происходит на этой стороне.
Электролит: Разбавленная серная кислота h3SO4 используется в качестве электролита. Он содержит только 31% серной кислоты. Я уже объяснял это очень подробно с помощью химического уравнения.
В любой ячейке совокупность положительных и отрицательных пластин называется элементом.
Контейнер, крышки ячеек и вентиляционные заглушки:Контейнер для батареи я уже объяснил выше.
Клеммы аккумулятора:Каждая свинцово-кислотная батарея снабжена двумя клеммами, которые называются клеммами батареи. Эти клеммы аккумулятора отмечены знаками + и –. Клемма +Ve обычно больше, чем отрицательная клемма.
Соединители ячеек:Соединители ячеек используются для последовательного соединения отдельных ячеек для получения желаемого напряжения.
Зарядка свинцово-кислотного аккумулятора: Новый или разряженный свинцово-кислотный аккумулятор заряжается с помощью зарядного устройства постоянного тока, подаваемое напряжение превышает напряжение аккумулятора. Процесс зарядки продолжается до тех пор, пока батарея не будет полностью заряжена.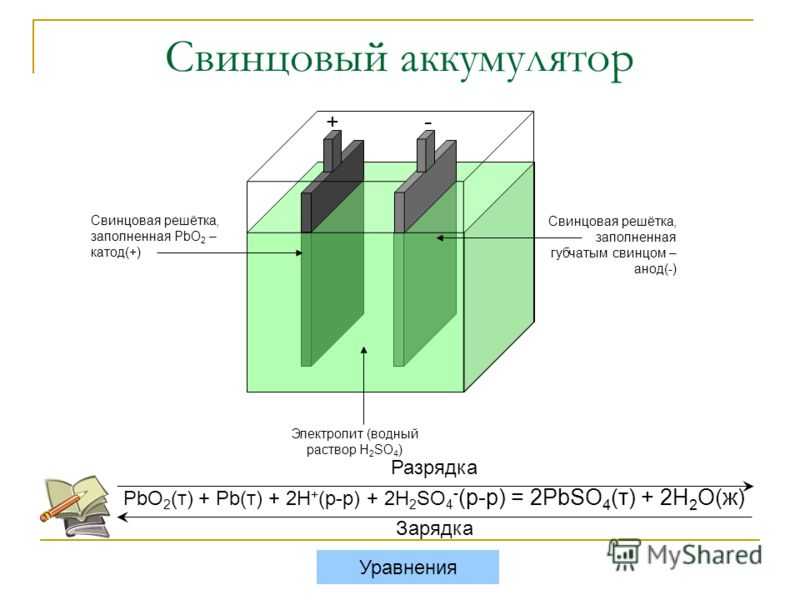 Ток будет течь через батарею в направлении, обратном тому, когда она подает ток, и батарея будет заряжаться. Положительная и отрицательная клеммы батареи соединены с положительной и отрицательной клеммами источника питания постоянного тока. Дважды проверьте положительный и отрицательный провода источника питания постоянного тока перед зарядкой аккумулятора.
Ток будет течь через батарею в направлении, обратном тому, когда она подает ток, и батарея будет заряжаться. Положительная и отрицательная клеммы батареи соединены с положительной и отрицательной клеммами источника питания постоянного тока. Дважды проверьте положительный и отрицательный провода источника питания постоянного тока перед зарядкой аккумулятора.
При первой зарядке аккумулятора используйте электролит низкой плотности и медленно заряжайте аккумулятор. Ионы h3 притягиваются к катоду, а ионы SO4 движутся к аноду. Как вы можете видеть на картинке ниже.
Во время зарядки происходят следующие изменения:
- Цвет анода меняется на цвет темного шоколада, а цвет катода меняется на серый.
- Удельный вес серной кислоты увеличен с 1,18 до 1,27.
- Напряжение ячейки увеличено с 1,8 В до 2,3 В.
- Клетка начинает поглощать энергию.
- Когда зарядка завершена, ячейка начинает производить газ.

Для зарядки аккумулятора электрическое напряжение генератора или зарядного устройства должно быть как минимум на 25 % выше, чем напряжение аккумулятора. Допустим, для 12-вольтовой батареи напряжение зарядного устройства должно быть 15 вольт. Аккумулятор не следует заряжать большим током, так как это может привести к повреждению аккумулятора. Однако после полной зарядки аккумулятора важно не продолжать зарядку, так как это приведет к повреждению аккумулятора. Контроллер заряда необходим для того, чтобы батарея не перезаряжалась. Большинство аккумуляторов повреждаются из-за перезарядки, обычно это происходит при зарядке аккумуляторов с помощью солнечных батарей. Что люди обычно и делают, так это просто подключают солнечные панели к аккумулятору и не используют контроллер заряда солнечной батареи.
Контроллер заряда или регулятор заряда — это, по сути, регулятор напряжения или тока для предотвращения перезарядки батарей. Он регулирует напряжение и ток от солнечных панелей, идущих к аккумулятору. Большинство 12-вольтовых панелей выдают от 16 до 20 вольт или даже больше, поэтому, если нет регулирования, батареи будут повреждены из-за перезарядки, поскольку большинству батарей требуется от 14 до 14,5 вольт для полной зарядки. Если вы планируете использовать солнечную панель, то покупка солнечного контроллера заряда должна быть первоочередной задачей. У меня есть очень подробная статья об этом; вам обязательно нужно прочитать эту статью.
Большинство 12-вольтовых панелей выдают от 16 до 20 вольт или даже больше, поэтому, если нет регулирования, батареи будут повреждены из-за перезарядки, поскольку большинству батарей требуется от 14 до 14,5 вольт для полной зарядки. Если вы планируете использовать солнечную панель, то покупка солнечного контроллера заряда должна быть первоочередной задачей. У меня есть очень подробная статья об этом; вам обязательно нужно прочитать эту статью.
Перед зарядкой аккумулятора необходимо проверить удельный вес электролита, если удельный вес кислоты меньше 1,175, то электролит следует заменить. Вентиляционные пробки должны быть удалены во время зарядки аккумулятора, чтобы мог выйти газообразный водород, образующийся в процессе зарядки.
Методы зарядки аккумуляторов:- Метод постоянного тока
- Метод постоянного потенциала
Свинцово-кислотный аккумулятор не обеспечивает 100-процентную эффективность хранения электроэнергии — вы никогда не получите столько энергии, сколько вложили при зарядке.